IMIDAZOLES QUE BLOQUEAN A LOS RECEPTORES DE ANGIOTENSINA II.
LOS IMIDAZOLES SUSTITUIDOS, POR EJEMPLO LOS DE FORMULA (I), SON UTILES COMO AGENTES DE BLOQUEO DE LA ANGIOTENSINA II.
ESTOS COMPUESTOS SON ACTIVOS PARA EL TRATAMIENTO DE LA HIPERTENSION Y DEL FALLO CARDIACO POR CONGESTION.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E87109919.
Solicitante: DUNCIA, JOHN JONAS VYTAUTAS.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1007 MARKET STREET,WILMINGTON DELAWARE 19898.
Inventor/es: CARINI, DAVID JOHN, DUNCIA, JOHN JONAS VYTAUTAS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4164 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,3-Diazoles.
- A61P9/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
- C07D233/54 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 233/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,3 o diazol-1,3 hidrogenado, no condensados con otros ciclos. › que tienen dos enlaces dobles entre miembros cíclicos o entre miembros cíclicos y miembros no cíclicos.
- C07D233/68 C07D 233/00 […] › Atomos de halógenos.
- C07D233/70 C07D 233/00 […] › Un átomo de oxígeno.
- C07D233/84 C07D 233/00 […] › Atomos de azufre.
- C07D233/90 C07D 233/00 […] › Atomos de carbono que tienen 3 enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo.
- C07D233/92 C07D 233/00 […] › unidos en posición 4 ó 5.
- C07D403/06 C07D […] › C07D 403/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos por el grupo C07D 401/00. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
- C07D403/10 C07D 403/00 […] › unidos por una cadena de carbono que contiene ciclos aromáticos.
- C07D403/14 C07D 403/00 […] › que contiene tres o más heterociclos.
- C07D405/10 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos por una cadena de carbono que contiene ciclos aromáticos.
- C07D409/10 C07D […] › C07D 409/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de azufre como únicos heteroátomos del ciclo. › unidos por una cadena de carbono que contiene ciclos aromáticos.
- C07D521/00 C07D […] › Compuestos heterocíclicos que contienen heterociclos no especificados.
- C07F9/6506 C07 […] › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 9/00 Compuestos que contienen elementos de los grupos 5 o 15 del sistema periódico. › cuyos átomos de nitrógeno están en posiciones 1 y 3.
PDF original: ES-2063734_T3.pdf
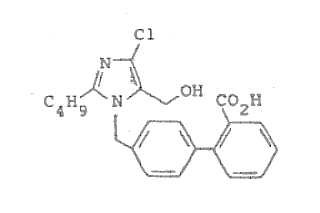
Fragmento de la descripción:
Imidazoles bloqueantes de receptores de angiotensina II.
Antecedentes de la invención
Esta invención se refiere a nuevos imidazoles sustituidos y procedimientos para su preparación, composiciones farmacéuticas que los contienen y procedimientos farmacéuticos para utilizarlos.
Los compuestos de esta invención inhiben la acción de la hormona angiotensina II (AII) y, por lo tanto, son útiles para aliviar la hipertensión inducida por angiotensina. La enzima renina actúa sobre una
K. Matsumura et al., en la patente estadounidense 4.207.324, publicada el 10 de junio de 1980, describen derivados de ácido 1,2-disustituido-4-haloimidazol-5-acético de fórmula:
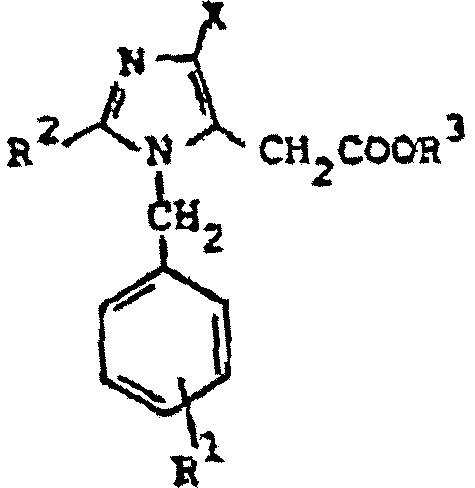
donde R1 es hidrógeno, nitro o amino; R2 es fenilo furilo o tienilo opcionalmente sustituido con halógeno, alquilo inferior, alcoxi inferior o di-alquilamino inferior; R3 es hidrógeno o alquilo inferior y X es halógeno; y sus sales fisiológicamente aceptables. Estos compuestos tienen acciones diuréticas e hipotensoras.
Furukawa et al., en la patente estadounidense 4.355.040, publicada el 19 de octubre de 1982, describe derivados hipotensores de ácido imidazol-5-acético que tienen la fórmula:
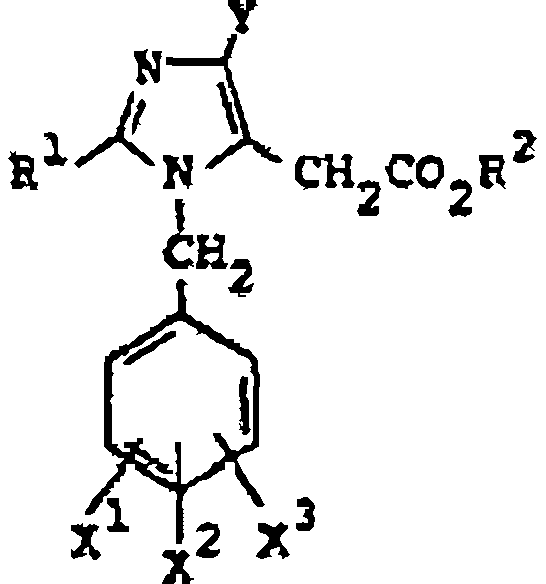
donde R1 es alquilo inferior, cicloalquilo o fenilo opcionalmente sustituido; X1, X2 y X3 son cada uno de ellos hidrógeno, halógeno, nitro, amino, alquilo inferior, alcoxi inferior, benciloxi o hidroxi; Y es halógeno y R2 es hidrógeno o alquilo inferior; y sus sales.
Furukawa et al., en la patente estadounidense 4.340.598, publicada el 20 de julio de 1982, describe derivados hipotensores de imidazol de fórmula:
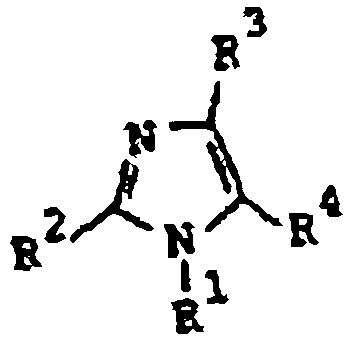
donde R1 es alquilo inferior o fenil-alquilo de C1-2 opcionalmente sustituido con halógeno o nitro; R2 es alquilo inferior, cicloalquilo o fenilo opcionalmente sustituido; uno entre R3 y R4 es -(CH2)nCOR5, donde R5 es amino, alcoxi inferior o hidroxilo y n es 0, 1, 2 y el otro entre R3 y R4 es hidrógeno o halógeno; con la condición de que R1 es alquilo inferior o fenetilo cuando R3 sea hidrógeno, n=1 y R5 es alcoxi inferior o hidroxilo; y sus sales.
Furukawa et al., en la solicitud de patente europea 103.647, describe derivados de ácido 4-cloro-2-fenilimidazol-5-acético útiles para tratar edemas e hipertensión, de fórmula:
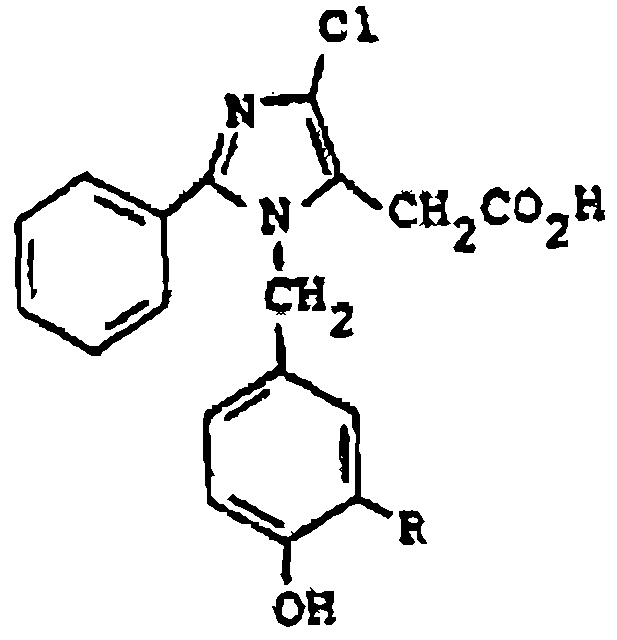
donde R representa alquilo inferior, y sus sales.
El metabolismo y disposición del agente hipotensor ácido 4-cloro-1-(4-metoxi-3-metilbencil)-2-fenil-imidazol-5-acético se describe por H. Torii en Takeda Kenkyushoho, 41, nº 3/4, 180-191 (1982).
Frazee et al., en la solicitud de patente europea 125.033-A describe derivados de 1-fenil(alquil)-2-tioimidazol que son inhibidores de dopamina-β-hidroxilasa y son útiles como hipotensores, diuréticos y cardiotónicos.
La solicitud de la patente europea 146.228, presentada el 16 de octubre de 1984, por S.S.L. Parhi, describe un procedimiento para la preparación de 1-sustituidos-5-hidroximetil-2-mercaptoimidazoles.
Un cierto número de referencias describe 1-bencil-imidazoles tales como la patente estadounidense 4.448.781 de Cross y Dickinson (publicada el 15 de mayo de 1984); la patente estadounidense 4.226.878 de Ilzuka et al (publicada el 7 de octubre de 1980); la patente estadounidense 3.772.315 de Regel et al. (publicada el 13 de noviembre de 1973); la patente estadounidense 4.379.927 de Vorbrüggen et al. (publicada el 12 de abril de 1983); entre otras.
Pals et al., Circulation Research, 29, 673 (1971) describen la introducción de un residuo de sarcosina en posición 1 y de alanina en posición 8 de la hormona vosoconstrictora endógena AII para producir un (octa)péptido que bloquea los efectos de AII sobre la presión sanguínea de ratas sin médula espinal. Este análogo [Sar1, Ala8] AII, que inicialmente se denominó "P-113" y posteriormente "Saralasina", se encontró que era uno de los antagonistas competitivos más potentes de las acciones de AII, aunque, como la mayor parte de los denominados antagonistas de péptidos-AII, posee también acciones agonistas por sí mismo. Se ha demostrado que la saralasina rebaja la presión arterial en mamíferos y el hombre cuando la presión (elevada) depende de AII en circulación (Pals et al., Circulation Research, 29, 673 (1971); Streeten and Anderson, Handbook of Hypertension, Vol. 5, Clinical Pharmacology of Antihypertensive Drugs, A. E. Doyle (Editor), Elsevier Science Publishers B.V. pag. 246 (1984)). Sin embargo, debido a su carácter agonista, la saralasina provoca efectos presores cuando la presión no es sostenida por AII. Siendo un péptido, los efectos farmacológicos para la sarasalina son de duración relativamente corta y solamente se manifiestan después de administración parenteral, siendo ineficaces las dosis orales. Aunque los usos terapéuticos de los bloqueantes de péptido AII, como saralasina, están severamente limitados debido a su ineficacia oral y de corta duración de acción, su principal utilidad es como un patrón farmacéutico.
El documento EP-A-0028834 describe derivados de ácido 1-bencil-imidazol-5-acético que tienen efecto antagonista sobre angiotensina II y actividad hipotensora.
Sumario de la invención
Según la presente invención, se proporcionan nuevos compuestos de fórmula (I) que tienen propiedades antagonizantes de angiotensina II y son útiles como antihipertensores.
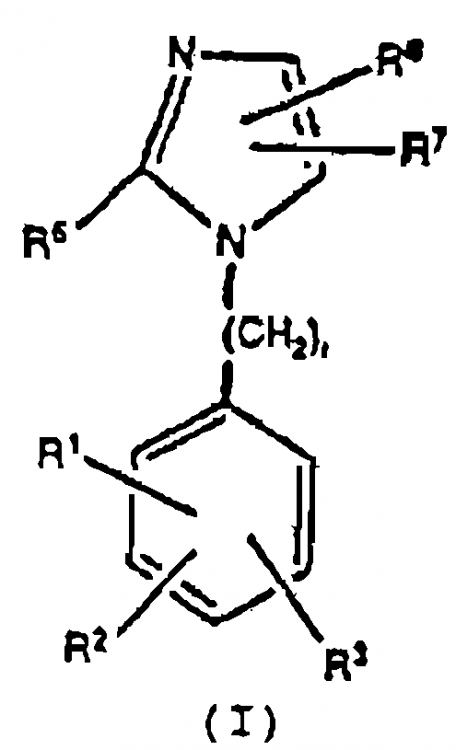
en la cual
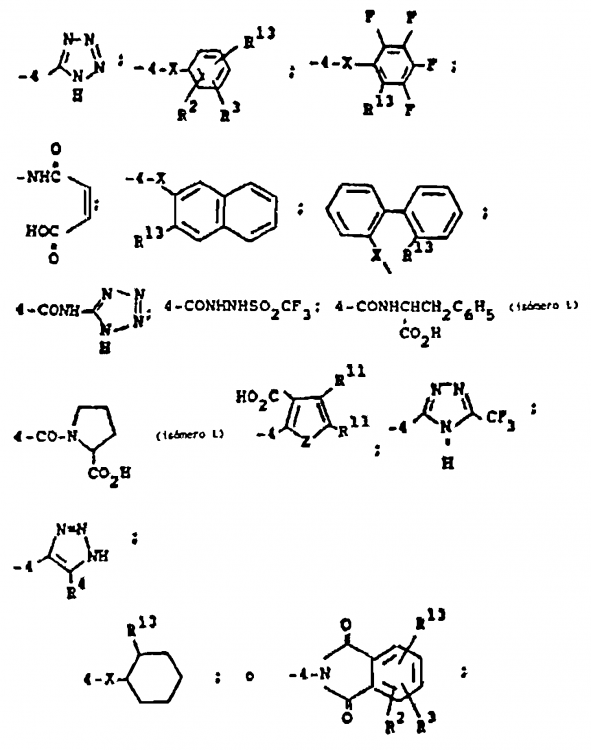
Reivindicaciones:
1. Un compuesto antihipertensor de la fórmula:
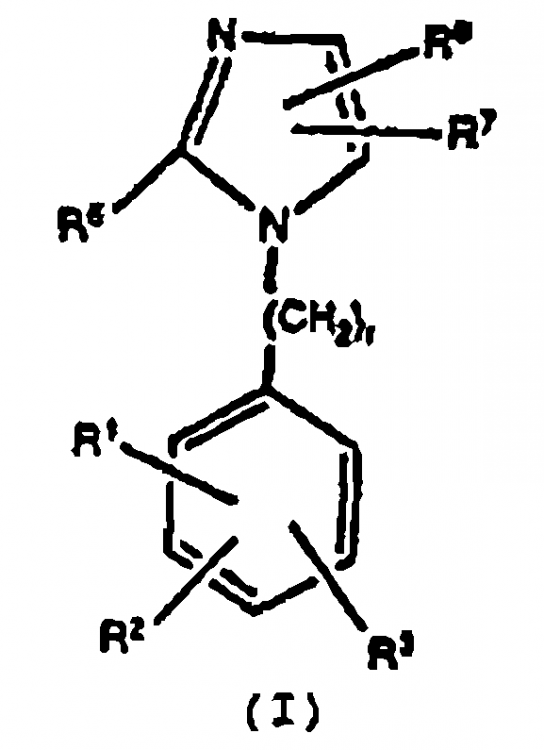
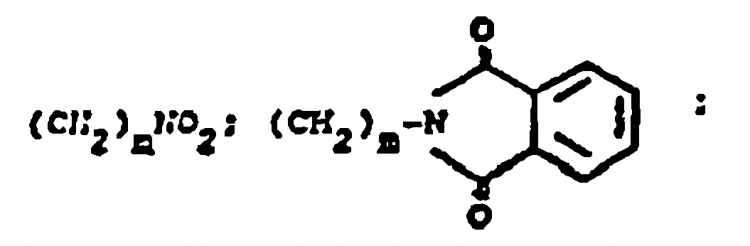
en la cual

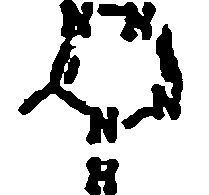
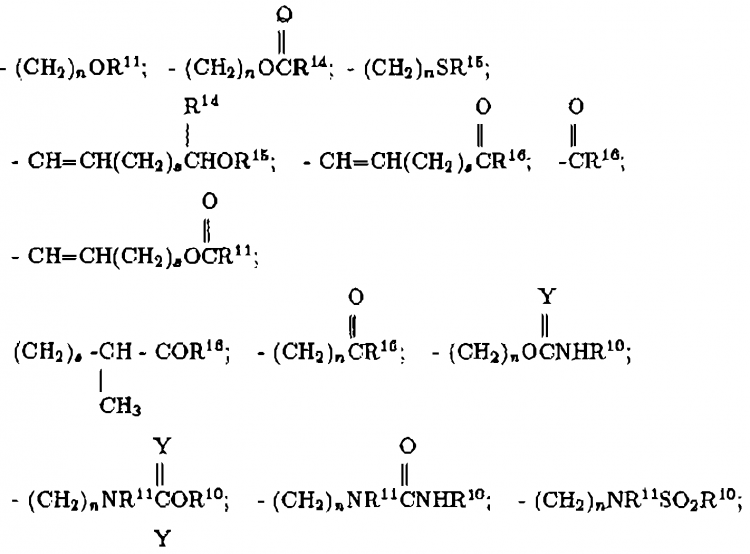
R18 y R19 son independientemente H, alquilo de 1 a 4 átomos de carbono, fenilo, bencilo, α-metilbencilo, o tomados conjuntamente forman un anillo de fórmula
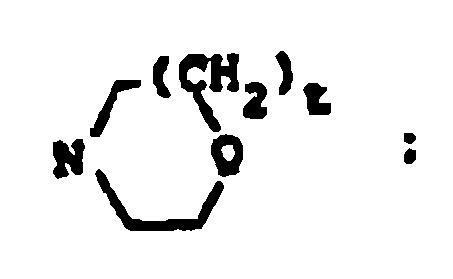
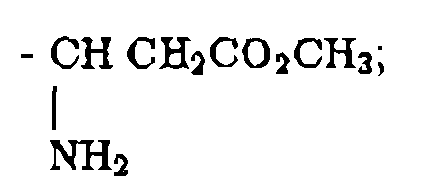
R22 y R23 son independientemente H, alquilo de 1 a 6 átomos de carbono, bencilo o se toman conjuntamente como (CH2)u, donde u es 3-6;
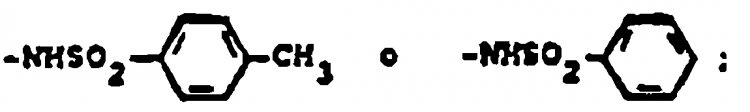
R27 y R28 son independientemente hidrógeno, alquilo con 1 a 5 átomos de carbono, o fenilo;
R29 y R30 son independientemente alquilo de 1-4 átomos de carbono o tomados conjuntamente son -(CH2)q-;
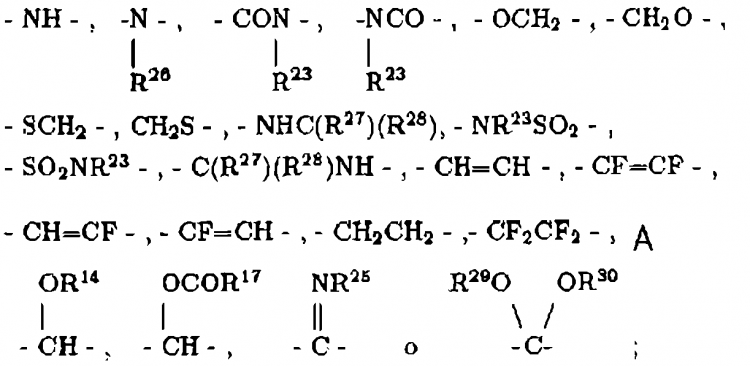
y sales farmacéuticamente aceptables de estos compuestos; con la condición de que:
2. Un compuesto según la reivindicación 1 que tiene la fórmula:
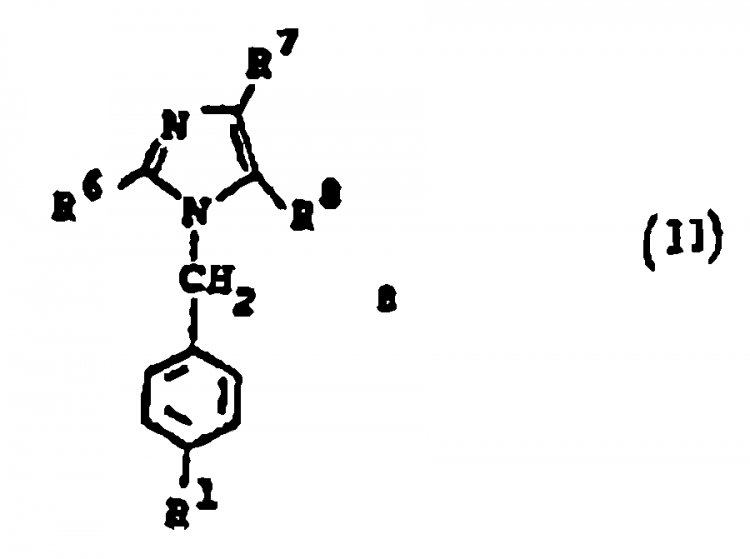
en la cual

y sales farmacéuticamente aceptables de estos compuestos.
3. Un compuesto según la reivindicación 2 en el que:
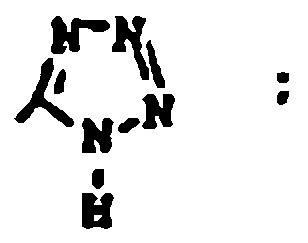
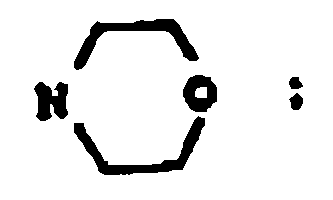
y sales farmacéuticamente aceptables.
4. Los compuestos según las reivindicaciones 1 a 3, seleccionados entre 2-butil-4-cloro-1-[(2'-(1H-tetrazol-5-il)bifenil-4-il)metil]-5-(hidroximetil)imidazol, o una sal farmacéuticamente aceptable del mismo;
2-butil-4-cloro-1-[(2'-carboxibifenil-4-il)metil]-5-(hidroximetil)imidazol o una sal farmacéuticamente aceptable del mismo;
2-butil-4-cloro-1-[(2'-carboxibifenil-4-il)metil]-5-[(metoxicarbonil)aminometil]imidazol o una sal farmacéuticamente aceptable del mismo;
2-butil-4-cloro-1-[(2'-carboxibifenil-4-il)metil]-5-[(propoxicarbonil)aminometil]imidazol o una sal farmacéuticamente aceptable del mismo;
2-butil-4-cloro-1-[(2'-carboxibifenil-4-il)metil]imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo;
2-butil-1-[(2'-carboxibifenil-4-il)metil]imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo;
2-(1E-butenil)-4-cloro-1-[(2'-carboxibifenil-4-il)metil]-5-(hidroximetil)imidazol, o una sal farmacéuticamente aceptable del mismo;
2-(1E-buteni1)-4-cloro-1-[(2'-carboxibifenil-4-il)metil]imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo;
2-propi1-4-cloro-1-[2'-(1H-tetrazol-5-il)bifenil-4-il)metil]-5-(hidroximetil)imidazol, o una sal farmacéuticamente aceptable del mismo;
2-propil-4-cloro-1-[2'-(1H-tetrazol-5-il)bifenil-4-il)metil]imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo;
2-butil-4-cloro-1-[2'-(1H-tetrazol-5-il)bifenil-4-il)metil)imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo;
2-(1E-butenil)-4-cloro-1-[2'-(1H-tetrazol-5-il)bifenil-4-il)metil]-5-hidroximetil)imidazol, o una sal farmacéuticamente aceptable del mismo; y
2-(1E-butenil)-4-cloro-1-[2'-(1H-tetrazol-5-il)bifenil-4-il)metil]-imidazol-5-carboxaldehído, o una sal farmacéuticamente aceptable del mismo.
5. Una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable y al menos un compuesto de las reivindicaciones 1 a 4.
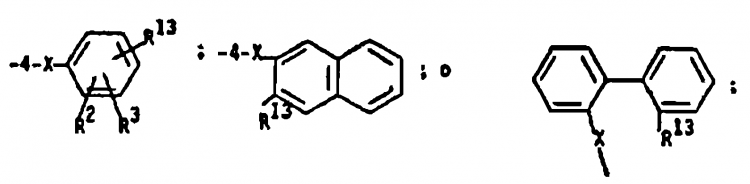
6. Un procedimiento para la preparación de un compuesto de reivindicaciones 1 a 4 en el que r es 1 el cual comprende poner en contacto un derivado de imidazol de Fórmula 1 con un derivado de bencilo de Fórmula 2 en un disolvente en presencia de una base durante de aproximadamente 1 a aproximadamente 10 horas a un temperatura en el intervalo de aproximadamente 20ºC a la temperatura de reflujo del disolvente para formar un bencilimidazol de Fórmula 3:

en la que cada uno de R1, R2, R3, R6, R7 y R8 es estable bajo las condiciones de reacción y es un grupo como se define en la reivindicación 1 o un intermedio o forma protegida del mismo el cual se puede transformar a un grupo tal y en el que X1 es halógeno, p-toluenosulfoniloxi o metilsulfoniloxi; y a partir de entonces según sea necesario trans- formar dichas formas intermedias o protegidas de los grupos R a los grupos R como se definen en la reivindicación 1.
7. Procedimiento según la reivindicación 6 en el que los compuestos 1 y 2 se ponen en contacto en presencia de una base seleccionada del grupo que consta de un hidruro metálico, MH, un alcóxido metálico, MOR, carbonato sódico, carbonato potásico, trietilamina y piridina, en un disolvente aprótico dipolar o, donde la base es MOR, el disolvente puede ser un alcohol, ROH, donde M es litio, sodio o potasio y R es metilo, etilo o t-butilo.
8. Procedimiento de la reivindicación 6, en el que: R1 es
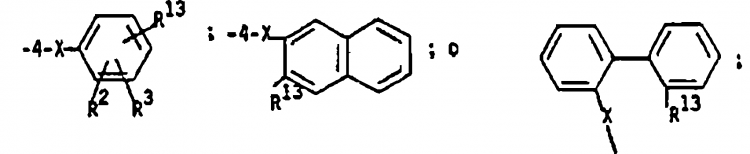
R2 y R3 son cada uno de ellos independientemente H, Cl, Br, I, CO2R14, F, NO2, alquilo de 1 a 4 átomos de carbono, alcoxi de 1 a 4 átomos de carbono, arilo o furilo;
R6 y R7 son como se definen en la reivindicación 1;
R14 y R15 son como se definió en la reivindicación 1.
9. Procedimiento según la reivindicación 8 en el que
10. Procedimiento según la reivindicación 9 en el que al menos uno de R2, R3 o R13 en la Fórmula 1 es -CO2R14 y se convierte en -CO2H.
11. Procedimiento según la reivindicación 9 en el que R14 es t-butilo y la reacción se lleva a cabo en CF3CO2H.
12. Procedimiento según la reivindicación 8 en el que R13 es -CN y el producto de Fórmula 3 se pone en contacto con (i) un ácido fuerte a la temperatura de reflujo del disolvente durante aproximadamente 2-96 horas o (ii) un álcali fuerte en un disolvente alcohólico a una temperatura en el intervalo de aproximadamente 20ºC y la temperatura de reflujo del disolvente durante aproximadamente 2-96 horas y seguidamente se ajusta el pH a aproximadamente 3-7, o (iii) ácido sulfúrico y seguidamente ácido o álcali, para convertir el producto en el correspondiente compuesto en el que R13 es -CO2H.
13. Procedimiento según la reivindicación 12 en el que al menos uno de R2, R3 o R13 es -CO2R14 y se convierte en -CO2H.
14. Procedimiento según la reivindicación 12 en el que R8 es -(CH2)nCN y se convierte en -(CH2)nCO2H, o es -(CH2)nOR11 y se convierte en (CH2)nOH cuando R13 se convierte en -CO2H.
15. Procedimiento según la reivindicación 8 en el que R13 es -CN y el producto de Fórmula 3 se pone en contacto con una mezcla de cantidades equimolares de azida de sodio y cloruro de amonio en un disolvente aprótico polar a una temperatura en el intervalo de aproximadamente 30ºC a la temperatura de reflujo del disolvente, durante aproximadamente 1 hora a 10 días, para convertir el producto en el compuesto correspondiente en el que R13 es 5-tetrazolilo.
16. Procedimiento según la reivindicación 15 en el que R8 es -(CH2)CN y se convierte en -(CH2)m-tetrazolilo cuando R13 se convierte en 5-tetrazolilo.
17. Procedimiento según la reivindicación 8 en el que R13 es -CN y el producto de Fórmula 3 se hace reaccionar con azida de trialquilestaño o azida de triarilestaño y seguidamente se realiza una hidrólisis ácida o básica para convertir el producto en el correspondiente compuesto en el que R13 es 5-tetrazolilo.
18. Procedimiento según la reivindicación 17 en el que R8 es -(CH2)nCN y se convierte en -(CH2)m-tetrazolilo cuando R13 se convierte en 5-tetrazolilo.
19. Procedimiento según la reivindicación 8 en el que R13 es -NO2 y el producto de Fórmula 3 se pone en contacto con un agente reductor para formar un segundo producto intermedio de Fórmula 3 en el que R13 es NH2, y este último se pone en contacto con un anhídrido (CH3SO2)2O o (CF3SO2)2O o un cloruro CH3SO2Cl o CF3SO2Cl de ácido sulfónico en un disolvente para producir un compuesto en el que R13 es -NHSO2CH3 o -NHSO2CF3.
20. Procedimiento según la reivindicación 19 en el que al menos uno de R2, R3 o R13 es -NO2 y se convierte en -NHSO2CH3 o -NHSO2CF3.
21. Procedimiento según la reivindicación 9 ó 12 en el que el compuesto de Fórmula 3 con R13 = CO2H
(a) o bien se pone en contacto con aproximadamente 1-4 equivalentes de cloruro de tionilo en cloruro de tionilo en exceso u otro disolvente a una temperatura en el intervalo de aproximadamente 20ºC a la temperatura de reflujo del disolvente durante un período de aproximadamente 5 minutos a aproximadamente 2 horas para formar un producto intermedio de Fórmula 3 en el que R13 es COCl, y este último se pone en contacto con aproximadamente 2-10 equivalentes de derivado de hidroxilamina H2NOR12 en derivado de hidroxilamina en exceso H2NOR12 u otro disolvente, a una temperatura en el intervalo de aproximadamente 25-80ºC durante aproximadamente 2-18 horas, o bien
(b) se pone en contacto con el derivado de hidroxilamina H2NOR12, diciclohexilcarbodiimida y 1-hidroxibenzotriazol en un disolvente a una temperatura en el intervalo de aproximadamente 0-30ºC durante aproximadamente 1-24 horas;
para proporcionar un compuesto en el que R13 es CONHOR12.
22. Procedimiento según la reivindicación 6 en el que
R2, R3, R6 y R7 son como se definen en la reivindicación 1 y
23. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOH y el producto de Fórmula 3 se pone en contacto con un alcohol R11OH en estado anhidro en presencia de un ácido fuerte o un ácido de Lewis, y seguidamente se saponifican cualesquiera de los grupos CO2R14 simultáneamente formados o presentes en el producto intermedio 3, para formar el correspondiente compuesto de Fórmula 3 en el que R8 es (CH2)nOR11 y R11 no es H.
24. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOR11 y R11 no es H y el producto de Fórmula 3 se pone en contacto con un medio ácido acuoso a una temperatura en el intervalo de aproximadamente 25ºC y la temperatura de reflujo del disolvente durante un período de aproximadamente 0,5-24 horas para formar el correspondiente compuesto de Fórmula 3 en el que R8 es (CH2)nOH.
25. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOH y el producto de Fórmula 3 se pone en contacto con
(a) un anhídrido (R14CO)2O o cloruro R14COCl de ácido carboxílico en un disolvente en presencia de una base a una temperatura en el intervalo de aproximadamente 0ºC y la temperatura de reflujo del disolvente durante aproximadamente 0,5-24 horas o
(b) un ácido carboxílico R14CO2H bajo condiciones anhidras en presencia de un ácido fuerte o un ácido de Lewis a aproximadamente 0º-100ºC durante aproximadamente 0,5 a 24 horas, para formar el correspondiente compuesto en el que R8 es (CH2)nOCOR14.
26. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOCOR14 y el producto de Fórmula 3 se pone en contacto con ácido o álcali acuoso para formar el correspondiente compuesto en el que R8 es (CH2)nOH.
27. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOH y el producto de Fórmula 3 se pone en contacto con un agente oxidante a una temperatura de aproximadamente 25-45ºC durante aproximadamente 1-200 horas para producir un compuesto correspondiente de Fórmula 3 en el que R8 es (CH2)n-1COR16 y R16 es H.
28. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCOR16 y R16 es H, y el producto de Fórmula 3 se pone en contacto con un compuesto organometálico R16P en el que P es MgBr o Li en un disolvente a una temperatura en el intervalo de aproximadamente -78ºC a 100ºC durante aproximadamente 0,5-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nCH(OH)R16 y R16 no es H.
29. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCH(OH)R16 y R16 no es H y el producto de Fórmula 3 se pone en contacto con un agente oxidante en un disolvente para formar un compuesto correspondiente de Fórmula en el que R8 es (CH2)nCOR16 y R16 no es H.
30. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCOR16 y R16 es H y el compuesto de Fórmula 3 se pone en contacto con un agente oxidante en un disolvente para formar un compuesto correspondiente de Fórmula 3 en el que R8 es (CH2)nCOR16 y R16 es OH.
31. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCOR16 y R16 es OH y el compuesto de Fórmula 3 se pone en contacto con cloruro de tionilo en exceso o en otro disolvente a una temperatura en el intervalo de aproximadamente 0ºC a la temperatura de reflujo del disolvente durante aproximadamente 5 minutos a aproximadamente 24 horas para formar un compuesto correspondiente de Fórmula 3 en el que R8 es (CH2)nCOCl y seguidamente se pone en contacto este último con una amina NHR18R19 en exceso o en un disolvente a temperaturas en el intervalo de aproximadamente 0ºC y la temperatura de reflujo del disolvente durante aproximadamente 5 minutos a aproximadamente 24 horas para formar un compuesto correspondiente de Fórmula 3 en el que R8 es (CH2)nCONR18R19.
32. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOR11 y R11 es H y el producto de Fórmula 3 se pone en contacto con cloruro de tionilo en exceso o en un disolvente a una temperatura en el intervalo de aproximadamente 20ºC a la temperatura de reflujo del disolvente durante aproximadamente 0,5-24 horas para formar un compuesto intermedio de Fórmula 3 en el que R8 es (CH2)nCl.
33. Procedimiento según la reivindicación 32 en el que el compuesto de Fórmula 3 en el que R8 es (CH2)mCl se pone en contacto con imidazol, 1,2,3-triazol, 1,2,4-triazol, tetrazol o ftalimida en presencia de una base en un disolvente a temperaturas en el intervalo de aproximadamente 55ºC a la temperatura de reflujo del disolvente durante aproximadamente 1-24 horas para producir un compuesto correspondiente de Fórmula 3 en el que R8 es (CH2)m-imidazol, (CH2)m-triazol, (CH2)m-tetrazol o (CH2)m-ftalimida.
34. Procedimiento según la reivindicación 32 en el que el compuesto de Fórmula 3 en el que R8 es (CH2)nCl se pone en contacto con la sal de sodio o potasio de un mercaptano R15SH en un disolvente a una temperatura en el intervalo de aproximadamente 25-100ºC durante aproximadamente 1-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nSR15.
35. Procedimiento según la reivindicación 32 en el que el compuesto de Fórmula 3 en el que R8 es (CH2)nCl se pone en contacto con un cianuro de metal alcalino en un disolvente a una temperatura en el intervalo de aproximadamente 20-100ºC durante aproximadamente 1-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nCN y este último compuesto se hidroliza para proporcionar el correspondiente compuesto de Fórmula 3 en el que R8 es (CH2)nCOR16 y R16 es OH.
36. Procedimiento según la reivindicación 32 en el que el compuesto de Fórmula 3 en el que R8 es (CH2)n-1Cl se pone en contacto con la sal de sodio o potasio de un malonato de dialquilo en un disolvente a una temperatura en el intervalo de aproximadamente 20-100ºC durante aproximadamente 0,5-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nCH(CO2-alquilo)2 y seguidamente se saponifica este último con álcali acuoso a una temperatura en el intervalo de aproximadamente 25ºC a la temperatura de reflujo del disolvente y seguidamente se acidifica con ácido mineral para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nCH(CO2H)2 y seguidamente se calienta este último a aproximadamente 120ºC o en ácido mineral diluido a la temperatura de reflujo para formar un producto de Fórmula 3 en el que R8 es (CH2)nCOR16 y R16 es OH.
37. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCN y el compuesto de Fórmula 3, se pone en contacto con azida de sodio y cloruro de amonio en un disolvente a una temperatura en el intervalo de aproximadamente 30ºC y la temperatura de reflujo del disolvente durante aproximadamente 1 hora a aproximadamente 10 días para formar un compuesto de la invención en el que R8 es (CH2)n-tetrazol.
38. Procedimiento según la reivindicación 22 en el que R8 es -CHO y el compuesto de Fórmula 3 se pone en contacto con un metileno fosforano (C6H5)3P=CH(CH2)sCHR14OR15 o (C6H5)3P=CH(CH2)sCOR16 en un disolvente a una temperatura en el intervalo de aproximadamente 25ºC a la temperatura de reflujo del disolvente durante aproximadamente 1-24 horas para formar un compuesto de Fórmula 3 en el que R8 es -CH=CH(CH2)sCHR14OR15 o -CH=CH(CH2)sCOR16, excepto cuando R15 es H y R16 es OH, y seguidamente de forma opcional poner en contacto el compuesto de Fórmula 3 en el que R8 es -CH=CH (CH2)sCOR16 con un agente reductor en un disolvente a una temperatura de aproximadamente 0º-25ºC durante aproximadamente 0,5-24 horas para formar un producto de Fórmula 3 en el que R8 es -CH=CH(CH2)sCHR14OH.
39. Procedimiento según la reivindicación 22 en el que R8 es (CH2)mOH y el compuesto de Fórmula 3 se pone en contacto con un agente de fluoración en un disolvente a una temperatura en el intervalo de aproximadamente -30ºC a 25ºC durante un período de aproximadamente 0,5-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)mF.
40. Procedimiento según la reivindicación 22 en el que el compuesto de Fórmula 3 en el que R8 es (CH2)mCl se pone en contacto con nitrato de plata en un disolvente aprótico dipolar a una temperatura en el intervalo de aproximadamente 25-80ºC durante aproximadamente 1-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)mONO2.
41. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nOH y el compuesto de Fórmula 3 se pone en contacto con un isocianato de Fórmula R10NCO en un disolvente a una temperatura en el intervalo de aproximadamente 25ºC a la temperatura de reflujo del disolvente durante un período de aproximadamente 5 minutos a aproximadamente 24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nOCONHR10.
42. Procedimiento según la reivindicación 22 en el que el compuesto en el que R8 es (CH2)nCl se pone en contacto con una amina R11NH2 en exceso de amina u otro disolvente durante un período de aproximadamente 1-24 horas a una temperatura en el intervalo de aproximadamente 0ºC a la temperatura de reflujo del disolvente para formar un producto intermedio de Fórmula 3 en el que R8 es (CH2)nNHR11.
43. Procedimiento según la reivindicación 22 en el que R8 es (CH2)nCl y el compuesto de Fórmula 3 se pone en contacto con una azida de metal alcalino en un disolvente aprótico a una temperatura en el intervalo de aproximadamente 25-80ºC durante aproximadamente 1-24 horas para formar un compuesto de Fórmula 3 en el que R8 es (CH2)nN3 y este último se pone en contacto con un agente reductor para formar un producto intermedio de Fórmula 3 en el que R8 es (CH2)nNH2.
44. Procedimiento según la reivindicación 42 o 43 en el que R8 es (CH2)nHR11 o (CH2)nNH2 y el compuesto de Fórmula 3 se pone en contacto con un cloroformiato de Fórmula R10OCOCl o un derivado de sulfonilo de fórmula R10SO2Cl, o (R10SO2)O en un disolvente en presencia de una base a una temperatura en el intervalo de aproximadamente 0ºC a la temperatura de reflujo de un disolvente durante aproximadamente 5 minutos a aproximadamente 24 horas para formar un compuesto de Fórmula 3 en el que R8 es -(CH2)nNR11CO2R10 o -(CH2)nNR11SO2R10.
45. Procedimiento según la reivindicación 42 o 43 en el que el compuesto de Fórmula 3 con R8 igual a -(CH2)nNHR11 o (CH2)nNH2 se pone en contacto con un isocianato o isotiocianato R10NCY en un disolvente a una temperatura en el intervalo de aproximadamente 25ºC a la temperatura de reflujo del disolvente durante aproximadamente 5 minutos a aproximadamente 24 horas para formar un compuesto de Fórmula 3 en el que R8 es -(CH2)nNR11CYNHR10.
46. Procedimiento según la reivindicación 6 en el que R1 es NO2 R2, R3, R6, R7 y R8 son como se definió en la reivindicación 1 en el que el compuesto de Fórmula 3 en el que R1 es NO2 se reduce por medio de hierro y ácido acético, cloruro estannoso o hidrógeno y paladio para proporcionar un compuesto de Fórmula 3 en el que R1 es NH2 y este último se hace reaccionar con un anhídrido de ácido apropiado tal como anhídrido ftálico o un anhídrido ftálico sustituido en un disolvente o con un cloruro de ácido apropiado tal como cloruro de ácido antranílico sustituido en presencia de un álcali acuoso o una base o con un ácido ftálico o antranílico apropiadamente sustituido en presencia de diciclohexilcarbodiimida en un disolvente para producir un compuesto de Fórmula 3 en el que R1 es
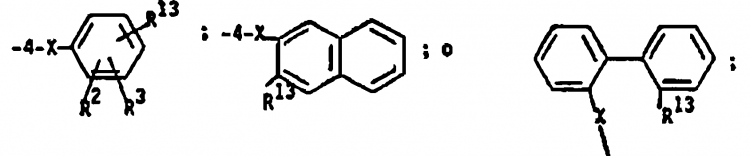
y X es NHCO.
47. Procedimiento según la reivindicación 6 en el que R1 es OCH2C6H5, R2 y R3 son H y R6, R7 y R8 son como se definió en la reivindicación 1 y el compuesto resultante de Fórmula 3 con R1 igual a OCH2C6H5 se pone en contacto con ácido trifluoroacético a temperatura de reflujo durante un período de aproximadamente 0,2-1 hora o con hidrógeno y paladio para formar el correspondiente compuesto de Fórmula 3 en el que R1 es OH y este último se pone en contacto con una base a aproximadamente 25ºC y un haluro de bencilo adecuado de la fórmula:
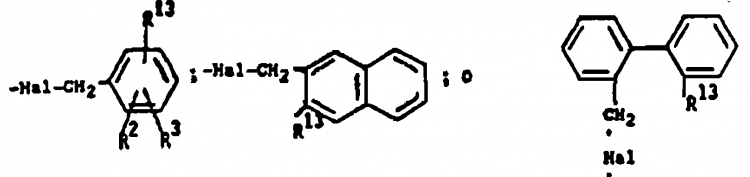
para producir el correspondiente compuesto de Fórmula 3 en el que R1 es
y X es -OCH2-.
48. Procedimiento según la reivindicación 6 en el que R8 es -CHO, por el cual el derivado de bencilo de Fórmula 2 se une al derivado de imidazol de Fórmula 1 preferentemente en el átomo de nitrógeno adyacente al átomo de carbono del anillo imidazol al cual está unido R8.
Patentes similares o relacionadas:
Antagonistas del cisteinil leucotrieno, del 25 de Marzo de 2020, de Sun Pharma Advanced Research Company Ltd: Un compuesto de la fórmula (Ia), o la sal farmacéuticamente aceptable de este, **(Ver fórmula)** en donde, R1 y R2 se seleccionan de hidrógeno y halógeno; […]
Inhibidores SGLT1/SGLT2 duales, del 12 de Febrero de 2020, de JANSSEN PHARMACEUTICA NV: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde R1 es hidroxilo, C1-4 alcoxi, heteroarilo, o halógeno; R2 es H, C1-2 alquilo, […]
Moduladores del receptor nuclear (ROR) para el tratamiento de enfermedades inflamatorias y autoinmunes, del 27 de Noviembre de 2019, de AbbVie Inc: Un compuesto de Formula (I-a): **(Ver fórmula)** o una sal farmaceuticamente aceptable del mismo, en el que: G y J son independientemente […]
Derivados de (aza-)isoquinolinona, del 13 de Noviembre de 2019, de MERCK PATENT GMBH: Compuestos seleccionados del grupo N.º Nombre "A3" 3-[4-(1-hidroxi-1-metil-etil)-fenil]-2H-isoquinolin-1-ona "A5" 6-fluoro-3-[4-(1-hidroxi-1-metil-etil)-fenil]-2H-isoquinolin-1-ona […]
Derivados de imidazopiridazina enlazados a heterociclilo como inhibidores de PI3Kß, del 25 de Septiembre de 2019, de JANSSEN PHARMACEUTICA NV: Un compuesto de Fórmula (I)**Fórmula** , un tautómero o una forma estereoisomérica del mismo, en donde R1 representa -C(=O)OH, -C(=O)NH2, -NH2,**Fórmula** […]
Inhibidores de PDE10 y composiciones y métodos relacionados, del 15 de Mayo de 2019, de OMEROS CORPORATION: Un compuesto que tiene la siguiente estructura (I):**Fórmula** o una sal o estereoisómero farmacéuticamente aceptables del mismo, o un compuesto de estructura (I) isotópicamente […]
Antagonistas de C5aR, del 10 de Abril de 2019, de CHEMOCENTRYX, INC.: Un compuesto que tiene la fórmula:**Fórmula**
Inhibidores de la replicación viral, su proceso de preparación y sus usos terapéuticos, del 4 de Abril de 2019, de HIVIH: Un compuesto según la fórmula (I):**Fórmula** en la que: - R1 y R6, sin sustituir o sustituidos por al menos un T1, idénticos o diferentes, representan […]