FRACCION DE QUIL A CON BAJA TOXICIDAD Y SU USO.
Uso de la fracción A de Quil A integrada en una partícula iscom junto con al menos otro adyuvante con capacidad inmunomodulador en forma libre o integrado en otra partícula iscom distinta para la preparación de una composición adyuvante con efecto sinérgico que incluye el potenciamiento de las respuestas inmunes y la actividad inmunomoduladora,
facilitando el uso del otro adyuvante, que cuando se usa solo puede ser tóxico en dosis que son eficaces
Tipo: Resumen de patente/invención. Número de Solicitud: W04001038SE.
Solicitante: ISCONOVA AB.
Nacionalidad solicitante: Suecia.
Dirección: UPPSALA SCIENCE PARK, DAG HAMMARSKJOLDS VAG 54 A,751 83 UPPSALA.
Inventor/es: MOREIN, BROR, LOVGREN BENGTSSON, KARIN, EKSTROM, JILL, RANLUND,KATARINA, HU,KEFIE.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K39/39 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Clasificación PCT:
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Clasificación antigua:
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Fragmento de la descripción:
Fracción de Quil A con baja toxicidad y su uso.
Campo de la invención
La presente invención se refiere al uso de la fracción A de Quil A integrada en una partícula iscom junto con al menos otro adyuvante para la preparación de una composición adyuvante con efectos sinérgicos que incluyen el nivel de respuestas inmunes y la actividad inmunomoduladora.
Técnica anterior
Existe una gran necesidad de sistemas de administración de adyuvantes y vacunas eficaces tanto para hombres como para animales a usar para inmunoprofilaxia o para inmunoterapia. Para las vacunas animales existen numerosos adyuvantes diferentes entre los que se incluyen vacunas adyuvadas con iscom y matriz de iscom. Sin embargo, únicamente los adyuvantes de hidróxido de aluminio y fosfato de calcio están comercialmente disponibles para vacunas humanas, y se ha registrado recientemente un adyuvante de emulsión en aceite (MF59) para una vacuna de gripe humana. De esta manera, existe una carencia de adyuvantes eficaces, particularmente para vacunas humanas. Los adyuvantes no son sólo importantes para potenciar el nivel de la respuesta inmune sino aún más para la calidad o tipo de respuesta inmune, que se debe corresponder con el tipo de infección contra la que se pretende que la vacuna proteja. Con respecto a los patógenos que se establecen por sí mismos en el interior de la célula al igual que los virus, pero también algunas bacterias y parásitos, se requiere una respuesta inmune del tipo denominado Th1 para una protección inmune óptima, y en muchos casos, una respuesta de tipo Th1 es un requisito previo para la protección inmune. Sin embargo, en la actualidad también se ha establecido, que un tipo de respuesta Th1 o Th2 puro puede producir efectos secundarios, debido a que se necesita un equilibrio entre los dos tipos de células T auxiliares para la regulación inmune. Es decir, la respuesta Th1 regula la respuesta Th2 por ejemplo mediante la producción de IFN-? y la respuesta Th1 está regulada por la respuesta Th2 por ejemplo mediante la producción de la citoquina IL10. De esta manera, el equilibrio Th1-Th2 es esencial para evitar efectos secundarios. Para ser capaces de inducir el tipo correcto de respuesta inmune para la protección contra los diversos patógenos se requerirán numerosos adyuvantes. Una respuesta Th1 se refleja una por la respuesta de los anticuerpos IgG2a, y por tanto se usa como marcador de la respuesta Th1 de la célula t auxiliar. Un aspecto importante de los adyuvantes es la seguridad que incluye el hecho de que la respuesta inmune evocada debería tener una calidad que evite efectos secundarios cuando se produce una infección posterior tras la vacunación. Aparecieron efectos secundarios graves en el caso del virus respiratorio sincitial cuando una vacuna del virus respiratorio (VRS) inactivado con formalina adyuvada con hidróxido de aluminio se ensayó en niños hace aproximadamente 30 años. Los niños vacunados enfermaron y se produjo entre ellos un índice de mortalidad mayor tras la infección natural con VRS que en los niños no vacunados.
Toxicidad aguda o efectos secundarios han sido los riesgos principales en el uso veterinario y particularmente humano de las saponinas de Quillaja en las preparaciones de vacunas. Estos objetivos fueron sólo parcialmente conseguidos con éxito, las fracciones purificadas, por ejemplo, QA-21 (documento EP 0 362 279 B2) y las combinaciones de las fracciones A y C (documento WO 96/11711, patente de Iscotec se definieron químicamente, de hecho, en comparación con la "Quillaja Saponaria Molina", pero siguen produciendo cierta alguna toxicidad y efectos secundarios.
Ha resultados ahora que la fracción A de Quil A tiene baja toxicidad, y en una dosis baja potencia el nivel de respuestas inmunes y la capacidad inmunomoduladora de otros adyuvantes en dosis subóptimas, que cuando se usan por sí mismos pueden ser tóxicos o producir efectos secundarios en dosis eficaces. De esta manera, esto facilita el uso de otros adyuvantes que, cuando se usan por sí mismos, pueden ser tóxicos en dosis que son eficaces.
Resumen de la invención
La presente invención es el uso de la fracción A de Quil A integrada en una partícula iscom junto con al menos otro adyuvante para la preparación de una composición adyuvante con efectos sinérgicos para potenciar el nivel de respuestas inmunes y actividad inmunomoduladora tal como se define en las reivindicaciones. (Esta invención se refiere especialmente al uso de la fracción A de Quil A en una composición que comprende partículas iscom en la que se integran diferentes fracciones de Quil A en diferentes partículas iscom y de matriz de iscom).
Descripción de los dibujos
Fig 1-1
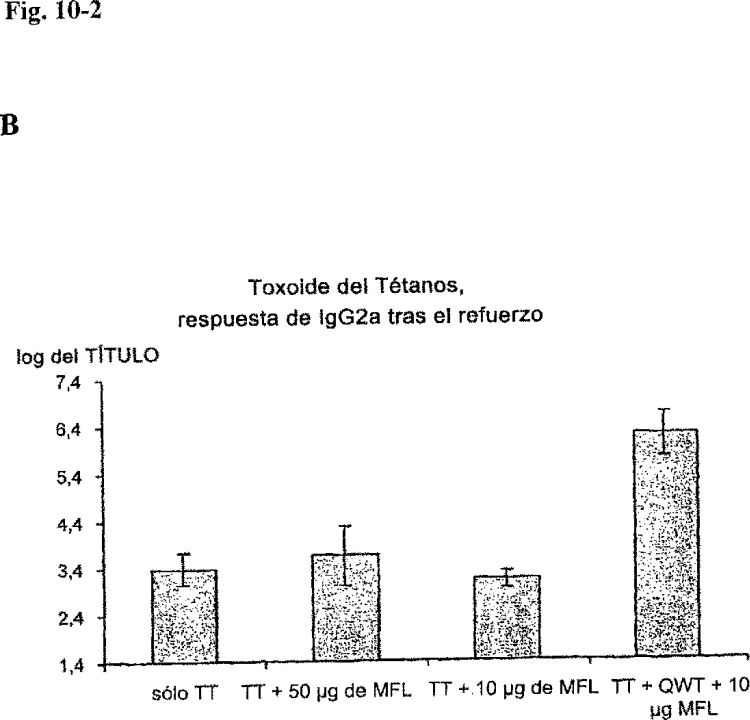
Una dosis elevada (50 µg) de QHC en la matriz es tóxica, mientras que una dosis elevada de QWT en la matriz no es tóxica cuando se suplementa a OVA para potenciar la respuesta del anticuerpo en ratones Balb/C (véase el texto). Ambas formulaciones potencian respuestas similares de anticuerpos específicos contra OVA tal como se midió mediante ELISA tres semanas después de la segunda inmunización para la respuesta de IgG total (A) y en el subtipo IgG2a (B).
Fig 1-2
Efectos sinérgicos de matriz-QWT y matriz-QHX cuando se suplementan a OVA para potenciar la respuesta del anticuerpo en ratones Balb/C (véase el texto). La dosis de matriz-QWT y matriz-QHC osciló como sigue en el grupo 1, sin QWT ni C; Gr. 2, 0,3 µg QWT sin C; Gr. 3, 0,3 µg QWT + 2 µg C; Gr. 4, 10 µg QWT sin C; Gr. 5, 10 µg QWT 2 µg C. La dosis de OVA fue de 10 µg. Hubo 8 ratones por grupo, que se inmunizaron dos veces con 4 semanas de separación s.c con la formulación respectiva. Se midieron los títulos de anticuerpo mediante ELISA contra OVA:
A IgG total 3 semanas después de la primera inmunización
B IgG2a 2 semanas después de la segunda inmunización
C IgG1 2 semanas después de la segunda inmunización
Fig 2-1
Toxicidad de QWT y AC (es decir, 703) de las iscom del virus respiratorio sincitial (VRS) medida mediante el índice de supervivencia en ratones recién nacidos (1 semana de edad) tras una inyección intraperitoneal con 1 µg de iscom (proteína). La relación proteína/saponina es 1/1.
Fig 3-1
Respuesta de anticuerpos en ratones recién nacidos (1 semana de edad) y adultos tras una inmunización intraperitoneal y un refuerzo posterior después de 3 semanas con 1 µg de iscom (proteína). La relación proteína/saponina es 1/1.
Fig 4-1
Respuesta de las células T citotóxicas (CTL) tras una inmunización intraperitoneal con 1 µg de iscom (proteína). La relación proteína/saponina es 1/1. Se recogieron las células de bazo 1 y 3 semanas después de la inmunización intraperitoneal.
Fig 5-1
La matriz QWT es menos tóxica en células VERO (una línea celular de mono) que la matriz 703 y la matriz C tras la exposición durante 72 h en cultivo medido mediante la velocidad de crecimiento proporcional (%) en cultivos no expuestos. La matriz QWT es bien tolerada a todas las concentraciones ensayadas, es decir, hasta 1300 µg. No se registró crecimiento en cultivos expuestos a 800 µg de matriz 703 o 45 µg de matriz QHC.
- A. Exposición de células VERO a la matriz QWT y a la matriz 703 tal como se indica.
- B. Exposición de células VERO a la matriz QHC tal como se indica.
Fig 5-2
La matriz QWT es menos tóxica que la matriz C en células de bazo obtenidas de ratones tras la exposición durante 72 h en cultivo medida mediante la velocidad de crecimiento determinada mediante un procedimiento colorimétrico tal como se describe en el texto. La velocidad de crecimiento se compara con el crecimiento de las células de bazo en medio sólo o conjuntamente con mitógeno Con A.
- A. Exposición de células de bazo a la matriz QWT en dosis decrecientes de 10 a 1,25 µg tal como se indica.
- B. Exposición de células de bazo a la matriz QHC en dosis decrecientes de 10 a 1,25 µg tal como se indica.
Figura 6
Esta figura muestra la preparación de las fracciones A, B y C mediante HPLC;
Figura 7
Esta figura muestra el efecto sinérgico de matriz-QWT y matriz-QHC. Se inmunizaron grupos de 8 ratones hembras Balb/c s.c. en la base de la cola con 5 microgramos de ovoalbúmina (OVA) sola (Gr 1) o mezclada...
Reivindicaciones:
1. Uso de la fracción A de Quil A integrada en una partícula iscom junto con al menos otro adyuvante con capacidad inmunomodulador en forma libre o integrado en otra partícula iscom distinta para la preparación de una composición adyuvante con efecto sinérgico que incluye el potenciamiento de las respuestas inmunes y la actividad inmunomoduladora, facilitando el uso del otro adyuvante, que cuando se usa solo puede ser tóxico en dosis que son eficaces.
2. El uso de acuerdo con la reivindicación 1 en el que el al menos otro adyuvante se escoge entre saponinas, que se producen naturalmente, moléculas de saponina sintética o semisintética derivadas del extracto bruto de saponina de Quillaja saponaria Molina escogido entre las fracciones de C, el B B3, B4 y B4b y QA-1, QA-2, QA-3, QA-4, QA-5, QA-6, QA-7, QA-8, QA-9, QA-10, QA-11, QA-12, QA-13, QA-14, QA-15, QA-16, QA-17, QA-18, QA-19, QA-20 QA-22, el esqueleto de la pared celular, polímeros en bloque, por ejemplo, copolímeros en bloque hidrófilos, por ejemplo, CRL-1005, TDM (Dimicolato de trehalosa), lipopéptidos, LPS y derivados de LPS, el Lípido A de diferentes especies bacterianas y sus derivados, por ejemplo, monofosforil lípido A, variantes de CpG, variantes de Cp-GODN, inmunomoduladores animales humanos endógenos, por ejemplo, GM-CSF, IL-2, adyuvante de toxinas bacterianas activas, por ejemplo, la toxina del cólera TC, y sus subcomponente TCB y TCA1, toxina termolábil (TL) de E. coli, o toxina de Bordetella pertussis (BP) y el filamento de hemaglutinina de BP.
3. El uso de acuerdo con la reivindicación 2, en el que la fracción de saponina de Quil A se escoge a partir de la fracción C o B de Quil A.
4. El uso de acuerdo con cualquiera de las reivindicaciones 1-3, en el que al menos otro adyuvante se integra en una partícula iscom.
5. El uso de acuerdo con la reivindicación 4, en el que el al menos otro adyuvante se integra en partículas iscom distintas.
6. Uso de acuerdo con cualquiera de las reivindicaciones 1-3, en el que la fracción A de Quil A se integra en una partícula iscom y al menos otro adyuvante está libre y no integrado en ninguna partícula iscom.
7. Uso de acuerdo con la reivindicación 6, en el que al menos otro adyuvante que está libre y no integrado en ninguna partícula iscom es monofosforil lípido A y/o la toxina del cólera TC.
8. Uso de acuerdo con cualquiera de las reivindicaciones 1-7, en el que la partícula iscom es un complejo iscom.
9. Uso de acuerdo con cualquiera de las reivindicaciones 1-7, en el que la partícula iscom es un complejo de matriz de iscom.
10. Uso de acuerdo con cualquiera de las reivindicaciones 1-9, en el que la composición comprende además un vehículo, diluyente, excipiente o aditivo farmacéuticamente aceptable.
Patentes similares o relacionadas:
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Respuesta inmune mejorada en especies aviares, del 1 de Julio de 2020, de Bayer Intellectual Property GmbH: Una composición de inmunomodulador, en que la composición del inmunomodulador comprende: a. un vehículo catiónico de administración de liposomas; y […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Inmunomodulación mediante inhibidores de IAP, del 6 de Mayo de 2020, de NOVARTIS AG: Una vacuna que comprende una cantidad inmunogénica de un antígeno procedente de tumor o antígeno tumoral y un adyuvante que comprende un inhibidor de IAP […]