FOSFODIESTERASAS ESPECÍFICAS DE NUCLEÓTIDOS CÍCLICOS PROCEDENTES DE LEISHMANIA Y USOS DE LAS MISMAS.
Proteína sustancialmente purificada que comprende un dominio catalítico de fosfodiesterasa (PDE) de PDE-B1 de Leishmania que comprende los aminoácidos 647-880 como se expone en SEC ID Nº:
3 o variantes y mutantes del dominio catalítico que son al menos un 80% idénticos a los aminoácidos 647-880 de SEC ID Nº: 3 y que hidrolizan AMPc
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/003990.
Solicitante: UNIVERSITÄT BERN
OTSUKA PHARMACEUTICAL CO., LTD.
Nacionalidad solicitante: Suiza.
Dirección: VERWALTUNGSDIREKTION, HOCHSCHULSTRASSE 4 3012 BERN SUIZA.
Inventor/es: JOHNER,Andrea, SEEBECK,Thomas, SHAKUR,Yasmin.
Fecha de Publicación: .
Fecha Solicitud PCT: 3 de Septiembre de 2004.
Clasificación PCT:
- C07K16/40 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra enzimas.
- C12N15/63 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N9/16 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces éster (3.1).
- C12Q1/44 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › esterasa.
Clasificación antigua:
- C07K16/40 C07K 16/00 […] › contra enzimas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N9/16 C12N 9/00 […] › actúan sobre los enlaces éster (3.1).
- C12Q1/44 C12Q 1/00 […] › esterasa.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2358331_T3.pdf




Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
Solicitamos la prioridad de las Solicitudes Provisionales de Estados Unidos Nº 60/500,244 (presentada el 5 de septiembre de 2003), 60/504.070 (presentada el 19 de septiembre de 2003) y 60/582.584 (presentada el 25 de junio de 2004). 5
La presente invención se refiere a nuevas secuencias de aminoácidos y de ácidos nucleicos de fosfodiesterasas específicas de nucleótidos cíclicos de un parásito de la familia de Leishmania, tal como Leishmania major. La invención también se refiere a construcciones de ácido nucleico, vectores y células hospedadoras que comprenden las secuencias de ácido nucleico así como métodos para producir y usar las secuencias de aminoácidos y ácidos nucleicos. La invención se refiere adicionalmente al uso de estas secuencias y de anticuerpos dirigidos contra estas secuencias, en el 10 diagnóstico y tratamiento de trastornos relacionados con la infección de Leishmania, tal como Leishmania major, incluyendo la identificación de compuestos que forman complejos con los polipéptidos y ácidos nucleicos en la presente invención.
ANTECEDENTES DE LA INVENCIÓN
Leishmania major es uno de varios parásitos de Leishmania que, cuando se introduce en un organismo 15 hospedador, es el agente causante de leishmaniasis. Leishmania major es una especie del complejo Leishmania tropica. Otros complejos (que comprenden especies y subespecies) incluyen Leishmania donovani, Leishmania mexicana y Leishmania viannia. De acuerdo con la Organización Mundial de la Salud, la leishmaniasis está entre las enfermedades más infecciosas a nivel global y es endémica en 88 países de África, Asia, Europa y en Sudamérica y Norteamérica. Se ha estimado que más de 12 millones de personas sufren infecciones Leishmaniales a nivel global, 20 existiendo serios problemas de salud pública particularmente en países tales como Irán, Irak, Afganistán, Argelia, Brasil, India, Perú y Siria. La leishmaniasis se manifiesta de manera más habitual como leishmaniasis cutánea (es decir de piel) (CL) o leishmaniasis visceral (es decir en órganos internos) (VL). CL es la forma más común de leishmaniasis y es el resultado de la transmisión del parásito Leishmania major mediante la mordedura de un flebótomo hembra infectado. Los síntomas de CL incluyen grandes lesiones o úlceras de piel en partes expuestas del cuerpo, que causan una 25 discapacidad grave y cicatriz permanente.
Los métodos de tratamiento de leishmaniasis típicamente se han limitado a administrar antimonio pentavalente (Sbv) (Sundar et al. (2002) Curr. Opin. Infect. Dis. 15, 593-598). Debido a la reciente aparición de resistencia a gran escala a Sbv, sin embargo, la eficacia de este tratamiento se está volviendo crecientemente limitada. Además, el tratamiento con Sbv tiene varios efectos secundarios que incluyen náuseas, vómitos, diarrea y convulsiones. Además, la 30 coinfección de VIH con especies de Leishmania presenta retos adicionales puesto que dicha coinfección puede alterar dramáticamente la epidemiología, diagnóstico y respuesta de leishmaniasis a terapia (Lee et al. (2003) Int. J. Infect. Dis. 7, 86-93).
DESCRIPCIÓN RESUMIDA DE LA INVENCIÓN
La invención proporciona nuevos polipéptidos de fosfodiesterasa específica de nucleótido cíclico de Leishmania 35 (LmPDE) y moléculas de ácidos nucleicos de los mismos que son útiles en el diagnóstico y tratamiento de leishmaniasis. Los polipéptidos de la presente invención también incluyen anticuerpos que reconocen y se unen a polipéptidos de LmPDE. Las moléculas de ácido nucleico de la invención también incluyen ácidos péptido nucleicos (PNA) y moléculas antisentido que reaccionan con las moléculas de ácido nucleico de la invención.
En una realización, la invención proporciona fosfodiesterasas nuevas de longitud completa (PDE) del parásito 40 Leishmania major, designadas LmPDE-A, LmPDE-B1 y LmPDE-B2, incluyendo las moléculas polipeptídicas, moléculas de ácido nucleico correspondientes y fragmentos de las mismas.
La presente invención también abarca diversas secuencias de nucleótidos y aminoácidos que representan diferentes formas y fragmentos de los genes, transcritos y proteínas de LmPDE tales como proteínas mutadas de forma conservativa, formas alélicas diferentes, formas polimórficas, transcritos precursores alternativos y transcritos maduros. 45 Adicionalmente, se proporcionan moléculas de ácido nucleico recombinante que son variantes de utilización de codón de las nuevas secuencias de LmPDE. La invención abarca LmPDE de Leishmania major, así como de otras especies y subespecies de Leishmania de los complejos Leishmania tropica, Leishmania donovani, Leishmania mexicana y Leishmania viannia.
La presente invención proporciona adicionalmente moléculas de ácido nucleico recombinante que codifican 50 secuencias de tipo silvestre o mutantes de polipéptidos de LmPDE que mantienen la actividad biológica de PDE. Estas incluyen mutantes de origen natural y sintéticos, así como polipéptidos semisintéticos y recombinantes.
La presente invención también incluye los polinucleótidos que codifican LmPDE en vectores de expresión recombinante y sistemas de hospedador-vector que incluyen vectores de expresión. Una realización proporciona diversas células hospedadoras transformadas con vectores recombinantes que incluyen las secuencias de nucleótidos 55 de LmPDE de la invención. La invención también proporciona organismos modificados genéticamente que comprenden
un vector que contiene una secuencia de LmPDE recombinante en la que al menos un gen de LmPDE endógeno se ha deshabilitado.
La presente invención proporciona adicionalmente métodos para usar polipéptidos de LmPDE sustancialmente purificados para identificar compuestos que modulan la expresión o actividad de las LmPDE.
La presente invención también proporciona métodos para usar secuencias de nucleótidos de LmPDE como 5 sondas y cebadores de ácido nucleico y para usar polipéptidos de LmPDE como antígenos para la producción de anticuerpos anti LmPDE nuevos. Las sondas y cebadores de LmPDE y los anticuerpos anti LmPDE son útiles en los ensayos de diagnóstico y kits para la detección de secuencias proteicas y de nucleótidos de LmPDE de origen natural presentes en muestras biológicas.
Se expondrán objetos y ventajas adicionales de la invención en parte en la descripción a continuación y en parte 10 resultarán obvias a partir de la descripción o pueden aprenderse por práctica de la invención. Los objetos y ventajas de la invención se realizarán y obtendrán por medió de los elementos y combinaciones particularmente indicados en las reivindicaciones adjuntas. Además, las ventajas descritas en el cuerpo de la memoria, si no están incluidas en las reivindicaciones, no son por sí mismas limitaciones de la invención reivindicada.
Las publicaciones analizadas en la presente memoria se proporcionan solamente por su descripción previa a la 15 fecha de presentación de la presente solicitud. Nada de la presente memoria debe interpretarse como una admisión de que la presente invención no tiene derecho a antedatar dicha publicación en virtud de invención previa. Además, las fechas de publicación proporcionadas pueden ser diferentes de las fechas de publicación reales que pueden requerir confirmarse de forma independiente.
BREVE DESCRIPCIÓN DE LOS DIBUJOS 20
La Figura 1 muestra la secuencia de aminoácidos deducida de un polipéptido de LmPDE-A de longitud completa (SEC ID Nº: 1).
Las Figuras 2A-2S muestran la secuencia de ADN (SEC ID Nº: 2) para el gen de longitud completa de LmPDE-A. La fase abierta de lectura comienza con adenina en la posición 530 y termina con guanina en la posición 2425.
Las Figuras 3A-3B muestran la secuencia de aminoácidos deducida de un polipéptido de LmPDE-B1 de longitud 25 completa (SEC ID Nº: 3).
Las Figuras 4A-4L muestran la secuencia de ADN (SEC ID Nº: 4) para el gen de longitud completa de LmPDE-B1. La fase abierta de lectura comienza con adenina en la posición 1267 y termina con adenina en la posición 4059.
Las Figuras 5A-B muestran la secuencia de aminoácidos deducida de un polipéptido de LmPDE-B2 de longitud completa (SEC ID Nº: 5). 30
Las Figuras 6A-6L muestran la secuencia de ADN (SEC ID Nº: 6) para el gen de longitud completa de LmPDE-B2. La fase abierta de lectura comienza con adenina en la... [Seguir leyendo]
Reivindicaciones:
1. Proteína sustancialmente purificada que comprende un dominio catalítico de fosfodiesterasa (PDE) de PDE-B1 de Leishmania que comprende los aminoácidos 647-880 como se expone en SEC ID Nº: 3 o variantes y mutantes del dominio catalítico que son al menos un 80% idénticos a los aminoácidos 647-880 de SEC ID Nº: 3 y que hidrolizan AMPc. 5
2. Proteína sustancialmente purificada que comprende un dominio catalítico de PDE de PDE-B2 de Leishmania que comprende los aminoácidos 657-890 como se expone en SEC ID Nº: 5 o variantes y mutantes del dominio catalítico que son al menos un 80% idénticos a los aminoácidos 657-890 de SEC ID Nº: 5 y que hidrolizan AMPc.
3. Proteína sustancialmente purificada de la reivindicación 1 que comprende la secuencia de aminoácidos expuesta en SEC ID Nº: 3 o variantes y mutantes de la misma que son al menos un 80% idénticos a SEC ID Nº: 3 y que hidrolizan 10 AMPc.
4. Proteína sustancialmente purificada de la reivindicación 2 que comprende la secuencia de aminoácidos expuesta en SEC ID Nº: 5 o variantes y mutantes de la misma que son al menos un 80% idénticos a SEC ID Nº: 5 y que hidrolizan AMPc.
5. Molécula de ácido nucleico sustancialmente purificada que comprende una secuencia de ácido nucleico que codifica 15 una proteína de la reivindicación 1 ó 2.
6. Molécula de ácido nucleico de acuerdo con la reivindicación 5 que comprende una secuencia de ácido nucleico que codifica una proteína de la reivindicación 3.
7. Molécula de ácido nucleico de acuerdo con la reivindicación 6, en donde la molécula de ácido nucleico comprende la secuencia de nucleótidos expuesta en SEC ID Nº: 4 que comienza con adenina en la posición 1267 y termina con 20 adenina en la posición 4059.
8. Molécula de ácido nucleico de acuerdo con la reivindicación 5 que comprende una secuencia de ácido nucleico que codifica una proteína de la reivindicación 4.
9. Molécula de ácido nucleico de acuerdo con la reivindicación 8, en donde la molécula de ácido nucleico comprende la secuencia de nucleótidos expuesta en SEC ID Nº: 6 que comienza con adenina en la posición 2182 y termina con 25 adenina en la posición 5004.
10. Molécula de ácido nucleico de la reivindicación 6 u 8, siendo la molécula de ácido nucleico una molécula de ADN.
11. Proteína de la reivindicación 3 o reivindicación 4, o el ácido nucleico de la reivindicación 6 u 8, en donde la proteína tiene un valor de KM de 1 a 2 M para AMPc.
12. Proteína de la reivindicación 3 o reivindicación 4, o el ácido nucleico de la reivindicación 6 u 8, en donde la proteína 30 no hidroliza GMPc.
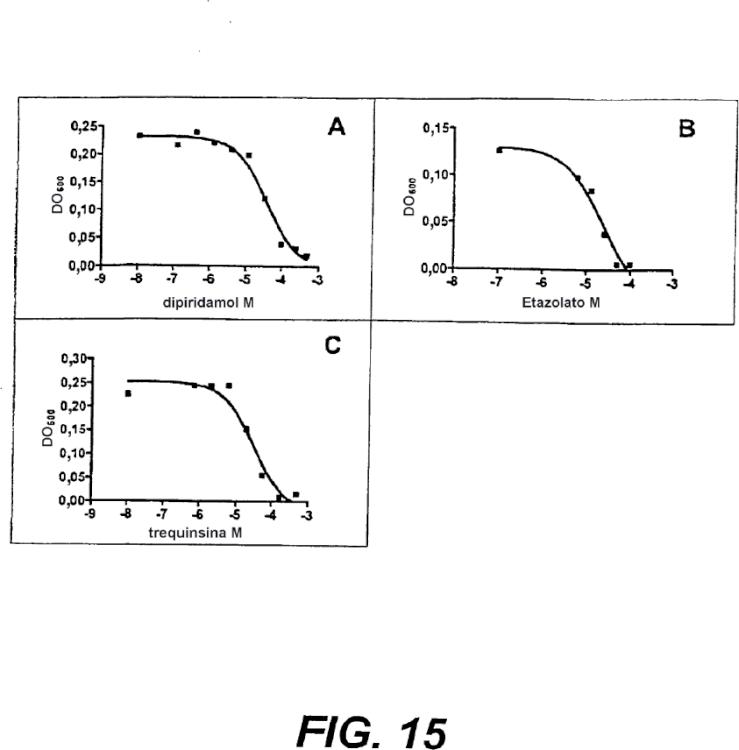
13. Proteína de la reivindicación 3 ó 4, o el ácido nucleico de la reivindicación 6 u 8, en donde la proteína hidroliza sustancialmente AMPc en presencia de hasta aproximadamente 100 µM de un inhibidor de fosfodiesterasa seleccionado de cilostamida, zaprinast, etazolato, Ro-20-1724, rolipram, isobutilmetilxantina (IBMX), 8-metoximetil-IBMX, papaverina, milrinona, petoxifilina y eritro-9-(2-hidroxi-3-nonil)adenina. 35
14. Vector que comprende la molécula de ácido nucleico de la reivindicación 6 u 8.
15. Vector de la reivindicación 14 en donde la molécula de ácido nucleico está unida operativamente al menos a una secuencia de control de la expresión.
16. Sistema de vector hospedador que comprende el vector de la reivindicación 14 en una célula hospedadora adecuada. 40
17. Sistema de vector hospedador de la reivindicación 16 en donde la célula hospedadora adecuada es una célula bacteriana.
18. Sistema de vector hospedador de la reivindicación 16 en donde la célula hospedadora adecuada es una célula eucariota.
19. Sistema de vector hospedador de la reivindicación 18 en donde la célula eucariota es Saccharomyces cerevisiae. 45
20. Anticuerpo o fragmento de anticuerpo que comprende un sitio de unión a antígeno que reconoce y se une selectivamente a una proteína de la reivindicación 1, 2, 3 ó 4.
21. Anticuerpo de la reivindicación 20, en donde el anticuerpo es un anticuerpo monoclonal o un anticuerpo policlonal.
22. Anticuerpo de la reivindicación 21, en donde el anticuerpo es quimérico, humanizado o humano.
23. Método para producir una proteína PDE que comprende cultivar el sistema de vector hospedador de la reivindicación 16 en condiciones adecuadas para producir la proteína PDE en el hospedador y recuperar la proteína PDE producida de esta manera.
24. Método para identificar un compuesto que modula la expresión de una proteína de acuerdo con la reivindicación 3 ó 5 4, comprendiendo el método:
(a) incubar una célula que puede expresar dicha proteína con un compuesto en condiciones y durante un tiempo suficientes para que la célula exprese dicha proteína sin el compuesto;
(b) incubar una célula de control en las mismas condiciones y durante el mismo tiempo sin el compuesto;
(c) medir la expresión de dicha proteína en la célula en presencia del compuesto; 10
(d) medir la expresión de dicha proteína en la célula control; y
(e) comparar la cantidad de expresión de dicha proteína en presencia y ausencia del compuesto, en donde una diferencia en el nivel de expresión indica que el compuesto modula la expresión de dicha proteína.
25. Método de la reivindicación 24 en donde el compuesto reduce la expresión de dicha proteína.
26. Método para identificar un compuesto que modula la actividad PDE de Leishmania de la proteína de acuerdo con la 15 reivindicación 3 ó 4, comprendiendo el método:
(a) poner en contacto una línea celular modificada por ingeniería genética para expresar dicha proteína, con un compuesto en condiciones y durante un tiempo suficientes para que la muestra exprese dicha proteína sin el compuesto;
(b) incubar una muestra de control en las mismas condiciones y durante el mismo tiempo sin el compuesto; 20
(c) medir dicha actividad PDE de dicha proteína en la muestra en presencia del compuesto;
(d) medir dicha actividad PDE de dicha proteína en la muestra de control; y
(e) comparar la cantidad de dicha actividad PDE de dicha proteína en presencia y ausencia del compuesto, en donde una diferencia en el nivel de actividad indica que el compuesto modula la actividad PDE de dicha proteína.
27. Método de la reivindicación 24 ó 26, en el cual el compuesto reduce la actividad PDE. 25
28. Organismo no humano modificado genéticamente que comprende el vector de la reivindicación 14 y en el donde se ha desactivado al menos un gen PDE endógeno.
29. Método para detectar la infección por el parásito Leishmania que comprende determinar la cantidad presente en una muestra de un sujeto de al menos una proteína de cualquiera de las reivindicaciones 1 a 4.
30. Método para detectar la infección por el parásito Leishmania que comprende determinar la cantidad presente en una 30 muestra de un sujeto de al menos una molécula de ácido nucleico de cualquiera de las reivindicaciones 5 a 9.
31. Método de la reivindicación 29 ó 30, en donde el parásito Leishmania es Leishmania major.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Producción de FDCA catalizada por deshidrogenasa, del 17 de Junio de 2020, de PURAC BIOCHEM B.V.: Proceso para oxidar ácido 5-hidroximetil-2-furancarboxílico (HMFCA) a ácido 5-formil-2-furoico (FFA), donde el proceso comprende la etapa de incubar una […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para aumentar la expresión de un antígeno patogénico codificado, del 3 de Junio de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica en la dirección 5' → 3' para: i) • una región codificante, que codifica para al menos […]
Microorganismo con productividad de l-lisina aumentada y procedimiento para producir l-lisina utilizando el mismo, del 27 de Mayo de 2020, de CJ CHEILJEDANG CORPORATION: Una subunidad beta prima (subunidad-β') mutante de la ARN polimerasa, en la que la subunidad beta prima (subunidad-β') mutante de la ARN polimerasa tiene […]
Agrupación de genes de biosíntesis de carrimicina, del 27 de Mayo de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Agrupación de genes de biosíntesis de carrimicina, que consiste en 44 genes que comprende: 1) cinco genes de policétido sintasa, incluyendo los residuos […]