Formulación de una solución de paracetamol inyectable, procedimiento de preparación y de acondicionamiento de una solución de este tipo, y dispositivo de acondicionamiento de una solución de este tipo.
Formulación de una solución de paracetamol inyectable lista para usar,
caracterizada porque dicha solución deparacetamol está compuesta únicamente por paracetamol, agua bidestilada y un agente de tamponación, teniendodicha formulación una concentración máxima de paracetamol de 1 g / 100 ml, un pH comprendido entre 5,5 y 6,5, yun contenido de oxígeno inferior a 0,2 ppm.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09152160.
Solicitante: MOLY PHARMA.
Nacionalidad solicitante: Francia.
Dirección: DOMAINE DE PERES 31470 CAMBERNARD FRANCIA.
Inventor/es: DOULEAU,DIDIER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/167 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K47/12 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Acidos carboxílicos; Sus sales o anhídridos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
PDF original: ES-2414086_T3.pdf
Fragmento de la descripción:
Formulación de una solución de paracetamol inyectable, procedimiento de preparación y de acondicionamiento de una solución de este tipo, y dispositivo de acondicionamiento de una solución de este tipo La presente invención se refiere a una formulación simplificada de paracetamol para preparación inyectable lista para usar. Según la invención, dicha solución de paracetamol está compuesta únicamente por paracetamol, agua bidestilada y un agente de tamponación. La invención se refiere igualmente a un procedimiento de preparación y de acondicionamiento de dicha solución y a un dispositivo de acondicionamiento de dicha solución.
El paracetamol, como numerosos principios activos, es sensible a la presencia de oxígeno en el aire así como al oxígeno disuelto en los disolventes acuosos clásicos utilizados para la preparación de soluciones inyectables. La estabilidad de la solución depende además de las condiciones de pH del medio, que pueden evolucionar a lo largo del tiempo mediante reacción con ciertos compuestos químicos que entran en la composición de los artículos de acondicionamiento de la solución.
La degradación química del paracetamol pasa por la formación de 4-paraminofenol y de 3-paraminofenol que se transforman en derivados quinónicos coloreados. La degradación del paracetamol puede desembocar en formas dimerizadas del paracetamol.
Para superar este problema de estabilidad, se han utilizado varios procedimientos que consisten en:
- neutralizar el oxígeno disuelto en la solución mediante la adición a esta última de agentes antioxidantes tales como
ácido ascórbico o cisteína; 25
- eliminar el oxígeno disuelto mediante burbujeo en la solución de un gas inerte tal como nitrógeno o dióxido,
- estabilizar el pH de la solución a alrededor de 6 mediante mezclas de tamponación.
Se dan a conocer dichas soluciones, por ejemplo, en el documento WO 98/05314.
Todos estos procedimientos anteriores tienen una cierta eficacia, pero las soluciones desoxigenadas acondicionadas contienen siempre una cantidad residual de oxígeno disuelto.
Las soluciones de paracetamol del estado de la técnica pueden presentar efectos irritantes o alergizantes ligados a la presencia de agentes antioxidantes.
Además, es conocido que ciertos antioxidantes pueden degradarse bajo el efecto del calor. Así, es indispensable añadir compuestos tales como sales de metales divalentes para conservar la integridad de los antioxidantes.
Así, las fórmulas existentes de paracetamol en solución inyectable están compuestas por numerosos coadyuvantes que vuelven la preparación de la solución compleja y costosa, multiplicando las ocasiones de aporte de oxígeno en la incorporación de materiales a la solución a pesar de las precauciones tomadas a ese respecto.
Por otro lado, para garantizar la estabilidad de la solución acondicionada, los dispositivos de acondicionamiento propuestos son generalmente frascos de vidrio tapados mediante un tapón de elastómero.
Las soluciones pueden acondicionarse igualmente en bolsas flexibles cerradas con un tapón de elastómero. El acondicionamiento en bolsa flexible permite asegurar no solo la seguridad de manipulación en los centros sanitarios 50 con respecto a los riesgos de rotura de los frascos de vidrio, sino también la seguridad del paciente por la ausencia de riesgo de entrada de aire en la solución durante la administración del producto, que puede ser el origen de infecciones intrahospitalarias y de riesgos de embolia gaseosa.
En el campo de la técnica del relleno de estos dos tipos de acondicionamientos, el frasco de vidrio obliga a 55 conservar un espacio de aire entre el líquido y el tapón para permitir la operación de esterilización y evitar la explosión del frasco o su destape accidental durante esta operación. Este espacio de cabeza debe ser del orden de 20 a 30 ml y debe rellenarse con gas inerte o ponerse a vacío.
La bolsa flexible tiene como ventaja permitir un relleno mayor del volumen útil y reducir el espacio de cabeza a un 60 volumen del orden de 5 a 10 ml sin necesidad de tratar el contenido gaseoso de este espacio. Además, el material plástico permite esterilizar las bolsas sin riesgo de explosión o fisuración.
Aunque todos los dispositivos de acondicionamiento anteriores propuestos tienen como objeto principal proteger a la solución del entorno exterior, no permiten resolver el problema de la oxidación debida al oxígeno disuelto en la 65 solución.
El objetivo principal de la presente invención es proteger a la solución de paracetamol contra la oxidación posterior por el oxígeno disuelto en la solución procedente de operaciones de preparación de la solución.
Para paliar los problemas técnicos descritos anteriormente, el concepto de la presente invención está basado en: 5
- una formulación simplificada de la solución de paracetamol en la que el número de componentes de las materias primas se reduce para permitir optimizar las operaciones y el tiempo de preparación;
- un procedimiento de preparación automática que integra el control continuo de los parámetros de calidad de la solución, tales como el contenido de oxígeno, el título de paracetamol y el pH;
- un dispositivo de acondicionamiento que incorpora un absorbente de oxígeno que permita captar el oxígeno disuelto en la solución de paracetamol.
Con este fin, la invención se refiere a una formulación de una solución de paracetamol inyectable lista para usar.
Según la invención, la formulación de la solución de paracetamol está compuesta únicamente por paracetamol, agua bidestilada y un agente de tamponación, teniendo dicha formulación una concentración máxima de paracetamol de 1 g/100 ml, un pH comprendido entre 5, 5 y 6, 5 y un contenido de oxígeno inferior a 0, 2 ppm.
Dicha formulación simplificada permite optimizar las operaciones y el tiempo de preparación de la solución. Permite una economía de costes de fabricación con relación a las formulaciones existentes. Además, el número reducido de materias primas en la formulación permite integrar el conjunto de operaciones de preparación en un reactor estanco único e igualmente suprimir los riesgos de aporte de oxígeno e impurezas en las operaciones de preparación.
De preferencia, el agente de tamponación elegido es un agente de tamponación de acetato que solo aporta a la formulación propuesta en la presente invención componentes químicos idénticos al radical acetilo de la molécula de paracetamol.
La mezcla de tampón acetato permite estabilizar el pH de la solución a entre 5, 5 y 6, 5 y, de preferencia a pH 6, para optimizar la estabilidad del paracetamol y autorizar el acondicionamiento de la solución en bolsa flexible de PVC que puede causar, a lo largo del tiempo, una disminución del pH de la solución e influir en la estabilidad del principio activo.
De preferencia, esta mezcla de tampón acetato está compuesta por acetato de sodio trihidratado y ácido acético glacial.
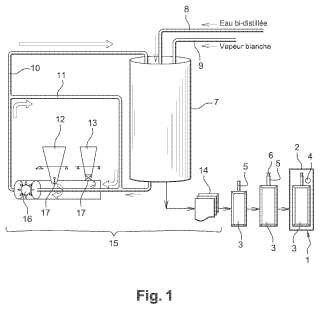
La invención se refiere igualmente a un procedimiento de preparación y acondicionamiento de una solución de paracetamol tal como se describe anteriormente mediante un reactor estanco, estando compuesto dicho reactor por una cuba ligada de manera estanca con un circuito de distribución de agua bidestilada, un circuito de inyección de vapor de agua blanco bidestilada, un circuito de disolución de paracetamol y acetato de sodio, un microdosificador de ácido acético glacial y un circuito de transferencia de solución.
Según la invención, el procedimiento incluye las etapas siguientes consistentes en:
a) introducir un volumen de agua bidestilada en la cuba a través del circuito de distribución de agua bidestilada, limpiándose la cuba previamente con vapor de agua bidestilada blanco;
b) enfriar el volumen de agua hasta una temperatura comprendida entre 30 y 35ºC;
c) controlar el contenido de oxígeno disuelto en el volumen de agua y proceder a una desoxigenación mediante vapor de agua bidestilada blanco si el contenido de oxígeno es superior a 0, 2 ppm;
d) introducir por aspiración el paracetamol y el acetato de sodio en forma de polvo en dicho circuito de disolución,
disolviéndose a continuación el paracetamol y acetato de sodio en el circuito de disolución mediante un ultradispersor;
e) remitir la mezcla obtenida en la etapa d) a la cuba a través del circuito de transferencia,
f) ajustar el pH de la solución mediante el microdosificador de ácido acético glacial y ajustar entonces el volumen final de la mezcla con la ayuda de agua bidestilada;
g)... [Seguir leyendo]
Reivindicaciones:
1. Formulación de una solución de paracetamol inyectable lista para usar, caracterizada porque dicha solución de paracetamol está compuesta únicamente por paracetamol, agua bidestilada y un agente de tamponación, teniendo dicha formulación una concentración máxima de paracetamol de 1 g / 100 ml, un pH comprendido entre 5, 5 y 6, 5, y un contenido de oxígeno inferior a 0, 2 ppm.
2. Formulación según la reivindicación 1, caracterizada porque el agente de tamponación es un agente de tamponación acoplado compuesto por acetato de sodio y ácido acético. 10
3. Formulación según la reivindicación 1 o 2, caracterizada porque el pH de la solución es de 6.
4. Formulación según una de las reivindicaciones 1 a 3, caracterizada porque contiene 1 g/100ml de paracetamol.
5. Procedimiento de preparación y acondicionamiento de una solución de paracetamol según una de las reivindicaciones 1 a 4 mediante un reactor estanco (15) , estando compuesto dicho reactor por una cuba (7) ligada de manera estanca con un circuito de distribución de agua bidestilada (8) , un circuito de inyección de vapor de agua bidestilada blanco (9) , un circuito de disolución (11) de paracetamol y de acetato de sodio y un circuito de transferencia de solución (10) , caracterizado porque dicho procedimiento incluye las etapas siguientes consistentes en:
a) introducir un volumen de agua bidestilada en la cuba (7) a través del circuito de distribución de agua bidestilada (8) , limpiándose la cuba previamente con vapor de agua bidestilada blanco;
b) enfriar el volumen de agua hasta una temperatura comprendida entre 30 y 35ºC;
c) controlar el contenido de oxígeno disuelto en el volumen de agua y proceder a una desoxigenación mediante vapor de agua bidestilada blanco si el contenido de oxígeno es superior a 0, 2 ppm;
d) introducir por aspiración el paracetamol y el acetato de sodio en forma de polvo en dicho circuito de disolución (11) , disolviéndose a continuación el paracetamol y acetato de sodio en el circuito de disolución mediante un ultradispersor (16) ;
e) remitir la mezcla obtenida a la salida del circuito de disolución a la cuba a través del circuito de transferencia (10) ,
f) ajustar el pH de la solución mediante ácido acético glacial y completar el volumen final de la mezcla con agua bidestilada;
g) controlar el contenido de oxígeno de la solución y proceder a una desoxigenación mediante vapor blanco si el 40 contenido de oxígeno es superior a 0, 2 ppm;
h) hacer pasar la solución de paracetamol a través de un primer filtro (14) de 0, 45 μm y entonces un segundo filtro (14) de 0, 22 μm;
i) proceder a la etapa de acondicionamiento consistente en rellenar una bolsa flexible (3) con la solución de paracetamol filtrada de la etapa h) , y cerrar de manera estanca dicha bolsa (3) en un envase secundario (2) con un absorbente de oxígeno (4) ; y
porque se realizan las etapas a) a h) en dicho reactor estanco (15) en atmósfera desoxigenada con vapor de agua 50 bidestilada blanco.
6. Procedimiento según la reivindicación 5, caracterizado porque la bolsa flexible (3) que contiene la solución de paracetamol incluye un espacio de cabeza de un volumen de aire limitado comprendido entre 5 y 10 cm3.
7. Procedimiento según la reivindicación 5 o 6, caracterizado porque en la etapa i) se realiza un vacío parcial en dicho envase secundario (2) antes de encerrar dicha bolsa flexible (3) y dicho absorbente (4) en el envase secundario (2) .
8. Procedimiento según una de las reivindicaciones 5 a 7, caracterizado porque la etapa i) del procedimiento se 60 realiza en una sala limpia de acondicionamiento de clase A o B, de manera que se evite la etapa de esterilización en autoclave.
9. Procedimiento según una de las reivindicaciones 5 a 7, caracterizado porque si la etapa i) del procedimiento se realiza en una sala limpia de acondicionamiento de clase C, el procedimiento comprende una etapa suplementaria 65 de esterilización por autoclave de la solución acondicionada después de la etapa i) .
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]