Formulación de fulvestrant.
Una formulación farmacéutica que comprende fulvestrant en un vehículo de ricinoleato,
un disolvente no acuoso de tipo éster farmacéuticamente aceptable, y un alcohol farmacéuticamente aceptable, en la que la formulación está adaptada para la administración por vía intramuscular, y que logra una concentración terapéuticamente significativa de fulvestrant en plasma sanguíneo durante al menos dos semanas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2001/000049.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: 151 85 SÖDERTÄLJE SUECIA.
Inventor/es: EVANS, JOHN, RAYMOND, GRUNDY, ROSALIND, URSULA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/565 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K47/14 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K47/44 A61K 47/00 […] › Aceites, grasas o ceras previstas en dos o más grupos de A61K 47/02 - A61K 47/42; Aceites naturales o aceites naturales modificados, grasas o ceras, p. ej. aceite de ricino, aceite de ricino polietoxilado, cera Montana, lignito, goma laca, colofonía, cera de abeja o lanolina (glicéridos sintéticos, p. ej. triglicéridos de cadena mediana, A61K 47/14).
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.

Fragmento de la descripción:
Formulación de fulvestrant.
La invención se refiere a una nueva formulación farmacéutica de liberación sostenida, adaptada para administrarla mediante inyección, que contiene el compuesto 7α-[9- (4, 4, 5, 5, 5-pentafluoropentilsulfinil) nonil]estra-1, 3, 5 (10) -trieno-3, 17β-diol, más particularmente a una formulación adaptada para la administración mediante inyección, que contiene el compuesto 7α-[9- (4, 4, 5, 5, 5-pentafluoropentil-sulfinil) nonil]estra-1, 3, 5 (10) trieno-3, 17β-diol en disolución en un vehículo de ricinoleato que comprende adicionalmente al menos un alcohol y un disolvente no acuoso de tipo éster que es miscible con el vehículo de ricinoleato.
La privación de estrógenos es fundamental en el tratamiento de muchas enfermedades benignas o malignas de las mamas y del aparato reproductor. En las mujeres premenopáusicas, esto se consigue mediante la ablación de la función ovárica por medios quirúrgicos, radioterapéuticos o médicos; y, en las mujeres posmenopáusicas, mediante el uso de inhibidores de la aromatasa.
Un enfoque alternativo a la retirada de estrógenos consiste en antagonizar los estrógenos con antiestrógenos. Estos son fármacos que se fijan a los receptores de estrógenos (ER) presentes en los núcleos de tejidos que responden a los estrógenos, y que compiten por ellos. Los antiestrógenos convencionales no esteroideos, tales como el tamoxifeno, compiten eficazmente por la fijación a ER pero su eficacia esta limitada frecuentemente por el agonismo parcial que ponen de manifiesto, lo que da por resultado un bloqueo incompleto de la actividad que ocurre por mediación de los estrógenos (Furr y Jordan 1984, May y Westley 1987) .
El potencial de los antiestrógenos no esteroideos que para presentar propiedades como agonístas impulsó la búsqueda de nuevos compuestos que pudieran fijarse a ER con alta afinidad sin activar ninguna de las respuestas hormonales transcripcionales normales y, ni las manifestaciones consiguientes de los estrógenos. Tales moléculas serían antiestrógenos puros
, distinguibles con claridad de los ligandos semejantes al tamoxifeno y capaces de provocar la ablación completa de los efectos tróficos de los estrógenos. Tales compuestos son denominados a la baja de Receptores de Estrógenos (Estrogen Receptor-Downregulators) (E.R.D.) . La explicación teórica para el diseño y ensayo de antiestrógenos puros, nuevos, se ha descrito por Bowler et al., 1989; Wakeling 1990a, 1990b, 1990c, Wakeling y Bowler, 1987, 1988.
Los análogos esteroideos del estradiol, con una cadena lateral de alquilsulfinilo en la posición 7 α proporcionaron los primeros ejemplos de compuestos desprovistos de actividad estrogénica (Bowler et al., 1989) . Uno de estos, el 7α-[9- (4, 4, 5, 5, 5-pentafluoropentilsulfinil) nonil]estra-1, 3, 5- (10) trieno-3, 17β-diol se seleccionó para llevar a cabo un estudio completo sobre la base de su actividad de antagonista de estrógenos puro y de su potencia antiestrogénica sensiblemente aumentada con respecto a otros antiestrógenos que se encuentran disponibles. Los descubrimientos y las experiencias clínicas preliminares, in vitro, con el 7α-[9- (4, 4, 5, 5, 5-pentafluoropentilsulfinil) nonil]estra-1, 3, 5 (10) -trieno-3, 17β-diol han promovido el interés en el desarrollo del fármaco como agente terapéutico para indicaciones dependientes de estrógenos tales como el cáncer de mama y ciertas afecciones ginecológicas benignas.
Al 7α-[9- (4, 4, 5, 5, 5-pentafluoropentilsulfinil) nonil]estra-1, 3, 5- (10) -trieno-3, 17β-diol, o ICI 182.780, se le ha asignado la denominación común internacional fulvestrant, que se utiliza en esta memoria en lo sucesivo. Cuando se hace referencia al fulvestrant, se incluyen sus sales farmacéuticamente aceptables y cualesquiera posibles solvatos de los mismos.
El fulvestrant se fija a ER con una afinidad similar a la del estradiol, y bloquea completamente la acción estimulante del crecimiento del estradiol sobre las células del carcinoma de mama humano, in vitro; es más potente y más eficaz que el tamoxifeno a este respecto. El fulvestrant bloquea completamente la acción uterotrófica del estradiol en ratas, ratones y monos, y bloquea también la actividad uterotrófica del tamoxifeno.
Debido a que el fulvestrant carece de la actividad estimulante semejante a la de los estrógenos, que es característica de los antiestrógenos clínicamente disponible, tales como el tamoxifeno o el toremifeno, puede ofrecer una actividad terapéutica mejorada que se caracteriza por una regresión tumoral más rápida, completa o de mayor duración; una menor incidencia o velocidad de desarrollo de resistencia al tratamiento; y una reducción de la invasividad tumoral.
En ratas adultas intactas, el fulvestrant logra la regresión máxima del útero a una dosis que no afecta adversamente a la densidad ósea ni lleva a una secreción aumentada de la gonadotrofina. Si esto fuera cierto también en humanos, estos descubrimientos podrían ser, desde el punto de vista clínico, de suma importancia. La densidad ósea reducida limita la duración del tratamiento ablativo de estrógenos para la endometriosis. El fulvestrant no bloquea los ER hipotalámicos. La ablación de estrógenos ocasiona o exacerba también los sofocos y otros síntomas menopáusicos; el fulvestrant no ocasionará tales efectos debido a que no atraviesa la barrera hematoencefálica.
La solicitud de patente europea No. 0 138 504 describe que ciertos derivados de esteroides son agentes antiestrogénicos eficaces. La descripción incluye información relativa a la preparación de los derivados de esteroides. En particular, existe la descripción dentro del Ejemplo 35 del compuesto 7α-[9- (4, 4, 5, 5, 5-pentafluoropentilsulfinil) nonil]estra-1, 3, 5 (10) -trieno-3, 17β-diol, cuyo compuesto es citado específicamente en la Reivindicación 4. Se describe también que los compuestos de aquella invención se pueden proporcionar para uso en forma de una composición farmacéutica que comprende un derivado esteroideo de la invención junto con un diluyente o vehículo farmacéuticamente aceptable. Se establece en ella que la composición puede tener una forma adecuada para la administración oral o parenteral.
El fulvestrant muestra, junto con otros compuestos a base de esteroides, ciertas propiedades físicas que hacen difícil la formulación de estos compuestos. El fulvestrant es una molécula particularmente lipófila, incluso en comparación con otros compuestos esteroideos, y su solubilidad en medios acuosos es sumamente baja, en torno a los 10 ng.ml- 1 (esta es una cifra estimada de un soluto en una mezcla de agua/disolvente, dado que no pudieron obtenerse medidas tan bajas como ésta en un soluto en agua solamente) .
En la actualidad existen varias formulaciones de esteroides inyectables de liberación sostenida que se han comercializado. Habitualmente, estas formulaciones emplean un aceite como disolvente y en ellas pueden encontrarse presentes excipientes adicionales. Seguidamente, en la Tabla 1, se describen algunas formulaciones inyectables de liberación sostenida, comercializadas.
En las formulaciones que se indican en la Tabla 1, se emplean varios aceites diferentes para solubilizar el compuesto, y se han utilizado excipientes adicionales tales como benzoato de bencilo, alcohol bencílico y etanol. Los volúmenes de aceite necesarios para solubilizar el esteroide que constituye el ingrediente activo, son bajos. Una liberación prolongada puede conseguirse para periodos desde 1 a 8 semanas.
(Tabla pasa a página siguiente)
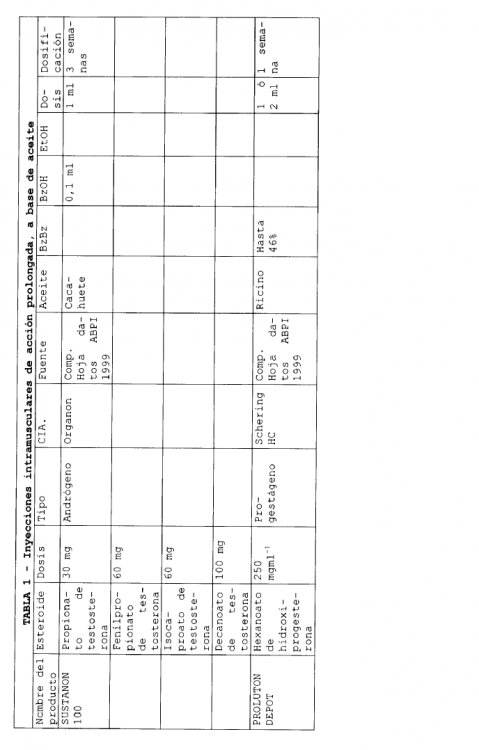
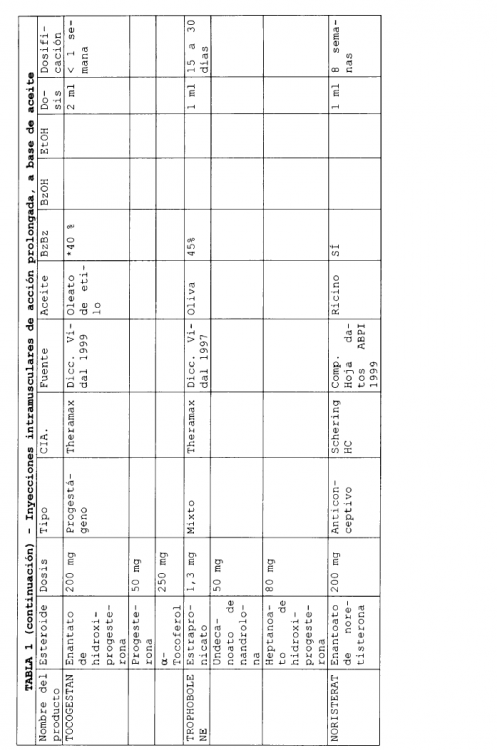
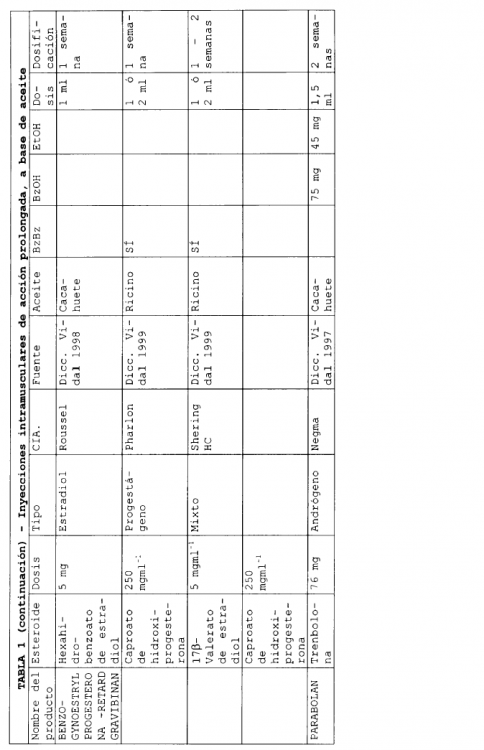
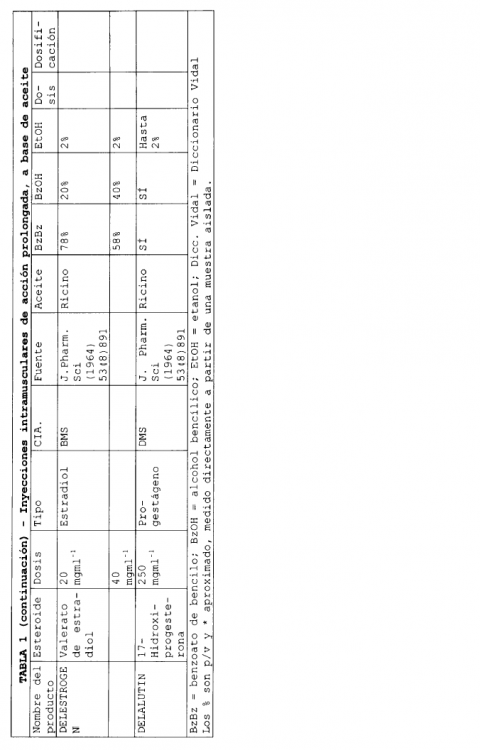
En el documento 5.183.814, Ejemplo 3, se describe una formulación de fulvestrant para inyección, de base oleosa, que comprende 50 mg de fulvestrant, 400 mg de alcohol bencílico y aceite de ricino suficiente para completar el volumen de la disolución hasta 1 ml. La fabricación a escala comercial de una formulación tal como la descrita en el documento US 5.183.814 será complicada por la elevada concentración de alcohol. Por tanto, existe la necesidad de rebajar la concentración en alcohol en formulaciones de fulvestrant al tiempo que se impide la precipitación de fulvestrant en la formulación.
La Tabla 2 muestra la solubilidad del fulvestrant en varios disolventes distintos.
...
Reivindicaciones:
1. Una formulación farmacéutica que comprende fulvestrant en un vehículo de ricinoleato, un disolvente no acuoso de tipo éster farmacéuticamente aceptable, y un alcohol farmacéuticamente aceptable, en la que la formulación está adaptada para la administración por vía intramuscular, y que logra una concentración terapéuticamente significativa de fulvestrant en plasma sanguíneo durante al menos dos semanas.
2. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 30% o menos, en peso, de un alcohol farmacéuticamente aceptable por volumen de formulación, al menos 1% en peso de un disolvente no acuoso de tipo éster farmacéuticamente aceptable, miscible en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación que es capaz de lograr, tras la inyección, una concentración terapéuticamente significativa de fulvestrant en plasma sanguíneo durante al menos dos semanas.
3. Una formulación farmacéutica según la reivindicación 1 ó 2, en la que la concentración lograda de fulvestrant en plasma sanguíneo es al menos 2, 5 ng.ml- 1 durante al menos dos semanas.
4. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 30% o menos, en peso, de un alcohol farmacéuticamente aceptable por volumen de formulación, al menos 1% en peso de un disolvente no acuoso de tipo éster farmacéuticamente aceptable, miscible en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación de al menos 45 mg.ml- 1 de fulvestrant.
5. Una formulación farmacéutica según la reivindicación 1 a 4, que contiene 25% p/v, o menos, de un alcohol farmacéuticamente aceptable.
6. Una formulación farmacéutica según la reivindicación 5, que contiene 20% p/v, o menos, de un alcohol farmacéuticamente aceptable.
7. Una formulación farmacéutica según la reivindicación 5, que contiene 15-25% p/v de un alcohol farmacéuticamente aceptable.
8. Una formulación farmacéutica según la reivindicación 5, que contiene 17-23% p/v de un alcohol farmacéuticamente aceptable.
9. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 8, que contiene 60% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
10. Una formulación farmacéutica según la reivindicación 9, que contiene 50% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
11. Una formulación farmacéutica según la reivindicación 9, que contiene 45% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
12. Una formulación farmacéutica según la reivindicación 9, que contiene 40% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
13. Una formulación farmacéutica según la reivindicación 9, que contiene 35% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
14. Una formulación farmacéutica según la reivindicación 9, que contiene 30% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
15. Una formulación farmacéutica según la reivindicación 9, que contiene 25% p/v, o menos de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
16. Una formulación farmacéutica según la reivindicación 9, que contiene 10-25% p/v de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
17. Una formulación farmacéutica según la reivindicación 9, que contiene 12-18% p/v de un disolvente no acuoso de tipo éster farmacéuticamente aceptable.
18. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 15-25% en peso de un alcohol farmacéuticamente aceptable por volumen de formulación, 10-25% en peso de un disolvente no acuoso de tipo éster farmacéuticamente aceptable, miscible en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación de al menos 45 mg.ml- 1 de fulvestrant.
19. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 17-23% en peso de un alcohol farmacéuticamente aceptable por volumen de formulación, 12-18% en peso de un disolvente no acuoso de tipo éster farmacéuticamente aceptable, miscible en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación de al menos 45 mg.ml- 1 de fulvestrant.
20. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 19, en la que el alcohol farmacéuticamente aceptable es una mezcla de etanol y alcohol bencílico.
21. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 20, en la que el disolvente no acuoso de tipo éster farmacéuticamente aceptable se selecciona de benzoato de bencilo, oleato de etilo, miristato de isopropilo, palmitato de isopropilo, o una mezcla de cualquiera de ellos.
22. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 21, en la que el disolvente no acuoso de tipo éster farmacéuticamente aceptable es el benzoato de bencilo.
23. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 15-25% en peso de un alcohol farmacéuticamente aceptable por volumen de formulación, 10-25% en peso de benzoato de bencilo en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación de al menos 45 mg.ml- 1 de fulvestrant.
24. Una formulación farmacéutica adaptada para inyección intramuscular que comprende fulvestrant, 17-23% en peso de un alcohol farmacéuticamente aceptable por volumen de formulación, 12-18% en peso de benzoato de bencilo en un vehículo de ricinoleato, por volumen de formulación, y una cantidad suficiente de un vehículo de ricinoleato, para preparar de este modo una formulación de al menos 45 mg.ml- 1 de fulvestrant.
25. Una formulación farmacéutica según la reivindicación 23 ó 24, en la que el alcohol farmacéuticamente aceptable es una mezcla de etanol y alcohol bencílico.
26. Una formulación farmacéutica según la reivindicación 25, en la que el etanol y el alcohol bencílico se encuentran presentes a alrededor del mismo % en peso por volumen de formulación.
27. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 26, en la que el volumen total de la formulación es 6 ml, o menos, y la concentración de fulvestrant es al menos 45 mg.ml- 1.
28. Una formulación farmacéutica según cualquiera de las reivindicaciones 1 a 27, en la que la cantidad total de fulvestrant en la formulación es 250 mg, o más, y el volumen total de la formulación es 6 ml, o menos.
29. Una formulación farmacéutica según la reivindicación 28, en la que la cantidad total de fulvestrant en la formulación es 250 mg, y el volumen total de la formulación es 5 a 5, 25 ml.
30. Una formulación farmacéutica según cualquiera de las reivindicaciones 1-29, en la que el alcohol farmacéuticamente aceptable es una mezcla de 10% en peso de etanol por volumen de formulación, 10% en peso de alcohol bencílico por volumen de formulación, y la formulación contiene 15% en peso de benzoato de bencilo por volumen de formulación, y el vehículo de ricinoleato es aceite de ricino.
31. Una formulación farmacéutica adaptada para inyección intramuscular, según cualquiera de las reivindicaciones 1 a 30, para uso en terapia médica.
32. Uso de fulvestrant en la preparación de una formulación farmacéutica, según cualquiera de las reivindicaciones 1 a 30, para el tratamiento de una enfermedad benigna o maligna de las mamas o del aparato reproductor.
33. Una jeringa o vial que contiene una formulación farmacéutica según la reivindicación 30.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.