Formulación farmacéutica de liberación sostenida que comprende fenilefrina.
Una composición farmacéutica adecuada para la administración oral,
en la que la composición comprende:
a) un núcleo que comprende una matriz polimérica que comprende hidroxipropilcelulosa y sal sódica decarboximetilcelulosa, y fenilefrina o una sal farmacéuticamente aceptable de la misma; y
b) una capa erosionable, que opcionalmente comprende fenilefrina o una sal farmacéuticamente aceptable de lamisma;
en la que, después de la ingestión de la composición por un sujeto, al menos una parte de la fenilefrina se absorbeen el colon del sujeto.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/013050.
Solicitante: MSD Consumer Care, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3030 Jackson Avenue Memphis TN 38151 ESTADOS UNIDOS DE AMERICA.
Inventor/es: REO, JOSEPH P., MONTEITH,DAVID, O\'\'MULLANE,JOHN, NOWAK,ROBERT T, WAN,JIANSHENG, KABIR,MOHAMMED A, ABUTARIF,MALAZ A, FRITZ,GLENN E.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/137 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/36 A61K 9/00 […] › que contienen hidratos de carbono o sus derivados (A61K 9/34 tiene prioridad).
PDF original: ES-2391585_T3.pdf
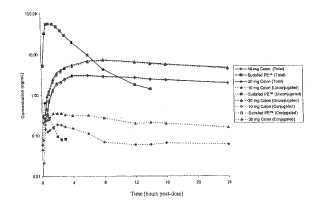
Fragmento de la descripción:
Formulación farmacéutica de liberación sostenida que comprende fenilefrina
Antecedentes de la invención
La fenilefrina y sus sales farmacéuticamente aceptables están reconocidas por los expertos en la materia como un descongestivo nasal inocuo y eficaz para seres humanos cuando se administra a intervalos frecuentes. Las formulaciones disponibles en el mercado incluyen gel nasal, gotas nasales y pulverización nasal (es decir, gotas nasales de Aiconefrin® o gel nasal de Neo-Synephrine®) , así como comprimidos orales de liberación inmediata o cápsulas de gelatina (es decir, Sudafed PE™ o DayQuil® LiquiCaps) . Debido a la corta semivida de las especies de fenilefrina activas en plasma in vivo, la fenilefrina y sus sales farmacéuticamente aceptables como se formulan normalmente, se administran normalmente cada cuatro horas para el alivio de la congestión nasal.
Por lo tanto, existe la necesidad no satisfecha de un suministro menos frecuente de fenilefrina para mayor comodidad del paciente y para conseguir una disponibilidad sostenida de la fenilefrina terapéuticamente activa dentro de un sujeto que necesite tal administración.
La administración menos frecuente da como resultado una mejor adherencia del paciente a los regímenes de dosificación apropiados. Además, los niveles en plasma terapéuticos constantes de los componentes activos pueden ser más efectivos e incluso eficaces en comparación con las fluctuaciones observadas cuando se proporcionan dosis múltiples de una formulación de liberación inmediata convencional, al proporcionar niveles eficaces sostenidos y disminuir la gravedad y frecuencia de los efectos secundarios observados con niveles de plasma máximos elevados. Por lo tanto, se necesitan formulaciones de fenilefrina que puedan administrarse con menos frecuencia, por ejemplo, una vez cada 8, 12, 16, 20 o 24 horas.
La patente de Estados Unidos US 3 558 768 describe una composición de liberación sostenida que comprende fenilefrina en la que la liberación del fármaco está controlada por la capa de cubierta.
Sumario de la invención
La presente invención proporciona composiciones y procedimientos para el suministro eficaz de fenilefrina para proporcionar una biodisponibilidad mejorada y sostenida que proporcione fenilefrina eficaz además de aumentar la comodidad. La invención se basa, en parte, en la observación por parte de los inventores de que la fenilefrina se absorbe eficazmente desde el colon y su apreciación de que las formulaciones que permiten la absorción desde el colon proporcionarán una mayor proporción de fenilefrina remanente en una forma no conjugada terapéuticamente activa, en comparación con las formulaciones que permiten la absorción desde áreas superiores del tracto gastrointestinal (GI) . La administración de una formulación que proporciona absorción desde el colon tiene la ventaja adicional de mantener concentraciones en plasma de fenilefrina activa con una sola administración de una píldora de gran tamaño del fármaco.
En un aspecto, la invención proporciona composiciones farmacéuticas adecuadas para la administración oral que comprenden fenilefrina o una sal farmacéuticamente aceptable de la misma, en las que la fenilefrina pasa a estar disponible para la absorción desde el colon. La composición es una formulación sólida que comprende: un núcleo que comprende una matriz polimérica que comprende hidroxipropilcelulosa y sal sódica de carboximetil celulosa, y fenilefrina o una sal farmacéuticamente aceptable de la misma, y una capa erosionable que encapsula al núcleo, en la que la composición y el grosor de la capa erosionable son tales que el núcleo queda expuesto cuando la composición entra en el colon o aproximadamente en el momento en el que la composición alcanza el colon.
En ciertas realizaciones, la capa erosionable comprende una matriz polimérica. En otras realizaciones, la capa erosionable es un revestimiento. En un aspecto, la capa erosionable es una matriz polimérica de cierta composición y grosor de manera que la capa se erosiona a lo largo de un determinado periodo de tiempo. En otro aspecto, la capa erosionable es una matriz polimérica o un revestimiento de cierta composición que se erosiona cuando se encuentra con un cierto entorno. En ciertas realizaciones, la capa erosionable se erosiona a un cierto pH. En otras realizaciones, la capa erosionable comprende sustratos específicos de colon y se erosiona en el colon. En ciertas realizaciones, el sustrato específico de colon se erosiona en presencia de enzimas específicas de colon y no mientras atraviesa el tracto digestivo superior, incluyendo el estómago y/o el intestino delgado. En otro aspecto, la invención proporciona composiciones farmacéuticas adecuadas para la administración oral que comprenden fenilefrina o una sal farmacéuticamente aceptable de la misma, en las que la fenilefrina pasa a estar disponible para la absorción en todas las partes del tracto GI incluyendo el duodeno, yeyuno, íleon y colon. Ciertas realizaciones de la invención son composiciones farmacéuticas formuladas como una sola forma de dosificación para suministrar fenilefrina o una sal farmacéuticamente aceptable de la misma a un sujeto que lo necesita, para proporcionar una concentración máxima de fenilefrina no metabolizada en el plasma (de dicho sujeto) aproximadamente de 0, 1 a 16 horas después de la ingestión de la composición, y en las que la fenilefrina no metabolizada se mantiene a un nivel mayor de 0, 1 ng/ml aproximadamente 6, 8, 12 y/o 24 horas después de la ingestión de la composición.
En ciertas realizaciones, la capa (o capas) erosionable y/u otro componente (o componentes) de la composición distintos del núcleo comprende (o comprenden) fenilefrina o una sal farmacéuticamente aceptable de la misma. Por ejemplo, además del núcleo que comprende fenilefrina o una sal farmacéuticamente aceptable de la misma, la fenilefrina también se dispersa en una capa erosionable que comprende una matriz polimérica. La matriz polimérica comprende fenilefrina o una sal farmacéuticamente aceptable de la misma para la liberación inmediata.
En ciertas realizaciones, la composición comprende adicionalmente un revestimiento entérico y/o un revestimiento superior, en la que el revestimiento superior actúa mejorando el aspecto o palatabilidad de la formulación.
En una realización, la composición es una formulación de cápsula en la que la fenilefrina o una sal farmacéuticamente aceptable de la misma se encierra en una cápsula que descarga su contenido cuando la composición entra en el colon, o aproximadamente en el momento en el que la composición alcanza el colon. En una realización, la composición es una formulación de cápsula en la que la fenilefrina o una sal farmacéuticamente aceptable de la misma se encierra en una cápsula que descarga una parte de su contenido cuando la composición entra en el colon.
En una realización, la formulación de cápsula comprende adicionalmente fenilefrina o una sal farmacéuticamente aceptable de la misma para liberación inmediata y/o uno o más agentes terapéuticos adicionales para la liberación inmediata o sostenida.
En una realización, la composición farmacéutica de la invención se formula de tal manera que es adecuada para el uso pediátrico.
En una realización, la composición farmacéutica comprende adicionalmente uno o más agentes terapéuticos adicionales. Dicho agente o agentes pueden formularse para la liberación inmediata después de la ingestión, para la liberación sostenida, para la liberación en el colon conjuntamente con fenilefrina, o cualquier combinación de las mismas. El agente terapéutico adicional puede ser un descongestivo, un antipirético, un antiinflamatorio, un supresor de la tos, un expectorante, analgésico o cualquier otro agente terapéutico o combinaciones de dichos agentes, útil para aliviar los síntomas de un resfriado, alergia estacional y otras alergias, fiebre del heno o problemas de sinusitis, de los que cualquiera puede producir un aumento en la secreción nasal.
Otro aspecto de la invención es el uso de una composición de la invención para la fabricación de un medicamento para tratar los síntomas del resfriado, gripe, alergias o rinitis no alérgicas en un sujeto que lo necesite. En ciertas realizaciones, la composición está en una forma para administración cada 8, 12, 16, 20 o 24 horas. En una realización preferida, la composición está en una forma para administración cada 12 horas.
Otro... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica adecuada para la administración oral, en la que la composición comprende:
a) un núcleo que comprende una matriz polimérica que comprende hidroxipropilcelulosa y sal sódica de carboximetilcelulosa, y fenilefrina o una sal farmacéuticamente aceptable de la misma; y
b) una capa erosionable, que opcionalmente comprende fenilefrina o una sal farmacéuticamente aceptable de la misma;
en la que, después de la ingestión de la composición por un sujeto, al menos una parte de la fenilefrina se absorbe en el colon del sujeto.
2. La composición farmacéutica de la reivindicación 1, en la que al menos el 5 % en peso de la fenilefrina o una sal farmacéuticamente aceptable de la misma se absorbe en el colon del sujeto.
3. La composición farmacéutica de acuerdo con la reivindicación 1, en la que el núcleo comprende uno o más gránulos que comprenden fenilefrina o una sal farmacéuticamente aceptable de la misma.
4. La composición farmacéutica de acuerdo con la reivindicación 3, en la que uno o más gránulos tienen un revestimiento de granulo erosionable sobre la superficie de dicho gránulo (o gránulos) .
5. La composición farmacéutica de acuerdo con la reivindicación 4, en la que el revestimiento de gránulo erosionable comprende un polímero sensible al pH o un polímero específico de colon.
6. La composición farmacéutica de acuerdo con la reivindicación 1, en la que el núcleo comprende adicionalmente un potenciador de la penetración.
7. La composición farmacéutica de acuerdo con la reivindicación 1, en la que la capa erosionable comprende una mezcla de hidroxipropil metilcelulosa, alcohol polivinílico o copolímero de injerto alcohol polivinílico-polietilenglicol y carboximetil celulosa o sal sódica de carboximetil celulosa.
8. La composición farmacéutica de acuerdo con la reivindicación 7, en la que la capa erosionable comprende adicionalmente celulosa microcristalina.
9. La composición farmacéutica de acuerdo con la reivindicación 1, en la que la capa erosionable encapsula parcial
o completamente el núcleo.
10. La composición farmacéutica de la reivindicación 1, en la que el núcleo comprende adicionalmente celulosa microcristalina y/o estearato de magnesio.
11. La composición farmacéutica de la reivindicación 10, en la que la capa erosionable comprende uno o más polímeros a base de alcohol polivinílico.
12. La composición farmacéutica de la reivindicación 11, en la que la capa erosionable comprende adicionalmente loratadina o desloratadina.
13.
30. 600 cPs al 10 %, aproximadamente un 4-5 % (p/p) de hidroxipropil celulos.
15. 300 cPs al 2 %, aproximadamente un 16-17 % (p/p) de sal sódica de carboximetilcelulosa, aproximadamente u.
5. 61 % (p/p) de celulosa microcristalina y aproximadamente un 0, 9-1 % (p/p) de estearato de magnesio; y la capa erosionable comprende los siguientes componentes: aproximadamente un 1-2 % (p/p) de fenilefrina o una sal farmacéuticamente aceptable de la misma y aproximadamente un 6-10 % (p/p) de polímero a base de alcohol polivinílico;
en todos los casos, con respecto al peso total de la composición farmacéutica.
14. La composición farmacéutica de la reivindicación 13, en la que el polímero a base de alcohol polivinílico es un copolímero de injerto de alcohol polivinílico-polietilenglicol.
15. La composición farmacéutica de la reivindicación 13, en la que la capa erosionable comprende además aproximadamente un 0, 9-1 % (p/p) de loratadina o desloratadina con respecto al peso total de la composición farmacéutica.
16.
30. 600 cPs al 10 %, aproximadamente 25 mg de hidroxipropil celulos.
15. 300 cPs al 2 %, aproximadamente 90 mg de sal sódica de carboximetilcelulosa, aproximadamente 332, 5 mg de celulosa microcristalina y aproximadamente 5 mg de estearato de magnesio.
17. La composición farmacéutica de la reivindicación 1 o 16, en la que la capa erosionable comprende los siguientes componentes:
aproximadamente 7, 5 mg de fenilefrina o una sal farmacéuticamente aceptable de la misma y aproximadament.
3. 54 mg de polímero a base de alcohol polivinílico.
18. La composición farmacéutica de la reivindicación 17, en la que el polímero a base de alcohol polivinílico es un copolímero de injerto de alcohol polivinílico-polietilenglicol.
19. La composición farmacéutica de la reivindicación 17, en la que la capa erosionable comprende adicionalmente aproximadamente 5 mg de loratadina o desloratadina.
20. La composición farmacéutica de acuerdo con la reivindicación 1, que adicionalmente comprende un revestimiento externo.
21. La composición farmacéutica de acuerdo con la reivindicación 20, en la que el revestimiento externo contiene fenilefrina o una sal farmacéuticamente aceptable de la misma.
22. La composición farmacéutica de acuerdo con la reivindicación 20, en la que el revestimiento externo es un revestimiento entérico.
23. La composición farmacéutica de acuerdo con la reivindicación 20, en la que el revestimiento externo comprende fenilefrina o una sal farmacéuticamente aceptable de la misma y alcohol polivinílico.
24. La composición farmacéutica de acuerdo con la reivindicación 20, en la que el revestimiento externo comprende fenilefrina o una sal farmacéuticamente aceptable de la misma y copolímero de injerto de alcohol polivinílicopolietilenglicol.
25. La composición farmacéutica de acuerdo con la reivindicación 20, en la que el revestimiento externo comprende: un 1-2 % (p/p) de fenilefrina o una sal farmacéuticamente aceptable de la misma, un 6-10 % (p/p) de polímero a base de alcohol polivinílico y opcionalmente un 0, 9-1 % (p/p) de loratadina;
en todos los casos, con respecto al peso total de la composición farmacéutica.
26. La composición farmacéutica de acuerdo con la reivindicación 1, en la que la capa erosionable es una capa específica de colon; en la que después de la ingestión por un sujeto, la capa específica de colon se degrada por la acción de unas condiciones específicas del colon del sujeto.
27. La composición farmacéutica de acuerdo con la reivindicación 26, en la que las condiciones específicas de colon son una enzima específica de colon.
28. La composición farmacéutica de acuerdo con la reivindicación 27, en la que la capa específica de colon comprende uno o más polímeros seleccionados de uno o más del grupo que consiste en: N, N-dimetilacrilamida, N-tbutilacrilamida, ácido acrílico reticulado con compuestos azoaromáticos, quitosano, goma laca, almidón de guisante, amilosa, amilosa etilcelulosa y una combinación de pectina, quitosano e hidroxipropil metilcelulosa.
29. La composición farmacéutica de acuerdo con la reivindicación 26, en la que la capa específica de colon encapsula al núcleo.
30. La composición farmacéutica de acuerdo con la reivindicación 26, que adicionalmente comprende una capa erosionable adicional que comprende opcionalmente fenilefrina o una sal farmacéuticamente aceptable de la misma.
31. La composición farmacéutica de acuerdo con la reivindicación 26 o 30, que comprende adicionalmente un revestimiento externo.
32. La composición farmacéutica de acuerdo con la reivindicación 31, en la que el revestimiento externo es un revestimiento entérico.
33. La composición farmacéutica de acuerdo con la reivindicación 30, en la que la capa erosionable encapsula la capa específica de colon.
34. La composición farmacéutica para la administración oral de acuerdo con la reivindicación 1, en la que la capa erosionable es una capa sensible al pH que se disgrega completamente en unas condiciones de pH en el colon.
35. La composición farmacéutica de acuerdo con la reivindicación 34, en la que las condiciones de pH son de aproximadamente pH 5, 5 a aproximadamente pH 7, 0.
36. La composición farmacéutica de acuerdo con la reivindicación 35, en la que las condiciones de pH son de aproximadamente pH 5, 7 a aproximadamente pH 6, 8.
37. La composición farmacéutica de acuerdo con la reivindicación 34 que adicionalmente comprende una capa erosionable adicional que encapsula la capa sensible al pH y el núcleo, comprendiendo opcionalmente además la capa erosionable fenilefrina o una sal farmacéuticamente aceptable de la misma.
38. La composición farmacéutica de acuerdo con la reivindicación 34 o 35, que adicionalmente comprende un revestimiento externo.
39. La composición farmacéutica de acuerdo con la reivindicación 38, en la que el revestimiento externo es un revestimiento entérico.
40. La composición farmacéutica de acuerdo con la reivindicación 34, en la que la capa sensible al pH encapsula el núcleo.
41. La composición farmacéutica de acuerdo con la reivindicación 1, 26 o 34, que adicionalmente comprende un revestimiento superior.
42. La composición farmacéutica de acuerdo con la reivindicación 1, 3, 20, 26 o 34, que adicionalmente comprende uno o más agentes terapéuticos adicionales.
43. La composición farmacéutica de acuerdo con la reivindicación 22, en la que uno o más agentes terapéuticos adicionales se formulan en el núcleo, la capa erosionable, un revestimiento externo o cualquier combinación de dos
o más de los mismos.
44. La composición farmacéutica de acuerdo con la reivindicación 1, 3, 20 o 43, en la que uno o más agentes terapéuticos adicionales se formulan en la capa erosionable.
45. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 42 a 44, en la que uno o más agentes terapéuticos adicionales se seleccionan de uno o más del grupo que consiste en un antihistamínico, un analgésico, un antipirético y un agente antiinflamatorio no esteroideo.
46. La composición farmacéutica de acuerdo con la reivindicación 45, en la que el antihistamínico se selecciona del grupo que consiste en difenhidramina, clorfeniramina, tripelenamina, prometazina, clemastina, doxilamina, astemizol, terfenadina, cimetidina, famotidina, nizatidina, ranitidina, cromolina, loratadina, desloratadina, azatidina, fexofenadina, terfenadina, cetirizina, astemizol y levocabastina, sales farmacéuticamente aceptables de los mismos y combinaciones de los mismos.
47. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 42 a 44, en la que uno o más agentes terapéuticos adicionales se formulan en forma de liberación inmediata.
48. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 42 a 44, en la que uno o más agentes terapéuticos adicionales son loratadina o desloratadina en forma de liberación inmediata.
49. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 42 a 44, en la que la composición se formula como una cápsula o un comprimido.
50. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 42 a 44, en la que uno o más agentes terapéuticos adicionales están en forma de liberación sostenida.
51. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1 a 50, para su uso como un medicamento para el tratamiento de los síntomas de resfriado, gripe, alergia o rinitis no alérgica.
52. La composición farmacéutica de acuerdo con la reivindicación 51, en la que el medicamento está en una forma para la administración cada 8 horas, 12 horas o 24 horas.
Patentes similares o relacionadas:
Compuestos y métodos para tratar un trastorno epiléptico, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un compuesto seleccionado de clemizol, o una sal farmacéuticamente aceptable del mismo, para uso en un método de tratamiento de un trastorno […]
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Régimen de dosificación para un agonista del receptor S1P, del 3 de Junio de 2020, de NOVARTIS AG: Uso de un modulador o agonista del receptor S1P en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, mediante […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Formulaciones de partículas inhalables que comprenden un agente antimuscarínico, del 6 de Mayo de 2020, de Crystec Ltd: Una formulación en polvo que comprende partículas de tolterodina o un compuesto relacionado con tolterodina seleccionado de (R)-N,N-diisopropil-3-(2-hidroxi-5-hidroximetilfenil)-3-fenilpropanamina, […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]
Métodos para el tratamiento de la retinopatía diabética proliferativa, del 22 de Abril de 2020, de Acucela, Inc: Un compuesto para su uso en el tratamiento de la retinopatía diabética proliferativa en un paciente que lo necesita, en donde el compuesto tiene la estructura […]
Formulación pediátrica, del 8 de Abril de 2020, de AMGEN INC.: Una formulación de polvo que comprende una cantidad terapéuticamente eficaz de hidrocloruro de (R)-N-[-1-(1- naftil)etil]-3-[3-(trifluorometil)fenil]propan-1-amina […]