FORMULACION FARMACEUTICA QUE COMPRENDE UN COMPUESTO RECEPTOR CB1 EN UNA SOLUCION SOLIDA Y/O DISPERSION SOLIDA.
La presente invención se refiere a una formulación farmacéutica que comprende piperidin-1-ilamida del ácido 5-(4-cloro-fenil)-1-(2,
4-dicloro-feniD-4,5-dihidro-1H-pirazol-3-carboxílico como racemato o enantiómero (R) y (S) o sus mezclas en una solución sólida y/o dispersión sólida
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/001760.
Solicitante: LABORATORIOS DEL DR. ESTEVE, S.A..
Nacionalidad solicitante: España.
Provincia: BARCELONA.
Inventor/es: CASADEVALL PUJALS,GEMMA, SANTANACH,DELISAU,ANGEL.
Fecha de Solicitud: 5 de Marzo de 2008.
Fecha de Publicación: .
Fecha de Concesión: 29 de Agosto de 2011.
Clasificación Internacional de Patentes:
- A61K31/4155 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensados y conteniendo otros heterociclos.
- A61K9/14H4
- A61K9/14H6
Clasificación PCT:
- A61K31/4155 A61K 31/00 […] › no condensados y conteniendo otros heterociclos.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
PDF original: ES-2347633_A1.pdf
Fragmento de la descripción:
Formulación farmacéutica que comprende un compuesto receptor CB1 en una solución sólida y/o dispersión sólida.
Objeto de la invención
La presente invención se refiere a una formulación farmacéutica que comprende piperidin-1-ilamida del ácido 5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico como racemato o enantiómero (R) y (S) o sus mezclas en una solución sólida y/o dispersión sólida.
Breve descripción de la invención
Los cannabinoides son compuestos, que se derivan de la planta Cannabis sativa que se conoce comúnmente como marihuana. El compuesto químico más activo de los cannabinoides que se produce de manera natural es el tetrahidrocannabinol (THC), particularmente
Estos cannabinoides que se producen de manera natural así como sus análogos sintéticos promueven sus efectos fisiológicos por medio de la unión a receptores acoplados a G específicos; los denominados receptores cannabinoides.
Actualmente, se han identificado y clonado dos tipos distintos de receptores que se unen tanto a los cannabinoides que se producen de manera natural como a los sintéticos. Estos receptores, que se denominan CB1 y CB2 participan en una variedad de procesos fisiológicos o fisiopatológicos en seres humanos y animales, por ejemplo procesos relacionados con el sistema nervioso central, sistema inmunitario, sistema cardiovascular, sistema endocrino, sistema respiratorio, el tracto gastrointestinal o con la reproducción, tal como se describe por ejemplo, por Hollister, Pharm. Rev. 38, 1986, 1-20; Reny y Singha, Prog. Drug. Res., 36, 71-114, 1991; Consroe y Sandyk, en Marijuana/Cannabinoids, Neurobiology y Neurophysiology, 459, Murphy L. y Barthe A. Eds., CRC Press, 1992.
Por tanto, los compuestos que tienen una alta afinidad de unión para estos receptores cannabinoides y que son adecuados para modular estos receptores son útiles para la prevención y/o el tratamiento de los trastornos relacionados con los receptores cannabinoides.
En particular, el receptor CB1 participa en muchos trastornos relacionados con la ingesta de alimentos diferentes tales como la bulimia u obesidad, incluyendo la obesidad asociada a la diabetes tipo II (diabetes no insulinodependiente) y por tanto, pueden usarse compuestos adecuados para regular este receptor para la profilaxis y/o el tratamiento de estos trastornos.
También la dislipidemia, el síndrome metabólico (ambos en sus aspectos dependientes del peso o independientes del peso) y la diabetes tipo II han aumentado en importancia para la sanidad pública a lo largo de las últimas décadas, especialmente para los países desarrollados o en vías de desarrollo, probablemente debido a un aumento marcado demoscópicamente en la proporción de miembros de la población obesos o con sobrepeso o en la edad promedio.
Los compuestos según la fórmula (I), (Ia) o (Ib) (también conocidos como piperidin-1-ilamidas del ácido 5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico como racemato y sus enantiómeros (S) y (R)) se describen junto con formas para su síntesis, sus puntos de fusión y su actividad biológica en las solicitudes WO 2005/077911 A1 (racemato), WO 2007/09686 A2 (enantiómero (S)) y WO 2007/09695 A1 (enantiómero (R)) respectivamente; incluyéndose el contenido de estas publicaciones en la presente por referencia. Estos compuestos demostraron ser compuestos y/o aglutinantes CB1 con actividad antiobesidad y/o compuestos que tienen un efecto reductor en los niveles de triglicéridos en sangre en modelos in vivo. Por tanto, estos compuestos según las fórmulas (I), (Ia) y (Ib) mostraron efectos claros especialmente dando a entender un gran potencial para el tratamiento o la prevención de la obesidad, la dislipidemia, el síndrome metabólico (tanto en sus aspectos dependientes del peso o independientes del peso) y/o la diabetes tipo II.
Por tanto, un objeto de la presente invención es proporcionar composiciones farmacéuticas adecuadas para estos compuestos. Ya que estos compuestos tienen una tendencia a no ser altamente solubles, este aspecto (importante cuando se trata con composiciones farmacéuticas especialmente aquellas adecuadas para permitir la absorción del principio activo a través de una mucosa o de una membrana biológica, especialmente para composiciones farmacéuticas para administración oral) en ciertas circunstancias terapéuticas necesita una mejora.
De acuerdo con lo anterior, sería deseable encontrar una formulación o una ruta para lograr una formulación en la que el principio activo se liberaría en un medio acuoso -simulando aplicación oral- con una velocidad de solución más alta que la que se ve con el principio activo solo. Especialmente, sería deseable tener una alta velocidad de solución en un medio acuoso como ácido clorhídrico 0,1 N -simulando el ácido gástrico- en los primeros 10 a 30 minutos como más del doble de la que se ve en el principio activo a disolverse. Lo más de preferencia son deseables velocidades de solución incluso más altas en los primeros 10 a 30 minutos.
Además sería deseable encontrar una formulación o una ruta para lograr una formulación en la que cuanto más tarde sea la administración oral en un modelo in vivo el principio activo se encontraría en plasma sanguíneo con una concentración mucho más alta (medida como AUC0-t) y/o alcanzando Tmáx mucho más rápida comparada con el principio activo sólo.
Sería incluso más deseable encontrar una formulación o una ruta para lograr una formulación
• en la que el principio activo se liberaría en un medio acioso -simulando aplicación oral- con una velocidad de solución más alta que la que se ve en el principio activo solo
• y en la que cuanto más tarde sea la administración oral en un modelo in vivo el principio activo se encontraría en plasma sanguíneo con una concentración mucho más alta (medida como AUC0-t) y/o alcanzando Tmáx mucho más rápida comparada con el principio activo sólo.
Dicho objeto se consigue proporcionando la composición farmacéutica que comprende una solución sólida y/o dispersión sólida según la invención y opcionalmente ingredientes farmacéuticamente aceptables adicionales.
Por tanto, en otro aspecto relacionado, la invención proporciona además una dispersión sólida y/o solución sólida de uno o más principios activos seleccionados de los compuestos de fórmula (I), (Ia) o (Ib) o mezclas de los mismos.
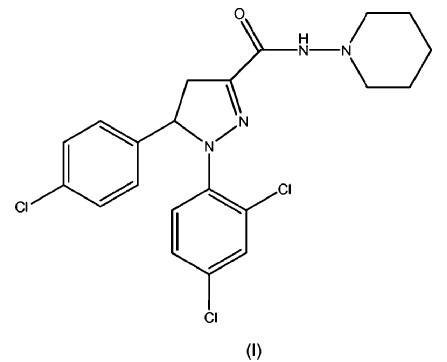
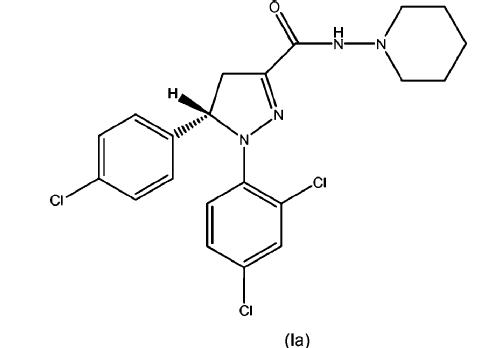
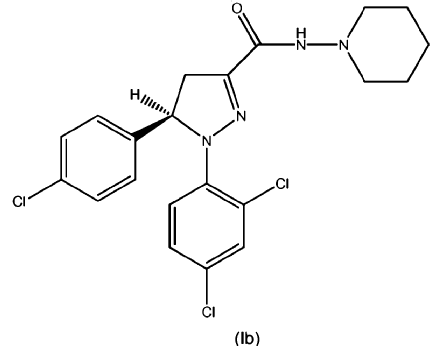
, opcionalmente en forma de uno o más de los polimorfos apropiados, en forma amorfa y/o sales correspondientes y/o solvatos correspondientes de los mismos,
que puede obtenerse mediante un procedimiento en el que
a) el/los principio/s activo/s se mezcla/n con una cantidad al menos equimolar de al menos un vehículo,
b) después o durante la etapa (a) la mezcla se calienta hasta que la mezcla se funda o se ablande y
c) posteriormente la mezcla, de preferencia eutéctica, se enfría por debajo del punto de fusión.
Se ha encontrado que la liberación y la captación del principio activo pueden mejorarse y potenciarse enormemente mediante las composiciones farmacéuticas según la invención. Especialmente, estas composiciones muestran una solución o perfil de solución mejorado, en la mayoría de los casos expresado como una mayor tasa de solución del principio activo (por ejemplo expresada como mg/h). Debido a que lo anterior también está influyendo positivamente la captación del principio activo en el cuerpo, como consecuencia la composición farmacéutica permite usar una dosis eficaz reducida, lo que por tanto claramente también actúa positivamente sobre cualquier efecto secundario indeseado. Por otro lado la composición según la invención mediante su tasa de solución mejorada también da como resultado una mayor proporción del principio activo que cruza la barrera hematoencefálica, creando más rápidamente las concentraciones (en algunos casos) necesarias del principio... [Seguir leyendo]
Reivindicaciones:
1. Una dispersión sólida y/o solución sólida de uno o más de los principios activos seleccionados de compuestos de fórmula (I), (Ia) o (Ib) o mezclas de los mismos
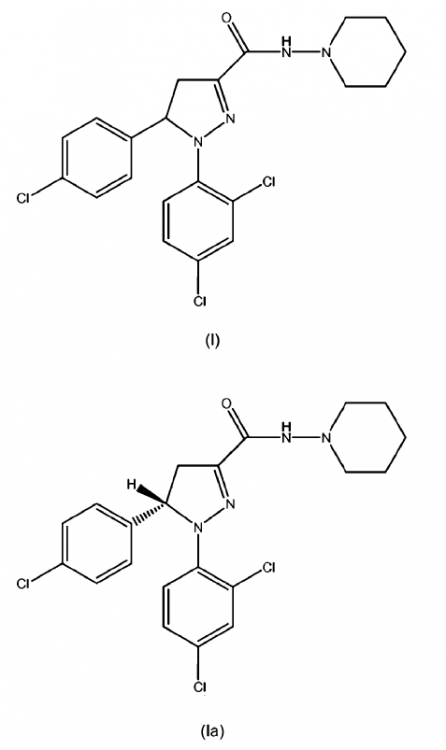
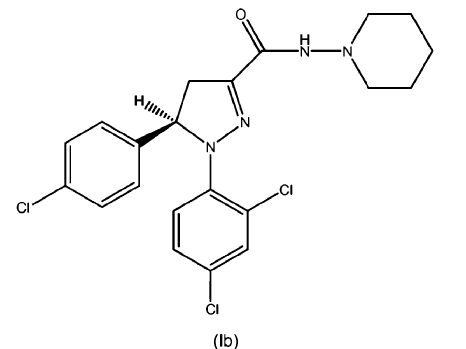
, opcionalmente en forma de uno o más de los polimorfos apropiados, en forma amorfa y/o sales correspondientes y/o solvatos correspondientes de los mismos,
que puede obtenerse mediante un procedimiento caracterizado porque
a) el/los principio/s activo/s se mezcla/n con una cantidad al menos equimolar de al menos un vehículo,
b) después o durante la etapa (a) la mezcla se calienta hasta que la mezcla se funda o se ablande y
c) posteriormente la mezcla se enfría por debajo del punto de fusión.
2. Dispersión sólida y/o solución sólida según la reivindicación 1, caracterizada porque el vehículo es o bien hidrófilo o bien higroscópico y tiene un punto de fusión de entre +40ºC y el punto de fusión del principio activo o mezcla de principios activos +20ºC.
3. Dispersión sólida y/o solución sólida según la reivindicación 1, caracterizada porque el vehículo se selecciona de:
• azúcares, tales como dextrosa, sacarosa, galactosa, sorbitol, maltosa, xilitol, manitol, lactosa;
• ácidos, tales como el ácido cítrico, ácido succínico;
• materiales poliméricos, tales como la povidona (PVP), poli(óxido de etileno), polietilenglicol (PEG), hidroxipropiimetilcelulosa, metilcelulosa, etilcelulosa hidroxietilcelulosa, ciclodextrina, hidroxipropilcelulosa, pectina, galactomanano;
• polímeros insolubles o entéricos, tales como ftalato de hidroxipropiimetilcelulosa, polimetacrilatos (por ejemplo Eudragit L-100, Eudragit S-100, Eudragit RL, Eudragit RS, Eudragit EPO);
• tensioactivos, tales como estearato de polioxietileno, Renex, poloxámero 188, texafor, AIP, ácido desoxicólico, ésteres de ácidos grasos superiores de polioxietileno-sorbitano (por ejemplo Tween, tal como Tween 80), los Span;
• otros, constituidos por: cera de carnauba, pentaeritritol, tetraacetato de pentaeritritilo, urea, uretano, hidroxialquilxantinas;
de preferencia los vehículos se seleccionan de
• EUDRAGIT, MYRJ 52, VITE-TPGS, GELUCIRE 50/13, HPMC-PHTALATE, HPMC, HEC, HPC-SL, PEO y/o POLOXAMER.
4. Dispersión sólida y/o solución sólida según cualquiera de las reivindicaciones 1 a 3, caracterizada porque
• la temperatura de fusión en la etapa (b) está en el intervalo de entre +40 y el punto de fusión del principio activo o mezcla de principios activos +20ºC; y/o
• la etapa de enfriamiento (c) se realiza reduciendo la temperatura en más de 10ºC/s, de preferencia 20ºC/s, hasta temperaturas inferiores a 25ºC, de preferencia inferiores a 0ºC; y/o se realiza poniendo en contacto la masa fundida de la etapa (b) con un entorno que tiene una temperatura de 25ºC o inferior, de preferencia 0ºC o inferior.
5. Dispersión sólida y/o solución sólida según la reivindicación 1, caracterizada porque la razón molecular entre el vehículo y el principio activo es de entre 1:1 y 1:20, de preferencia es de entre 1:1 y 1:10, más de preferencia es de entre 1:2 y 1:5.
6. Composición farmacéutica caracterizada porque comprende la solución sólida y/o dispersión sólida según cualquiera de las reivindicaciones 1 a 5 y opcionalmente ingredientes farmacéuticamente aceptables adicionales.
7. Composición farmacéutica según la reivindicación 6, caracterizada porque
• el principio activo está presente en una cantidad del 10 al 60%, de preferencia del 20 al 40% en peso basado en el peso total de la composición;
y/o
• el principio activo está presente en una cantidad de 1 a 250 mg, de preferencia de 10 a 200 mg, más de preferencia de 15 a 150 mg.
8. Composición farmacéutica que comprende la solución sólida según cualquiera de las reivindicaciones 6 ó 7, caracterizada porque es adecuada para potenciar la absorción del principio activo a través de una mucosa o de una membrana biológica.
9. Composición farmacéutica según la reivindicación 8, caracterizada porque la mucosa se selecciona de la
• mucosa nasal u olfativa,
• mucosa bucal u oral,
• mucosa gástrica,
• mucosa intestinal
• mucosa vaginal, o
• mucosa rectal,
de preferencia se selecciona de
• mucosa gástrica, o
• mucosa intestinal.
10. Composición farmacéutica según cualquiera de las reivindicaciones 6 a 9, caracterizada porque la composición farmacéutica se selecciona de
• una composición farmacéutica para aplicación oral,
• una composición farmacéutica para aplicación nasal,
• una composición farmacéutica para aplicación bucal,
• una composición farmacéutica para aplicación rectal, o
• una composición farmacéutica para aplicación vaginal; o
• una composición farmacéutica para aplicación transdérmica
• una composición farmacéutica para aplicación sistémica;
de preferencia se selecciona de
• una composición farmacéutica para aplicación oral.
11. Composición farmacéutica según cualquiera de las reivindicaciones 6 a 10, caracterizada porque la composición farmacéutica se selecciona de
• un comprimido,
• una cápsula,
• un sobre,
• un polvo,
• un comprimido oblongo,
• un gel,
• una película,
• un microgránulo,
• un gránulo,
• un implante,
• un producto multiparticulado con gránulos comprimidos para dar un comprimido,
• un producto multiparticulado con gránulos rellenados en una cápsula,
• un producto multiparticulado con microgránulos comprimidos para dar un comprimido,
• un producto multiparticulado con microgránulos rellenados en una cápsula, o
• un supositorio,
• una solución/dispersión inyectable
• un sistema transdérmico como un parche;
de preferencia seleccionado de
• un comprimido,
• una cápsula,
• un microgránulo,
• un gránulo,
• un producto multiparticulado con gránulos comprimidos para dar un comprimido,
• un producto multiparticulado con gránulos rellenados en una cápsula,
• un producto multiparticulado con microgránulos comprimidos para dar un comprimido, o
• un producto multiparticulado con microgránulos rellenados en una cápsula.
12. Composición farmacéutica según cualquiera de las reivindicaciones 6 a 11, caracterizada porque
• los ingredientes farmacéuticamente aceptables adicionales están presentes en una cantidad del 5 al 95%, de preferencia del 50 al 90% en peso basado en el peso total de la composición;
y/o
• los ingredientes farmacéuticamente aceptables adicionales están presentes en una cantidad total de 0 a 300 mg, de preferencia de 0 a 250 mg, más de preferencia de 20 a 250 mg.
13. Composición farmacéutica según cualquiera de las reivindicaciones 6 a 12, caracterizada porque el/los ingrediente/s farmacéuticamente aceptables adicionales se selecciona/n de
un diluyente, un aglutinante y/o un lubricante, y/o opcionalmente un fluidificante, un antiadhesivo, un conservante, y/o, opcionalmente, un agente de enmascaramiento del sabor, un agente de coloreado y/o un agente aromatizante y/o un potenciador de la permeación.
14. Composición farmacéutica según cualquiera de las reivindicaciones 6 a 13, caracterizada porque la composición farmacéutica se prepara usando extrusión del fundido en caliente.
15. Una composición farmacéutica caracterizada porque comprende como principio activo al menos uno de:
• piperidin-1-ilamida del ácido (rac)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico;
• piperidin-1-ilamida del ácido (R)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico, o
• piperidin-1-ilamida del ácido (S)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico,
• o mezclas de los mismos;
y opcionalmente ingredientes farmacéuticamente aceptables adicionales
16. Una composición farmacéutica para la administración oral caracterizada porque comprende la solución sólida y/o dispersión sólida según cualquiera de las reivindicaciones 1 a 5 y opcionalmente ingredientes farmacéuticamente aceptables adicionales.
17. Solución sólida y/o dispersión sólida según cualquiera de las reivindicaciones 1 a 5 o una composición farmacéutica según cualquiera de las reivindicaciones 6 a 15 y 16, caracterizada porque el principio activo se selecciona de
a) piperidin-1-ilamida del ácido (rac)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico;
de preferencia en
• forma del polimorfo α;
• forma del polimorfo β;
• forma amorfa;
• forma de un solvato, de preferencia un hidrato, más de preferencia un monohidrato;
• la base libre; o
• una sal con un ácido con un pka ≤ 3,0, especialmente seleccionándose el ácido de ácido 2,5-dihidroxibencenosulfónico, ácido 2-naftalenosulfónico, ácido aspártico, ácido bencenosulfónico, ácido canfor-10-sulfónico, ácido ciclohexilsulfámico, ácido dodecilsulfúrico, ácido etano-1,2-disulfónico, ácido etanosulfónico, ácido fumárico, ácido glutámico, ácido bromhídrico, ácido clorhídrico, ácido metanosulfónico, ácido naftaleno-1,5-disulfónico, ácido nítrico, ácido fosfórico, ácido p-toluenosulfónico, ácido sulfúrico y/o ácido tiociánico; siendo la sal más de preferencia un clorhidrato;
b) piperidin-1-ilamida del ácido (R)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico, de preferencia
de preferencia en
• forma del polimorfo α;
• forma del polimorfo γ;
• forma amorfa;
• forma de un solvato, de preferencia un hidrato;
• la base libre; o
• una sal con un ácido con un pka ≤ 3,0, especialmente seleccionándose el ácido de ácido 2,5-dihidroxibencenosulfónico, ácido 2-naftalenosulfónico, ácido aspártico, ácido bencenosulfónico, ácido canfor-10-sulfónico, ácido ciclohexilsulfámico, ácido dodecilsulfúrico, ácido etano-1,2-disulfónico, ácido etanosulfónico, ácido fumárico, ácido glutámico, ácido bromhídrico, ácido clorhídrico, ácido metanosulfónico, ácido naftaleno-1,5-disulfónico, ácido nítrico, ácido fosfórico, ácido p-toluenosulfónico, ácido sulfúrico y/o ácido tiociánico; siendo la sal más de preferencia un clorhidrato;
c) piperidin-1-ilamida del ácido (S)-5-(4-cloro-fenil)-1-(2,4-dicloro-fenil)-4,5-dihidro-1H-pirazol-3-carboxílico,
de preferencia en
• forma de un polimorfo;
• forma amorfa;
• forma de un solvato, de preferencia un hidrato;
• la base libre; o
• una sal con un ácido con un pka ≤ 3,0, especialmente seleccionándose el ácido de ácido 2,5-dihidroxibencenosulfónico, ácido 2-naftalenosulfónico, ácido aspártico, ácido bencenosulfónico, ácido canfor-10-sulfónico, ácido ciclohexilsulfámico, ácido dodecilsulfúrico, ácido etano-1,2-disulfónico, ácido etanosulfónico, ácido fumárico, ácido glutámico, ácido bromhídrico, ácido clorhídrico, ácido metanosulfónico, ácido naftaleno-1,5-disulfónico, ácido nítrico, ácido fosfórico, ácido p-toluenosulfónico, ácido sulfúrico y/o ácido tiociánico; siendo la sal más de preferencia un clorhidrato;
o
d) mezclas no racémicas de (b) y (c).
Patentes similares o relacionadas:
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Derivados de pirazol como inhibidores de la calicreína plasmática, del 13 de Mayo de 2020, de Kalvista Pharmaceuticals Limited: Un compuesto seleccionado del grupo que consiste de: **(Ver fórmula)** y sales y solvatos farmacéuticamente aceptables de los mismos.
Compuestos con actividad antitumoral, del 8 de Abril de 2020, de AB SCIENCE: Un compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde: R1 es un grupo alquilo; R4 es un grupo alcoxi […]
Pirazoles, del 18 de Marzo de 2020, de Janssen Pharmaceuticals, Inc: compuesto de Fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable, solvato, polimorfo o N-óxido del mismo; en donde: n es 1 o […]
Dihidropirazoles, composiciones farmacéuticas de los mismos y su uso para el tratamiento de trastornos de fertilidad, del 11 de Marzo de 2020, de MERCK PATENT GMBH: Compuesto de formula (I-B) **(Ver fórmula)** en la que R1 indica Hal, A, CN, -E-fenilo o Het3; R2 indica Hal, A, OA, NH2, CN, SA, SO2A, SO2NH2, O-fenilo […]
Derivados de 2-(1-heteroarilpiperazin-4-il)metil-1,4-benzodioxano como antagonistas de alfa2C, del 11 de Marzo de 2020, de ORION CORPORATION: Un compuesto de fórmula I, **(Ver fórmula)** en la que A es un anillo heterocíclico insaturado de cinco miembros que contiene 1, 2 o 3 heteroátomos […]
Halogenopirazoles como inhibidores de la trombina, del 26 de Febrero de 2020, de Verseon Corporation: Un compuesto para su uso en el tratamiento de una enfermedad o trastorno en un sujeto, teniendo el compuesto la Fórmula (IIa): **(Ver fórmula)** o una sal, éster, […]
Compuestos de 3-aminocicloalquilo como inhibidores de ROR-gamma-T y sus usos, del 17 de Febrero de 2020, de MERCK SHARP & DOHME CORP: Un compuesto según la fórmula I **Fórmula** o una de sus sales o solvatos farmacéuticamente aceptables, donde: a es una ausencia de enlace […]