FORMAS CRISTALINAS DE COMPUESTOS MACROLIDOS DOTADOS DE UNA ACTIVIDAD ANTIINFLAMATORIA.
La forma cristalina I de un compuesto de fórmula
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/006541.
Solicitante: ZAMBON S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIA LILLO DEL DUCA, 10,20091 BRESSO MI.
Inventor/es: COTARCA, LIVIUS, MICHIELETTO, IVAN, MORAZZONI, GABRIELE, BRAGA,DARIO, MARAGNI,PAOLO, BRESCELLO,ROBERTO, DI MARIA,ALESSANDRO, MASSACCESI,FRANCO, MELOTTO,ELISA.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07H17/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Clasificación PCT:
- A61K31/7048 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el oxígeno como heteroatomo de un ciclo, p. ej. Leucoglucosano, hesperidina, eritromicina, nistatina.
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- C07H17/08 C07H 17/00 […] › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Fragmento de la descripción:
Formas cristalinas de compuestos macrólidos dotados de una actividad antiinflamatoria.
La presente invención se refiere a compuestos macrólidos dotados de una actividad antiinflamatoria y más particularmente se refiere a nuevas formas estables cristalinas de un derivado de macrólido con actividad antiinflamatoria, procedimientos para la preparación de tales formas, composiciones farmacéuticas que los contienen como ingrediente activo y el uso de dichas formas cristalinas para el tratamiento de enfermedades inflamatorias.
Se sabe que muchos antibióticos en particular la clase de macrólidos basados en eritromicina que tienen 14 átomos en el anillo, tienen propiedades antiinflamatorias además de su actividad antibacteriana [Clin. Immunolher, (1996), 6, 454 - 464].
La eritromicina es un macrólido natural (The Merck Index, XIII Edición Nº. 3714, p. 654) que se ha usado ampliamente en el tratamiento de infecciones provocadas por bacterias Gram positivas, numerosas bacterias Gram negativas y micoplasmas.
Recientemente el interés de la comunidad científica ha girado hacia las propiedades antiinflamatorias e inmunomoduladoras de la eritromicina y derivados de la misma [Journal of Antimicrobial Chemotherapy, (1998), 41, Suppl. B, 37 - 46].
Esta actividad está bien documentada en estudios clínicos y en experimentos in vivo e in vitro.
Sin embargo, el hecho que los compuestos macrólidos convencionales tengan una fuerte actividad antibacteriana no permite se amplio uso en el tratamiento crónico en procesos inflamatorios no provocados por microorganismos patógenos, ya que esto podría dar lugar al rápido desarrollo de cepas resistentes.
El problema técnico anterior se resolvió exitosamente en la solicitud de patente internacional WO 2004/013153 (WO'153) en nombre del mismo solicitante, en la que se describen los derivados de macrólidos dotados de actividad antiinflamatoria y sin actividad antibiótica.
En particular, el compuesto (9S)-3-descladinosil-3'-desmetil-3'-acetil-9-deoxo-9-dehidro-eritromicina A (de aquí en adelante Compuesto) de fórmula
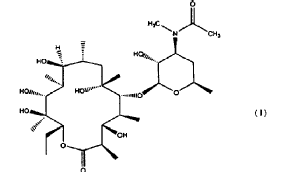
se obtiene en una forma amorfa sólida.
La capacidad de una sustancia de cristalizar con más de una estructura cristalina se conoce como polimorfismo y una forma cristalina particular se llama polimorfo.
El documento WO '153 no describe ni sugiere la posible existencia de formas polimorfas cristalinas del Compuesto.
Se sabe en la técnica que diferentes formas sólidas del mismo compuesto activo pueden mostrar distintas propiedades físicas tales como solubilidad, velocidad de disolución, y/o estabilidad de la vida útil, que puede conducir a diferencias en eficacia.
Además, las distintas propiedades físicas de las formas sólidas con respecto al estado cristalino o amorfo, puede influenciar notablemente la capacidad de fabricación química y farmacéutica de un compuesto, particularmente, cuando se prepara o se usa a escala industrial.
Por ejemplo, es importante ser capaz de proporcionar sustancias fármacos en una forma que se tan pura como sea posible.
Típicamente, las sustancias amorfas son más difíciles para manejar y formular que las formas cristalinas y a menudo con problemas de estabilidad e impureza.
Por lo tanto es deseable por los expertos en la técnica obtener el Compuesto sustancialmente en una forma estable cristalina, que se puede aislar fácilmente y hacerlo particularmente adecuado para uso como medicamento.
El documento WO'153 proporciona un procedimiento eficaz para producir el Compuesto en una forma amorfa partiendo de eritromicina.
Ahora se ha encontrado que mediante el uso de condiciones de reacción y disolventes adecuados, el Compuesto se puede aislar a partir de la mezcla de reacción en formas sólidas cristalinas estables, con buenos rendimientos y pureza.
La cristalinidad de las formas polimórficas se confirmó mediante la medición de difracción de rayos X de una muestra en polvo.
Por lo tanto, es un objeto de la presente invención una forma estable cristalina del Compuesto, que se denomina en el presente documento como Forma I cristalina.
La Forma I cristalina puede proporcionar un patrón de difracción de rayos X en polvo sustancialmente de acuerdo con lo mostrado en la Fig. 1.
Los valores de ángulo 2? de los máximos de difracción así como su intensidad relativa correspondiente se reseñan en la siguiente Tabla 1:
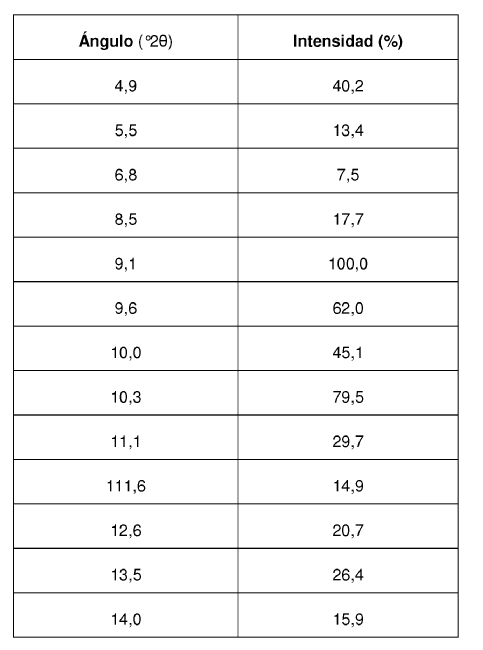
TABLA 1 (continuación)
La Forma I cristalina del Compuesto se caracteriza por proporcionar un patrón de difracción de rayos X que comprende valores de ángulo 2? y aproximadamente 4,9; aproximadamente 8,5; aproximadamente 9,1; aproximadamente 9,6; aproximadamente 10,3; aproximadamente 11,1; aproximadamente 14,5; aproximadamente 17,0; aproximadamente 18,2; aproximadamente 19,3. La forma cristalina I además se caracteriza por proporcionar una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo de 163 - 174ºC (comienzo: 168,2ºC; máximo: 174,8ºC).
Preferiblemente, la Forma I cristalina proporciona una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 163 - 168ºC.
La Forma I cristalina cumple más adecuadamente los requerimientos de procesamiento y estabilidad mencionados anteriormente que la forma amorfa obtenida en el documento WO '153.
Ahora sorprendentemente se ha encontrado que el Compuesto se puede obtener en una forma cristalina más estable.
Por lo tanto, es además un objeto de la presente invención una forma estable cristalina del Compuesto, que se denomina en el presente documento como Forma II cristalina.
La Forma II cristalina puede proporcionar un patrón de difracción de rayos X en polvo sustancialmente de acuerdo con la mostrada en la Fig. 2.
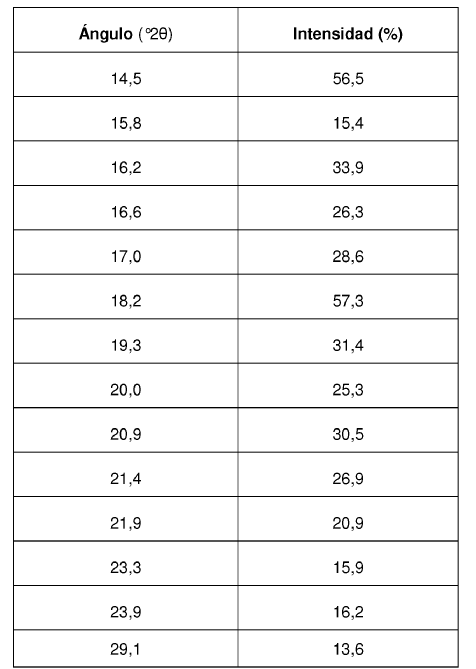
Los valores de ángulo 2? de los máximos de difracción así como su intensidad relativa correspondiente se reseñan en la siguiente Tabla 2:
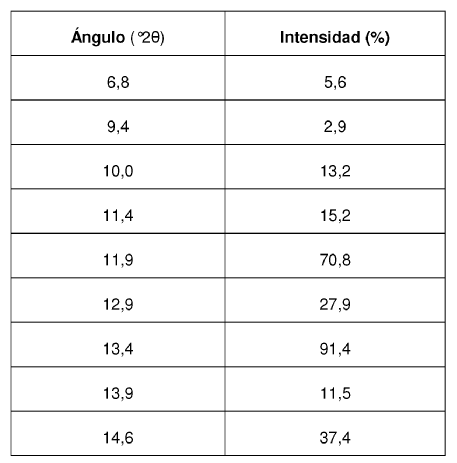
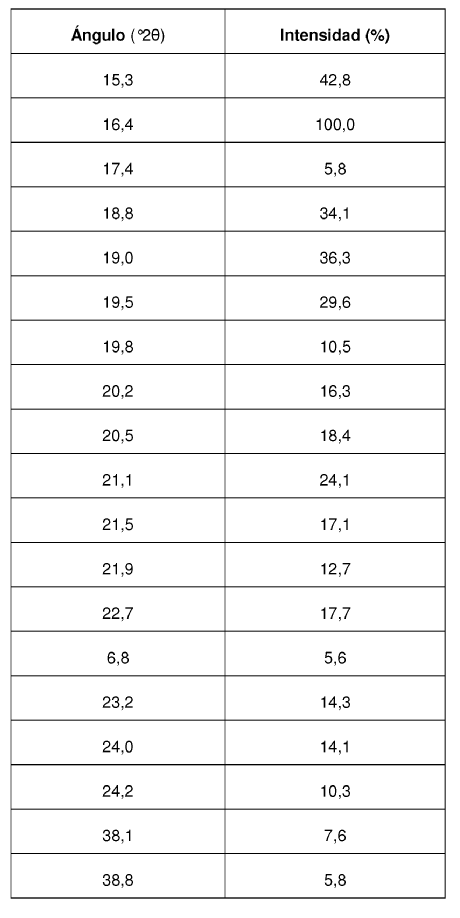
La Forma II cristalina del Compuesto se caracteriza por proporcionar un patrón de difracción de rayos X que comprende valores de ángulo 2? de aproximadamente 11,9; aproximadamente 13,4; aproximadamente 13,9; aproximadamente 14,6; aproximadamente 15,3; aproximadamente 16,4; aproximadamente 17,4; aproximadamente 18,8; aproximadamente 19,0; aproximadamente 19,5; aproximadamente 21,1; aproximadamente 22,7.
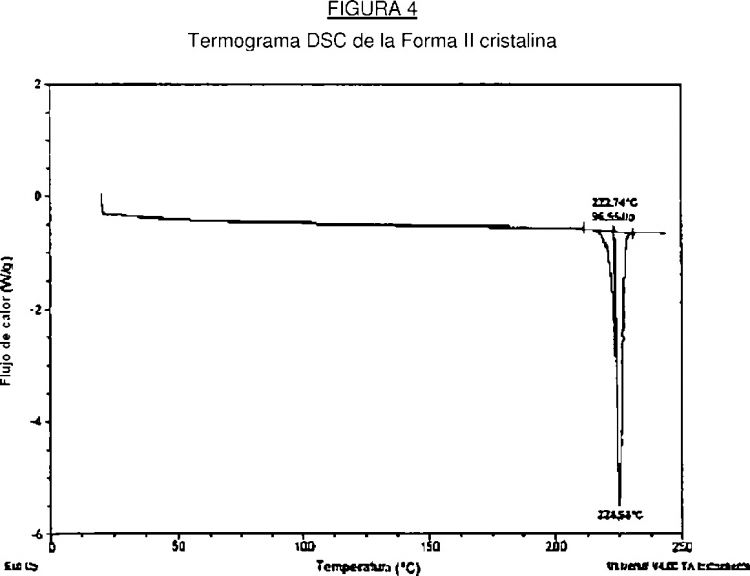
La Forma II además se caracteriza por proporcionar curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 218 - 226ºC (comienzo: 222,7ºC; máximo: 225,0ºC).
Preferiblemente, la Forma II cristalina proporciona una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 218 - 223ºC.
La Forma II cristalina se caracteriza por la baja actividad termodinámica, mostrando de este modo propiedades ventajosas tales como ser termodinámicamente más estable que la Forma I cristalina, especialmente en fluidos biológicos.
La Forma II cristalina se aísla a partir de la mezcla de reacción mediante procedimientos aplicables a escala industrial, con buenos rendimientos y pureza y, como resultado de su estabilidad termodinámica, es particularmente adecuados para uso como medicamento.
De acuerdo con la invención se proporciona además un procedimiento para la preparación de la Forma I cristalina mediante el aislamiento del producto de acuerdo con un procedimiento de precipitación por antidisolvente.
En...
Reivindicaciones:
1. La forma cristalina I de un compuesto de fórmula
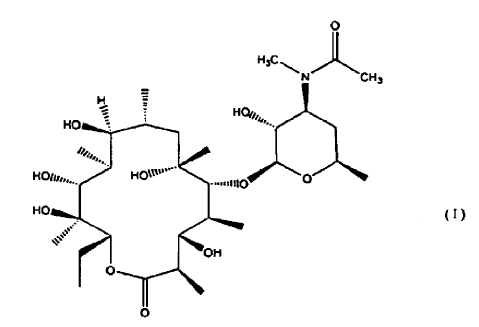
caracterizada por un patrón de difracción de rayos X en polvo que comprende valores de ángulo 2? de aproximadamente 4,9; aproximadamente 8,5; aproximadamente 9,1; aproximadamente 9,6; aproximadamente 10,3; aproximadamente 11,1; aproximadamente 14,5; aproximadamente 17,0; aproximadamente 18,2; aproximadamente 19,3.
2. Una forma cristalina de acuerdo con la reivindicación 1 que proporciona un Patrón de difracción de rayos X sustancialmente de acuerdo con el mostrado en la Fig. 1.
3. A forma cristalina de acuerdo con una de las reivindicaciones precedentes caracterizada por una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 163 - 174ºC.
4. Una forma cristalina de acuerdo con la reivindicación 3 caracterizada por una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 163 - 168ºC.
5. La forma cristalina II del compuesto de fórmula I caracterizada por un patrón de difracción de rayos X en polvo que comprende valores de ángulo 2? of aproximadamente 11.9; aproximadamente 13,4; aproximadamente 13,9; aproximadamente 14,6; aproximadamente 15,3; aproximadamente 16,4; aproximadamente 17,4; aproximadamente 18,8; aproximadamente 19,0; aproximadamente 19,5; aproximadamente 21,1; aproximadamente 22.7.
6. Una forma cristalina de acuerdo con la reivindicación 5 que proporciona un Patrón de difracción de rayos X en polvo sustancialmente de acuerdo con el mostrado en la Fig. 2.
7. Una forma cristalina de acuerdo con las reivindicaciones 5 ó 6 caracterizada por una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 218 - 226ºC.
8. Una forma cristalina de acuerdo con la reivindicación 7 caracterizada por una curva de calorimetría de barrido diferencial que tiene un comienzo de fusión que está comprendido en el intervalo 218 - 223ºC.
9. Un procedimiento para la preparación de la forma cristalina I de acuerdo con las reivindicaciones 1 - 4, que comprende añadir metil-terc-butil éter a una solución del compuesto de fórmula I en acetato de etilo, enfriar la mezcla de reacción obtenida, filtrar y secar el producto cristalizado.
10. Un procedimiento para la preparación de Forma II cristalina, de acuerdo con las reivindicaciones 5 - 8, que comprende la conversión de la forma cristalina I de acuerdo con las reivindicaciones 1 - 4, a la forma cristalina II mediante el calentamiento de una suspensión acuosa de dicha forma cristalina l.
11. Un procedimiento de acuerdo con la reivindicación 10 en el que la suspensión se calienta hasta una temperatura comprendida entre 30 y 35ºC.
12. Un procedimiento para la preparación de Forma II cristalina, de acuerdo con las reivindicaciones 5 - 8, que comprende la cristalización del compuesto de fórmula I en metil etil cetona.
13. Un procedimiento de acuerdo con la reivindicación 12 que comprende además la siembra de la solución con la Forma II cristalina.
14. La Forma I cristalina, de acuerdo con las reivindicaciones 1 - 4, para uso como un medicamento.
15. La Forma II cristalina, de acuerdo con las reivindicaciones 5 - 8, para uso como un medicamento.
16. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de la Forma I cristalina, de acuerdo con las reivindicaciones 1 - 4, como ingrediente activo en mezcla con un vehículo farmacéuticamente aceptable.
17. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de la Forma II cristalina, de cuerdo con las reivindicaciones 5 - 8, como ingrediente activo en mezcla con un vehículo farmacéuticamente aceptable.
18. Una composición farmacéutica de acuerdo con las reivindicaciones 16 ó 17 útil en el tratamiento de enfermedades inflamatorias.
19. Una composición farmacéutica de acuerdo con la reivindicación 18 útil en el tratamiento de enfermedades respiratorias.
20. Una composición farmacéutica acuerdo con la reivindicación 18 útil en el tratamiento de enfermedades gastrointestinales.
Patentes similares o relacionadas:
Polimorfos de 20,23-piperidinil-5-O-micaminosiltilonolida, del 20 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una forma cristalina de 20,23-dipiperidinil-5-O-micaminosil-tilonolida que tiene al menos una de las siguientes características: un espectro FT-Raman que comprende […]
Derivados de azitromicina con propiedades de potenciación de la barrera epitelial, del 13 de Mayo de 2020, de EpiEndo Pharmaceuticals ehf: Un compuesto de acuerdo con la fórmula (I) **(Ver fórmula)** En donde R1 es OH; R2 es de acuerdo con la fórmula (III) **(Ver […]
Derivados de avermectina B1 que tienen un sustituyente alcoximetilo en la posición 4'''' o 4'', del 17 de Febrero de 2020, de Boehringer Ingelheim Animal Health USA Inc: Compuesto de fórmula**Fórmula** en la que n es 0 o 1; A-B es -CH=CH; R1 es sec-butilo o isopropilo; R2 es CH2CH3, p-ClC6H4, CH2(CH2)2N3 […]
Levoisovalerilespiramicina III y preparaciones, métodos de preparación y utilizaciones de la misma, del 1 de Enero de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto cristalino de levoisovalerilespiramicina III, en el que, la fórmula estructural química de la levoisovalerilespiramicina III se representa como la fórmula […]
 Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Forma cristalina de levoisovalerilespiramicina II y preparaciones, procedimientos de preparación y utilizaciones de la misma, del 7 de Agosto de 2019, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto de levoisovalerilespiramicina II, en el que, la fórmula estructural química de la levoisovalerilespiramicina II se representa como la fórmula (II), en condiciones […]
Derivados de la anfotericina B con índice terapéutico mejorado, del 20 de Septiembre de 2018, de The Board of Trustees of the University of Illionis: Un compuesto, o una sal farmacéuticamente aceptable del mismo, el compuesto que se selecciona de**Fórmula**
Procedimientos para tratar enfermedades gastrointestinales, del 11 de Abril de 2018, de Cempra Pharmaceuticals, Inc: Una cantidad terapéuticamente efectiva de un compuesto de fórmula **Fórmula** o una sal farmacéuticamente aceptable del mismo, donde: R10 es hidrógeno […]