FORMA CRISTALINA MEJORADA DEL COMPUESTO A-348441.
Hemihidrato de ácido (3ß,5ß,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17ß-hidroxi-3-oxo-17α
-prop-1-inilestra-4,9-dien-11ßl]fenil)(metil)amino]etoxi)cholan-24-oico en una forma cristalina, que está caracterizado por una patrón de difracción de rayos X que tiene picos principales en 2θ = 6,58 ± 0,2, 8,54 ± 0,2, 12,28 ± 0,2 y 19,68 ± 0
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/006811.
Solicitante: KARO BIO AB.
Nacionalidad solicitante: Suecia.
Dirección: NOVUM 141 57 HUDDINGE SUECIA.
Inventor/es: LEANNA, MARVIN ROBERT, CINK,Russell,Drew, ZOU,Daozhong, TOMA,Pascal,H, LONG,Michelle,Andrée.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Julio de 2006.
Clasificación PCT:
- A61K31/575 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › sustituidos en posición 17 beta por una cadena de al menos tres átomos de carbono, p. ej. colano, colestano, ergosterol, sitosterol.
- A61P3/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la hiperglucemia, p.ej. antidiabéticos.
- C07J41/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen uno o más átomos de nitrógeno que no pertenecen a un heterociclo.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2356255_T3.pdf





Fragmento de la descripción:
La presente invención se refiere a un material cristalino mejorado y a su uso en el tratamiento de afecciones asociadas con un exceso de respuesta hepática a glucocorticoides.
El documento WO 2004/000869 se refiere a compuestos novedosos que son antagonistas selectivos de los receptores de glucocorticoides en el hígado. El Ejemplo 1 describe la síntesis de ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-5 hidroxi-3-oxo-17α-prop-1-inilestra-4,9-dien-11β-l] fenil}(metil)amino]etoxi} cholan-24-oico (denominado en ese ejemplo ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[11β,17α,)-17-hidroxi-3-oxo-17-prop-1-inilestra-4,9-dien-11-il]fenil}(metil) amino]etoxi}cholan-24-oico). Este compuesto se denomina, en adelante en la presente memoria, Compuesto I, y tiene la fórmula:
**(Ver fórmula)**
10
15
Desafortunadamente, la síntesis del Compuesto I es bastante difícil. El procedimiento del Ejemplo 1J del documento WO 2004/000869 lleva a un material amorfo, mientras que el procedimiento del Ejemplo 1S lleva a una forma cristalina que es higroscópica y no muy estable. 20
Se ha encontrado ahora que el Compuesto I puede ser sintetizado en la forma de un hemihidrato que tiene una forma cristalina novedosa, que tiene propiedades particulares mejoradas en comparación con el mismo compuesto en otras formas.
Consiguientemente, la presente invención proporciona el hemihidrato de ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-hidroxi-3-oxo-17α-prop-1-inilestra-4,9-dien-11β-l] fenil}(metil)amino]etoxi} cholan-24-oico (Compuesto I) en una 25 forma cristalina que está caracterizada por un patrón de difracción de rayos X que tiene picos principales en 2θ = 6,58 ± 0,2, 8,54 ± 0,2, 12,28 ± 0,2 y 19,68 ± 0,2. Otros picos significativos, pero menos prominentes, pueden encontrarse en 10,34 ± 0,2, 15,10 ± 0,2 y 15,46 ± 0,2. Un patrón de difracción de rayos X completo típico se muestra en la Figura 1. La Tabla 1 proporciona aquellos picos que tienen una intensidad mayor del 20%.
Tabla 1 30
2-Theta
I%
3,92
40,6
5,06
25,1
6,20
24,1
6,58
77,0
8,54
100,0
10,34
58,0
11,84
38,2
12,28
93,8
13,40
35,4
13,86
25,8
15,10
52,4
15,46
67,1
15,92
38,5
16,76
46,0
18,69
25,8
19,68
76,7
20,16
21,2
22,32
42,4
23,34
21,1
24,04
24,2
25,02
21,4
Una manera adicional de caracterización del material cristalino novedoso de la invención es mediante sus termogramas de calorimetría diferencial de barrido (Differential Scanning Calorimetry, DSC). Típicamente, el material tiene un termograma DSC que exhibe dos endotermas, una con un máximo en 71 ± 6ºC (y una aparición extrapolada de 51 ± 6ºC) y una más pronunciada con un máximo en 204 ± 6ºC (y una aparición extrapolada de 195 ± 6ºC). Dos curvas DSC típicas se muestran en las Figuras 2 y 3. 5
Naturalmente, los detalles exactos de cualquier patrón XRD o DSC dependerán de un número de factores, por ejemplo, el instrumento usado y el grado de pureza del material.
El material cristalino novedoso de la invención se denominará como Forma 1, a lo largo de la presente especificación.
Preferentemente, la Forma 1 es proporcionada, según la invención, a un nivel de pureza en el que al menos el 90%, especialmente al menos el 95%, más preferentemente, sustancialmente la totalidad, del Compuesto I presente es de la 10 Forma 1.
El propio Compuesto I puede ser sintetizado tal como se describe en el Ejemplo 1 del documento WO 2004/000869 o mediante los procedimientos descritos más adelante, en la presente memoria. El Compuesto I resultante, que tiene una estructura física diferente de la Forma 1, puede ser convertido, a continuación, a la Forma 1 mediante un procedimiento que comprende disolver el Compuesto I (no en la Forma 1) en un solvente adecuado, por ejemplo, nitrometano. 15 Consiguientemente, la presente invención proporciona también un procedimiento para la preparación de la Forma 1 del Compuesto I, que comprende disolver el Compuesto I en un solvente que comprende nitrometano, evaporar el solvente y recoger los cristales resultantes de la Forma 1. Se obtienen rendimientos óptimos cuando el nitrometano es evaporado lentamente. Una vez obtenidos los cristales de la Forma 1, puede obtenerse una cantidad adicional de la Forma 1 preparando una solución del Compuesto I en un solvente adecuado, sembrando la solución resultante con cristales de la 20 Forma 1, y, a continuación, añadiendo un solvente adicional para efectuar una recristalización, con las condiciones adecuadas para obtener la Forma 1 tras la siembra. Los solventes adecuados en este contexto incluyen solventes polares, por ejemplo, alcoholes tales como metanol, etanol o isopropanol, o sus mezclas, por ejemplo, mezclas de metanol/etanol, y cetonas, por ejemplo, acetona, a partir de los cuales la Forma 1 puede ser recristalizada mediante la adición de agua. 25
En contraste con la Forma 1, otra forma cristalina, denominada Forma 2, y que es el anhidrato preparado en el Ejemplo 1S del documento WO 2004/000869, tiene picos principales de difracción de rayos X en 2θ = 12,00 ± 0,2, 13,60 ± 0,2 y 15,34 ± 0,2, con picos adicionales significativos, pero de intensidad menor, en 6,28 ± 0,2, 12,60 ± 0,2, 14,90 ± 0,2, 16,08 ± 0,2 y 17,72 ± 0,2. Un patrón de difracción de rayos X completo típico de la Forma 2 se muestra en la Figura 3.
La Tabla 2 expone los picos que tienen una intensidad superior al 20%. 30
Tabla 2
2-Theta
I%
6,28
61,2
8,34
25,0
10,12
22,4
11,22
26,0
12,00
100,0
12,60
68,0
13,60
91,4
14,90
86,0
15,34
99,5
16,08
62,1
16,72
30,1
17,20
45,5
17,72
54,7
18,92
46,1
20,86
45,4
22,10
33,0
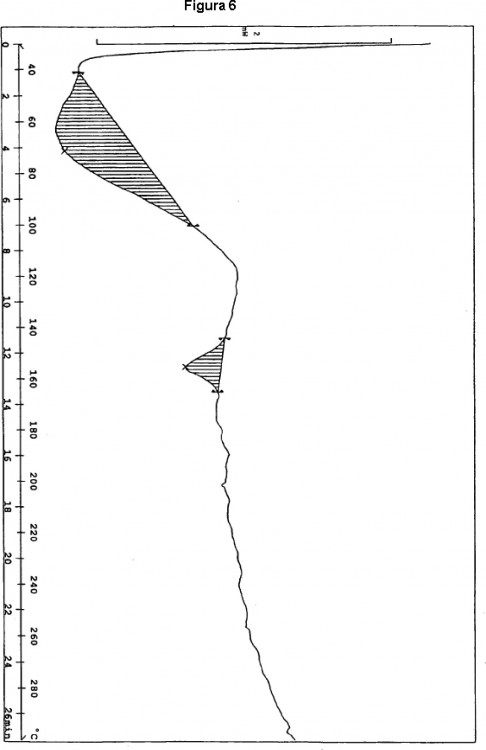
Típicamente, la Forma 2 tiene un termograma DSC que exhibe una única exoterma con un máximo en 166 ± 6ºC (y una aparición extrapolada de 157 ± 6ºC). Una curva DSC típica de la Forma 2 se muestra en la Figura 5. El compuesto I amorfo tiene un termograma DSC que exhibe una única exoterma con un máximo en 157 ± 6ºC (y una aparición 35 extrapolada de 149 ± 6ºC). Una curva DSC típica del Compuesto I amorfo se muestra en la Figura 6.
Se ha encontrado que la Forma 1 tiene un número de propiedades ventajosas; en particular, tiene un punto de fusión relativamente alto y baja solubilidad, evitando, de esta manera, una precipitación no deseada en formulaciones en solución. De manera importante, tiene una estabilidad mejorada y una hidroscopicidad inferior en comparación con la forma cristalina conocida del Ejemplo 1S del documento WO 2004/00869 y en comparación también con la forma 40
amorfa.
La invención proporciona además una composición farmacéutica que comprende la Forma 1 junto con un portador farmacéuticamente aceptable. Por ejemplo, la composición farmacéutica puede ser formulada para, y ser administrada a, seres humanos o a otros... [Seguir leyendo]
Reivindicaciones:
1. Hemihidrato de ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-hidroxi-3-oxo-17α-prop-1-inilestra-4,9-dien-11β-l]fenil)(metil)amino]etoxi)cholan-24-oico en una forma cristalina, que está caracterizado por una patrón de difracción de rayos X que tiene picos principales en 2θ = 6,58 ± 0,2, 8,54 ± 0,2, 12,28 ± 0,2 y 19,68 ± 0,2.
2. Material cristalino según la reivindicación 1, caracterizado por un patrón de difracción de rayos X que tiene picos 5 significantes en 10,34 ± 0,2 y 15,10 ± 0,2 y 15,46 ± 0,2.
3. Material cristalino según la reivindicación 2, caracterizado por un patrón de difracción de rayos X que contiene picos principales sustancialmente como los que se indican a continuación:
2-Theta
I%
3,92
40,6
5,06
25,1
6,20
24,1
6,58
77,0
8,54
100,0
10,34
58,0
11,84
38,2
12,28
93,8
13,40
35,4
13,86
25,8
15,10
52,4
15,46
67,1
15,92
38,5
16,76
46,0
18,64
25,8
19,68
76,7
20,16
21,2
22,32
42,4
23,34
21,1
24,04
24,2
25,02
21,4
4. Material cristalino según una cualquiera de las reivindicaciones 1 a 3, que tiene una curva de calorimetría diferencial 10 de barrido que exhibe dos endotermas, una con un máximo en 71 ± 6ºC y una con un máximo en 209 ± 6ºC.
5. Material cristalino según una cualquiera de las reivindicaciones 1 a 4, que tiene un nivel de pureza en el que al menos el 90%, especialmente al menos el 95%, más preferentemente, sustancialmente todo el ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-hidroxi-3-oxo-17α-prop-1-inilestra-4,9-dien-11β-l]fenil}(metil)amino]etoxi}cholan-24-oico presente, está en la forma cristalina requerida. 15
6. Procedimiento para la preparación de un material cristalino según una cualquiera de las reivindicaciones 1 a 5, que comprende disolver ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-hidroxi-3-oxo-17a-prop-1-inilestra-4,9-dien-11β-l]fenil}(metil)amino]etoxi}cholan-24-oico en un solvente que comprende nitrometano, evaporar el solvente y recoger los cristales resultantes.
7. Procedimiento para la preparación de un material cristalino según una cualquiera de las reivindicaciones 1 a 5, que 20 comprende preparar una solución de ácido (3β,5β,7α,12α)-7,12-dihidroxi-3-{2-[{4-[17β-hidroxi-3-oxo-17α-prop-1-inilestra-4,9-dien-11β-il]fenil}(metil)
amino]etoxi}cholan-24-oico en un solvente adecuado, sembrar la solución resultante con un material cristalino según una cualquiera de las reivindicaciones 1 a 4, y, a continuación, añadir agua para efectuar una recristalización, siendo las condiciones las adecuadas para obtener el material cristalino requerido tras la siembra. 25
8. Procedimiento según la reivindicación 7, en el que el solvente es un alcohol o una cetona o una mezcla de uno o más alcoholes y/o cetonas.
9. Composición farmacéutica que comprende un material cristalino según una cualquiera de las reivindicaciones 1 a 5, junto con un portador farmacéuticamente aceptable.
10. Material cristalino según una cualquiera de las reivindicaciones 1 a 5 o una composición según la reivindicación 9, 30 para su uso en un procedimiento de terapia.
11. Material cristalino o composición según la reivindicación 10, para su uso en el tratamiento de diabetes,
hiperglicemia, hiperinsulinemia, eliminación inadecuada de glucosa, obesidad, Síndrome X, hiperlipidemia, hipertensión diabética o niveles hepáticos elevados de glucocorticoides.
12. Material cristalino o composición según la reivindicación 11, para su uso en el tratamiento de diabetes, obesidad o Síndrome X.
13. Uso de un material cristalino según una cualquiera de las reivindicaciones 1 a 5 o una composición según la 5 reivindicación 9, en la fabricación de un medicamento para tratar una afección asociada con un exceso de respuesta hepática a glucocorticoides en un mamífero.
14. Uso según la reivindicación 13, en el que la afección es diabetes, hiperglicemia, hiperinsulinemia, eliminación inadecuada de glucosa, obesidad, Síndrome X, hiperlipidemia, hipertensión diabética o niveles hepáticos elevados de glucocorticoides. 10
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
 Hidrolizado de caseína para uso en el tratamiento de enfermedades inflamatorias, del 29 de Julio de 2020, de MJN U.S. Holdings, LLC: Una composición nutricional, que comprende un lípido o una fase grasa, una fuente de proteína y un hidrolizado de caseína para uso en el tratamiento […]
Hidrolizado de caseína para uso en el tratamiento de enfermedades inflamatorias, del 29 de Julio de 2020, de MJN U.S. Holdings, LLC: Una composición nutricional, que comprende un lípido o una fase grasa, una fuente de proteína y un hidrolizado de caseína para uso en el tratamiento […]
Forma cristalina anhidra de (1S)-1,5-anhidro-1-[3-[[5-(4-fluorofenil)-2-tienil]metil]-4-metilfenil]-D-glucitol, del 22 de Julio de 2020, de JANSSEN PHARMACEUTICA NV: Un proceso para la preparación de una forma cristalina anhidra de (1S)-1,5-anhidro-1-[3-[[5-(4-fluorofenil)-2- tienil]metil]-4-metilfenil]-D-glucitol que comprende […]
Péptidos marinos y nucleótidos de pescado, composiciones y sus usos para reducir la glucosa en sangre, del 22 de Julio de 2020, de FIRMENICH SA: Una combinación de un péptido marino y un nucleótido de pescado para su uso en el tratamiento de una afección seleccionada del grupo que consiste en prediabetes y diabetes, […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
MicroARN que modulan el efecto de la señalización de glucocorticoides, del 15 de Julio de 2020, de DEUTSCHES KREBSFORSCHUNGSZENTRUM STIFTUNG DES OFFENTLICHEN RECHTS: Un inhibidor de un micro ARN (miR), o de un sitio diana de un miR, en donde miR es miR-379, para su uso en el tratamiento o prevencion de una enfermedad seleccionada […]
Usos de composiciones que contienen un extracto tostado y xantohumol, del 15 de Julio de 2020, de Arcaini, Antonio: Composición, preferiblemente composición farmacéutica, que comprende xantohumol (XN), preferiblemente en una cantidad terapéuticamente eficaz, […]
BACTERIA DE HOLDEMANELLA SP. Y USO DE LA MISMA, del 2 de Julio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a la cepa de Holdemanella biformis la cepa H. biformis CECT 9752 a sus componentes celulares, metabolitos, […]