FORMA CRISTALINA III DE CLORHIDRATO DE MOXIFLOXACINA ANHIDRO Y SU PROCEDIMIENTO DE PREPARACION.
Un compuesto que es una forma cristalina III del monoclorhidrato de moxifloxacina anhidro que tiene un patrón de difracción de rayos X,
expresado en términos de ángulos 2zeta y obtenido con un difractómetro equipado con una fuente de radiación alfa-1 de cobre K, donde: (a) dicho patrón de difracción del polvo de rayos X incluye dos o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta de 7,1 ± 0,09, 8,8 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 16,6 ± 0,09, 17,7 ± 0,09 y 22,1 ± 0,09, o (b) dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta de 5,6 ± 0,09, 7,1 ± 0,09, 8,4 ± 0,09, 8,8 ± 0,09, 10,0 ± 0,09, 10,4 ± 0,09, 11,4 ± 0,09, 12,2 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 14,4 ± 0,09, 14,7 ± 0,09, 16,6 ± 0,09, 16,9 ± 0,09, 17,2 ± 0,09, 17,7 ± 0,09, 18,5 ± 0,09, 19,1 ± 0,09, 19,2 ± 0,09, 19,8 ± 0,09, 20,1 ± 0,09. 20,3 ± 0,09, 21,1 ± 0,09, 21,5 ± 0,09, 22,1 ± 0,09, 22,6 ± 0,09, 22,9 ± 0,09, 23,5 ± 0,09, 24,0 ± 0,09, 24,6 ± 0,09, 24,9 ± 0,09, 25,8 ± 0,09, 26,2 ± 0,09, 26,6 ± 0,09, 26,9 ± 0,09, 27,2 ± 0,09, 28,7 ± 0,09, 29,1 ± 0,09, 29,7 ± 0,09, 30,1 ± 0,09, 31,4 ± 0,09, 32,1 ± 0,09, 37,3 ± 0,09, 39,0 ± 0,09, 40,8 ± 0,09, 41,5 ± 0,09, 42,2 ± 0,09 y 43,1 ± 0,09 grados
Tipo: Resumen de patente/invención. Número de Solicitud: W04011031US.
Solicitante: DR. REDDY'S LABORATORIES LTD.
DR. REDDY'S LABORATORIES INC.
Nacionalidad solicitante: India.
Dirección: 7-1-27, AMEERPET,HYDERABAD 500 016.
Inventor/es: REDDY, MANNE, SATYANARAYANA, RAJU, VETUKURI, VENKATA, NAGA, KALI, VARA, PRASADA, KUMAR, RAPOLU, RAJESH, ESWARAIAH,SAJJA, SRINIVASREDDY,NINGAM, RAVINDRA,VEDANTHAM.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Agosto de 2009.
Clasificación Internacional de Patentes:
- A61K31/4709 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Quinoleínas no condensadas conteniendo otros heterociclos.
- C07D471/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/4709 A61K 31/00 […] › Quinoleínas no condensadas conteniendo otros heterociclos.
- C07D471/04 C07D 471/00 […] › Sistemas condensados en orto.
Clasificación antigua:
- A61K31/4709 A61K 31/00 […] › Quinoleínas no condensadas conteniendo otros heterociclos.
- C07D471/04 C07D 471/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Forma cristalina III de clorhidrato de moxifloxacina anhidro y su procedimiento de preparación.
Antecedentes de la invención
El monoclorhidrato de moxifloxacina es un agente antibacteriano sintético de amplio espectro. El resto activo, la moxifloxacina, ha mostrado ser clínicamente activo frente a la mayoría de las cepas de microorganismos, tales como microorganismos gram-positivos aerobios, incluyendo Staphylococcus aureus (sólo cepas susceptibles a la meticilina), Streptococcus pneumoniae (cepas susceptibles a la penicilina) y Streptococcus pyogenes; microorganismos gram-negativos aerobios, incluyendo Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae y Moraxella catarrhalis; y otros microorganismos como Chlamydia pneumoniae y Mycoplasma pneumoniae.
Resumen de la invención
Según un aspecto, la invención proporciona un compuesto que es una forma cristalina III del monoclorhidrato de moxifloxacina anhidro que tiene un patrón de difracción de rayos X, expresado en términos de ángulos 2? y obtenido con un difractómetro equipado con una fuente de radiación alfa-1 de cobre K, donde: (a) el patrón de difracción del polvo de rayos X incluye dos o más picos seleccionados entre el grupo consistente en picos con 2 ángulos theta de 7,1 ± 0,09, 8,8 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 16,6 ± 0,09, 17,7 ± 0,09 y 22,1 ± 0,09; o (b) dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo consistente en picos con 2 ángulos theta de 5,6 ± 0,09, 7,1 ± 0,09, 8,4 ± 0,09, 8,8 ± 0,09, 10,0 ± 0,09, 10,4 ± 0,09, 11,4 ± 0,09, 12,2 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 14,4 ± 0,09, 14,7 ± 0,09, 16,6 ± 0,09, 16,9 ± 0,09, 17,2 ± 0,09, 17,7 ± 0,09, 18,5 ± 0,09, 19,1 ± 0,09, 19,2 ± 0,09, 19,8 ± 0,09, 20,1 ± 0,09, 20,3 ± 0,09, 21,1 ± 0,09, 21,5 ± 0,09, 22,1 ± 0,09, 22,6 ± 0,09, 22,9 ± 0,09, 23,5 ± 0,09, 24,0 ± 0,09, 24,6 ± 0,09, 24,9 ± 0,09, 25,8 ± 0,09, 26,2 ± 0,09, 26,6 ± 0,09, 26,9 ± 0,09, 27,2 ± 0,09, 28,7 ± 0,09, 29,1 ± 0,09, 29,7 ± 0,09, 30,1 ± 0,09, 31,4 ± 0,09, 32,1 ± 0,09, 37,3 ± 0,09, 39,0 ± 0,09, 40,8 ± 0,09, 41,5 ± 0,09, 42,2 ± 0,09 y 43,1 ± 0,09 grados.
La forma cristalina III del monoclorhidrato de moxifloxacina anhidro puede también ser caracterizada por otros métodos analíticos.
En otro aspecto, la invención proporciona una composición que incluye moxifloxacina en forma sólida, donde al menos un 80% en peso del monoclorhidrato de moxifloxacina sólido es la forma cristalina III del monoclorhidrato de moxifloxacina anhidro. La forma cristalina III del monoclorhidrato de moxifloxacina anhidro en la composición de este aspecto de la invención puede ser caracterizada por los patrones de DRX tal como se describe.
La invención se relaciona también con un procedimiento para preparar la forma cristalina III del monoclorhidrato de moxifloxacina y con una composición farmacéutica que incluye la forma cristalina III del monoclorhidrato de moxifloxacina y uno o más soportes o diluyentes farmacéuticamente aceptables. La composición farmacéutica puede incluir también uno o más principios activos adicionales. Preferiblemente, la composición farmacéutica está en una forma de dosificación sólida para administración oral, tal como una tableta.
El compuesto puede ser usado para prevenir o tratar síndromes alérgicos mediante administración a un paciente que necesite dicho tratamiento de una cantidad efectiva de la forma cristalina III del monoclorhidrato de moxifloxacina anhidro.
Descripción de los dibujos adjuntos
La Figura 1 es una muestra de un difractograma de polvo de rayos X de la forma cristalina III del monoclorhidrato de moxifloxacina.
La Figura 2 es una muestra de un espectro de 13C-RMN en estado sólido de la forma cristalina III del monoclorhidrato de moxifloxacina.
La Figura 3 es una muestra de un espectro de infrarrojos de la forma cristalina III del monoclorhidrato de moxifloxacina.
La Figura 4 es una muestra de un termograma de análisis termogravimétrico de la forma cristalina III del monoclorhidrato de moxifloxacina.
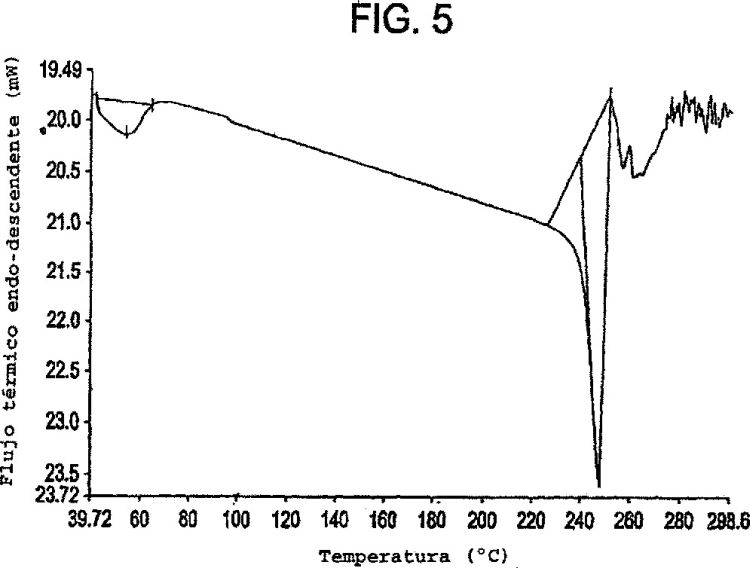
La Figura 5 es una muestra de un termograma de calorimetría de barrido diferencial de la forma cristalina III del monoclorhidrato de moxifloxacina.
Descripción detallada de la invención
A menos que se defina en contrario, los términos técnicos y científicos aquí empleados tienen el mismo significado que el comúnmente entendido por alguien con conocimientos ordinarios en la técnica a la que esta invención pertenece.
A menos que se indique en contrario, cualquier uso de palabras tales como "incluye", "contiene", "comprende", "tiene" y similares significa "incluye sin limitación" y no se considerará que limita ninguna afirmación general que se dé a los artículos o materias específicos o similares que van inmediatamente después. Las realizaciones de la invención no se excluyen mutuamente, pero pueden ser utilizadas en diversas combinaciones. Las realizaciones descritas de la invención y los ejemplos expuestos son dados con fines ilustrativos más que limitativos de la invención tal como queda expuesta en las reivindicaciones adjuntas.
Para los fines de la presente invención, se definen a continuación los siguientes términos.
Un "compuesto" es una substancia química que incluye moléculas de la misma estructura química.
"Farmacéuticamente aceptable" significa que es útil en la preparación de una composición farmacéutica generalmente no tóxica y no indeseable desde el punto de vista biológico, e incluye la característica de ser aceptable para uso veterinario y/o uso farmacéutico humano.
El término "composición" incluye, aunque sin limitación, un polvo, una suspensión, una emulsión y/o sus mezclas. El término composición pretende abarcar un producto que contiene los ingredientes especificados en las cantidades especificadas, así como cualquier producto que resulte, directa o indirectamente, de la combinación de los ingredientes especificados en las cantidades especificadas. Una "composición" puede contener un solo compuesto o una mezcla de compuestos.
El término "composición farmacéutica" pretende abarcar un producto que contiene el/los principio(s) activo(s) y excipientes farmacéuticamente aceptables que constituyen el soporte, así como cualquier producto que resulte, directa o indirectamente, de la combinación, acomplejación o agregación de cualesquiera dos o más de los ingredientes, o de la disociación de uno o más de los ingredientes, o de otros tipos de reacciones o interacciones de uno o más de los ingredientes. En consecuencia, las composiciones farmacéuticas de la presente invención incluyen cualquier composición preparada mezclando el principio activo, principio(s) activo(s) adicional(es) y excipientes farmacéuticamente aceptables.
El término "excipiente" significa un componente de un producto farmacéutico que no es el principio activo, tal como un rellenante, un diluyente, un soporte, etc. Los excipientes útiles en la preparación de una composición farmacéutica son preferiblemente generalmente seguros, no tóxicos y no indeseables biológicamente ni desde otro punto de vista, y son aceptables para uso veterinario, así como para uso farmacéutico humano. "Un excipiente farmacéuticamente aceptable", tal como se usa en la descripción y en las reivindicaciones, incluye tanto uno como más de uno de dichos excipientes.
El término "aislamiento" es utilizado para indicar la separación del compuesto que está siendo aislado independientemente de la pureza del compuesto aislado con respecto a cualquier substancia no deseada que se presente con el compuesto como una mezcla. Así, el grado de pureza del compuesto aislado o separado no afecta al estado del "aislamiento".
El término "alcohol alquílico inferior" define alcoholes que tienen de 1 a 8 átomos de carbono y que son capaces de disolver el monoclorhidrato de moxifloxacina o la moxifloxacina a sus temperaturas de reflujo con una solubilidad de al menos 0,05 g/ml (fármaco-a-solvente).
El término "substancialmente libre de" en relación a una composición, tal como se usa aquí, significa que la substancia no puede ser detectada en la composición por métodos conocidos para los expertos en la técnica en el momento de la presentación de esta solicitud.
El término "forma cristalina III del monoclorhidrato de moxifloxacina anhidro" es utilizado para hacer...
Reivindicaciones:
1. Un compuesto que es una forma cristalina III del monoclorhidrato de moxifloxacina anhidro que tiene un patrón de difracción de rayos X, expresado en términos de ángulos 2? y obtenido con un difractómetro equipado con una fuente de radiación alfa-1 de cobre K, donde: (a) dicho patrón de difracción del polvo de rayos X incluye dos o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta de 7,1 ± 0,09, 8,8 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 16,6 ± 0,09, 17,7 ± 0,09 y 22,1 ± 0,09, o (b) dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta de 5,6 ± 0,09, 7,1 ± 0,09, 8,4 ± 0,09, 8,8 ± 0,09, 10,0 ± 0,09, 10,4 ± 0,09, 11,4 ± 0,09, 12,2 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 14,4 ± 0,09, 14,7 ± 0,09, 16,6 ± 0,09, 16,9 ± 0,09, 17,2 ± 0,09, 17,7 ± 0,09, 18,5 ± 0,09, 19,1 ± 0,09, 19,2 ± 0,09, 19,8 ± 0,09, 20,1 ± 0,09. 20,3 ± 0,09, 21,1 ± 0,09, 21,5 ± 0,09, 22,1 ± 0,09, 22,6 ± 0,09, 22,9 ± 0,09, 23,5 ± 0,09, 24,0 ± 0,09, 24,6 ± 0,09, 24,9 ± 0,09, 25,8 ± 0,09, 26,2 ± 0,09, 26,6 ± 0,09, 26,9 ± 0,09, 27,2 ± 0,09, 28,7 ± 0,09, 29,1 ± 0,09, 29,7 ± 0,09, 30,1 ± 0,09, 31,4 ± 0,09, 32,1 ± 0,09, 37,3 ± 0,09, 39,0 ± 0,09, 40,8 ± 0,09, 41,5 ± 0,09, 42,2 ± 0,09 y 43,1 ± 0,09 grados.
2. Un compuesto según la reivindicación 1, opción (b), donde dicho patrón de difracción de rayos X incluye picos con ángulos 2 theta de aproximadamente 5,6, 7,1, 8,4, 8,8, 10,0, 10,4, 11,4, 12,2, 13,1, 13,9, 14,4, 14,7, 16,6, 16,9, 17,2, 17,7, 18,5, 19,1, 19,2, 19,8, 20,1, 20,3, 21,1, 21,5, 22,1, 22,6, 22,9, 23,5, 24,0, 24,6, 24,9, 25,8, 26,2, 26,6, 26,9, 27,2, 28,7, 29,1, 29,7, 30,1, 31,4, 32,1, 37,3, 39,0, 40,8, 41,5, 42,2 y 43,1 grados.
3. Un compuesto según la reivindicación 1 que tiene un espectro de 13C-RMN en estado sólido que comprende un pico a aproximadamente 107 ppm.
4. Un compuesto según la reivindicación 1 que tiene un espectro de absorción de infrarrojos que tiene bandas de absorción a aproximadamente 1159 cm-1 y 2706 cm-1.
5. Un compuesto según la reivindicación 1 que tiene un termograma de calorimetría de barrido diferencial que exhibe un pico endotérmico a aproximadamente 246ºC.
6. Una composición que contiene monoclorhidrato de moxifloxacina en forma de sólido, donde al menos un 80% en peso de dicho monoclorhidrato de moxifloxacina sólido es una forma cristalina III del monoclorhidrato de moxifloxacina anhidro que tiene un patrón de difracción de rayos X, expresado en términos de ángulos 2? y obtenido con un difractómetro equipado con una fuente de radiación alfa-1 de cobre K, donde dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo expuesto en la reivindicación 1, opción (b), o dos o más picos seleccionados entre el grupo expuesto en la reivindicación 1, opción (a).
7. Una composición según la reivindicación 6, donde al menos un 90% en peso de dicho monoclorhidrato de moxifloxacina sólido está en dicha forma cristalina III.
8. Una composición farmacéutica que incluye una cantidad farmacéuticamente efectiva de una forma cristalina III del monoclorhidrato de moxifloxacina anhidro y uno o más soportes o diluyentes farmacéuticamente aceptables, donde dicha forma cristalina III del monoclorhidrato de moxifloxacina anhidro tiene un patrón de difracción de rayos X expresado en términos de ángulos 2 theta y obtenido con una fuente de radiación alfa-1 de cobre K donde dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta expuestos en la reivindicación 1 (b), o dos o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta expuestos en la reivindicación 1, opción (a).
9. Una composición farmacéutica según la reivindicación 8, que es una forma de dosificación sólida para administración oral.
10. Un procedimiento para la preparación de una forma cristalina III del monoclorhidrato de moxifloxacina según la reivindicación 1, cuyo procedimiento consiste en:
a) someter a reflujo azeotrópicamente un monoclorhidrato de moxifloxacina de partida en un solvente seleccionado entre el grupo consistente en acetato de butilo terciario, ciclohexano, tolueno, metilisobutilcetona y sus mezclas;
b) enfriar el solvente sometido a reflujo mientras se agita la mezcla hasta que se separa un sólido, y
c) aislar dicho sólido separado para obtener así dicha forma cristalina III del monoclorhidrato de moxifloxacina anhidro.
11. Un procedimiento para la preparación de una forma cristalina III del monoclorhidrato de moxifloxacina según la reivindicación 1, cuyo procedimiento consiste en:
a) disolver clorhidrato de moxifloxacina en un alcohol alquílico de 1 a 8 átomos de carbono y que es capaz de disolver el monoclorhidrato de moxifloxacina o la moxifloxacina a su temperatura de reflujo con una solubilidad de fármaco a solvente de al menos 0,05 g/ml para obtener una solución;
b) añadir a la solución un antisolvente en el que el clorhidrato de moxifloxacina es escasamente soluble;
c) enfriar los solventes mixtos hasta que se separa un sólido, y
d) aislar dichos sólidos para obtener así dicha forma cristalina III del monoclorhidrato de moxifloxacina.
12. Un procedimiento según la reivindicación 11, donde dicho alcohol es seleccionado entre el grupo consistente en metanol, etanol, alcohol t-butílico, alcohol isopropílico y sus mezclas.
13. Un procedimiento según la reivindicación 11 ó 12, donde dicho antisolvente es el acetonitrilo.
14. Monoclorhidrato de moxifloxacina que tiene un patrón de difracción de rayos X, expresado en términos de ángulos 2? y obtenido con un difractómetro equipado con una fuente de radiación alfa-1 de cobre K donde dicho patrón de difracción del polvo de rayos X incluye cinco o más picos seleccionados entre el grupo consistente en picos con ángulos 2 theta de 5,6 ± 0,09, 7,1 ± 0,09, 8,4 ± 0,09, 8,8 ± 0,09, 10,0 ± 0,09, 10,4 ± 0,09, 11,4 ± 0,09, 12,2 ± 0,09, 13,1 ± 0,09, 13,9 ± 0,09, 14,4 ± 0,09, 14,7 ± 0,09, 16,6 ± 0,09, 16,9 ± 0,09, 17,2 ± 0,09, 17,7 ± 0,09, 18,5 ± 0,09, 19,1 ± 0,09, 19,2 ± 0,09, 19,8 ± 0,09, 20,1 ± 0,09, 20,3 ± 0,09, 21,1 ± 0,09, 21,5 ± 0,09, 22,1 ± 0,09, 22,6 ± 0,09, 22,9 ± 0,09, 23,5 ± 0,09, 24,0 ± 0,09, 24,6 ± 0,09, 24,9 ± 0,09, 25,8 ± 0,09, 26,2 ± 0,09, 26,6 ± 0,09, 26,9 ± 0,09, 27,2 ± 0,09, 28,7 ± 0,09, 29,1 ± 0,09, 29,7 ± 0,09, 30,1 ± 0,09, 31,4 ± 0,09, 32,1 ± 0,09, 37,3 ± 0,09, 39,0 ± 0,09, 40,8 ± 0,09, 41,5 ± 0,09, 42,2 ± 0,09 y 43,1 ± 0,09 grados, producido según los métodos de cualquiera de las reivindicaciones 10 a 13.
Patentes similares o relacionadas:
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Procedimiento de preparación de la forma A de grapiprant, del 22 de Julio de 2020, de Aratana Therapeutics Inc: Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Compuestos tricíclicos como agentes antineoplásicos, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula **(Ver fórmula)** en la que: A es **(Ver fórmula)** X e Y se seleccionan independientemente entre hidrógeno, alquilo (C1-C6), […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]