FORMA CRISTALINA ESTABLE DE BIFEPRUNOX MESILATO, FORMAS DE DOSIFICACION DEL MISMO Y METODOS DE UTILIZACION.
Una composición farmacéutica que comprende una cantidad eficaz de un ingrediente activo que comprende mesilato de bifeprunox y al menos un excipiente farmacéuticamente aceptable,
- en la que al menos aproximadamente 90% en peso del compuesto activo es la forma cristalina polimórfica alfa (alfa) y comprende menos de 10% en peso de las formas delta (delta) o gamma (gamma), siendo las difracciones de rayos X en polvo de las formas:
- en la que la cantidad eficaz de mesilato de bifeprunox es aproximadamente 0,05 a aproximadamente 40 mg, con la condición de que la cantidad eficaz no es 10 mg, y que comprende además lactosa monohidrato, glicolato sódico de almidón, estearil fumarato sódico y celulosa microcristalina
Tipo: Resumen de patente/invención. Número de Solicitud: W06060055EP.
Solicitante: SOLVAY PHARMACEUTICALS B.V..
Nacionalidad solicitante: Países Bajos.
Dirección: C.J. VAN HOUTENLAAN 36,1381 CP WEESP.
Inventor/es: EIJGENDAAL,IRENE, KLEIN,GERRIT, TERHORST-VAN AMSTEL,MARIA J.L. IPSI DEPARTMENT, ZWIER,KLAAS IPSI DEPARTMENT, BRUINS,NICO IPSI DEPARTMENT, RIGTER,HENDRIKUS T. IPSI DEPARTMENT, GOUT,ERIC IPSI DEPARTMENT, BOON,CAROLINE IPSI DEPARTMENT, DE VRIES,MICHIEL H. IPSI DEPARTMENT.
Fecha de Publicación: .
Fecha Concesión Europea: 19 de Agosto de 2009.
Clasificación Internacional de Patentes:
- A61K31/498 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirazinas o piperazinas condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinoxalina, fenazina.
- A61K9/20H2
- A61K9/20H4B
- A61K9/20H6F2
Clasificación PCT:
- A61K31/498 A61K 31/00 […] › Pirazinas o piperazinas condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinoxalina, fenazina.
- A61K9/28 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/48 A61K 9/00 […] › Preparaciones en cápsulas, p. ej. de gelatina, de chocolate.
- A61P25/18 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Antipsicóticos, es decir, neurolépticos; Medicamentos para el tratamiento de la esquizofrenia o de las fobias.
Fragmento de la descripción:
Forma cristalina estable de bifeprunox mesilato, formas de dosificación del mismo y métodos de utilización.
Campo de la invención
La presente descripción se refiere a una formulación farmacéutica que comprende una forma polimórfica estable del compuesto monometanosulfonato de 7-[4-([1,1'-bifenil]-3-ilmetil-1-piperacinil]-2(3H)-benzoxazolona y al uso de dicha formulación farmacéutica para el tratamiento de varios trastornos tales como trastornos del SNC.
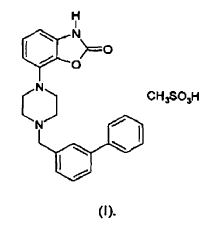
La sal mesilato del compuesto monometanosulfonato de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona (INNM mesilato de bifeprunox) tiene la fórmula
La sal de ácido clorhídrico de este compuesto (7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona (bifeprunox) se describe y reivindica en WO97/36893 y la sal monometanosulfonato se describe y reivindica en WO02/066449. En la segunda de esta publicaciones de patente se describe la formación directa de la sal monometanosulfonato por la reacción entre el éster mesilato reactivo de N,N,N-bis(2-etanol)-m-fenilbencil amina y 7-amino-2(3H)-benzoxazolona.
Se ha descubierto que por el método descrito en WO02/066449 el mesilato de bifeprunox se obtiene normalmente como un producto crudo (intervalo de fusión indicado en WO02/066449 como 263-275ºC) en una forma polimórfica que se indica adicionalmente en esta solicitud como polimorfo d (delta). Después de purificación adicional, el producto se obtiene en dos modificaciones diferentes de cristal o una mezcla de estas dos modificaciones. La primera de las dos modificaciones es el polimorfo d (delta) ya mencionado y tiene un punto de fusión en la forma pura de 265ºC. La segunda modificación se indica adicionalmente como polimorfo ? (gamma). Cuando el polimorfo ? se obtiene de forma predominante, se obtiene en casi todos los casos en una mezcla de dicho polimorfo con el polimorfo d, teniendo la mezcla un punto de fusión de aproximadamente 273ºC.
Durante investigaciones adicionales resultó que los polimorfos ? y d son metastables, y por lo tanto pueden presentar inconvenientes cuando se usan en una formulación farmacéutica. La formación impredecible de uno de los dos polimorfos ? y d o una mezcla de éstos tampoco es deseable. Sería deseable, por lo tanto, proporcionar una forma cristalina estable del monometanosulfonato de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona para uso farmacéutico que pueda producirse consistentemente.
Se ha encontrado que el monometanosulfonato de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona tiene también otra forma cristalina polimórfica (referida más adelante como polimorfo a (alfa)) que no tiene las desventajas de los polimorfos mencionados anteriormente. Esta forma cristalina del mesilato de bifeprunox es más estable termodinámicamente. La forma polimórfica a no sufre conversión, incluso a una humedad atmosférica alta o una temperatura alta. Además, esta forma cristalina cristaliza en la forma de cristales grandes que pueden filtrarse fácilmente y tienen una alta pureza. Por lo tanto, este polimorfo a es particularmente adecuado para la formulación del mesilato de bifeprunox en una forma sólida, si se desea después de la reducción del tamaño de las partículas.
La presente descripción proporciona la forma polimórfica a del mesilato de bifeprunox a varios niveles de pureza, formas de dosificación farmacéuticas que comprenden la forma polimórfica a del mesilato de bifeprunox y el uso de dichas formas de dosificación para el tratamiento o prevención de varias enfermedades y trastornos.
Descripción breve de los dibujos
La Fig. 1 muestra un patrón de XRPD de la forma polimórfica a del mesilato de bifeprunox.
La Fig. 2 muestra una señal de DSC de la forma polimórfica a del mesilato de bifeprunox.
La Fig. 3 muestra un espectro de IR (ATR) de la forma polimórfica a del mesilato de bifeprunox.
La Fig. 4 muestra un espectro de 13C RMN en estado sólido de la forma polimórfica a del mesilato de bifeprunox.
La Fig. 5 muestra la configuración de la forma polimórfica a del mesilato de bifeprunox obtenida a partir de cristalografía de rayos X.
La Fig. 6 muestra un patrón de XRPD de la forma polimórfica ? del mesilato de bifeprunox.
La Fig. 7 muestra una señal de DSC de la forma polimórfica ? del mesilato de bifeprunox.
La Fig. 8 muestra un espectro de IR (ATR) de la forma polimórfica ? del mesilato de bifeprunox.
La Fig. 9 muestra un espectro de 13C RMN en estado sólido de la forma polimórfica ? del mesilato de bifeprunox.
La Fig. 10 muestra la configuración de la forma polimórfica ? del mesilato de bifeprunox obtenida a partir de cristalografía de rayos X.
La Fig. 11 muestra un patrón de XRPD de la forma polimórfica d del mesilato de bifeprunox.
La Fig. 12 muestra una señal de DSC de la forma polimórfica d del mesilato de bifeprunox.
La Fig. 13 muestra un espectro de IR (ATR) de la forma polimórfica d del mesilato de bifeprunox.
La Fig. 14 muestra un espectro de 13C RMN en estado sólido de la forma polimórfica d del mesilato de bifeprunox.
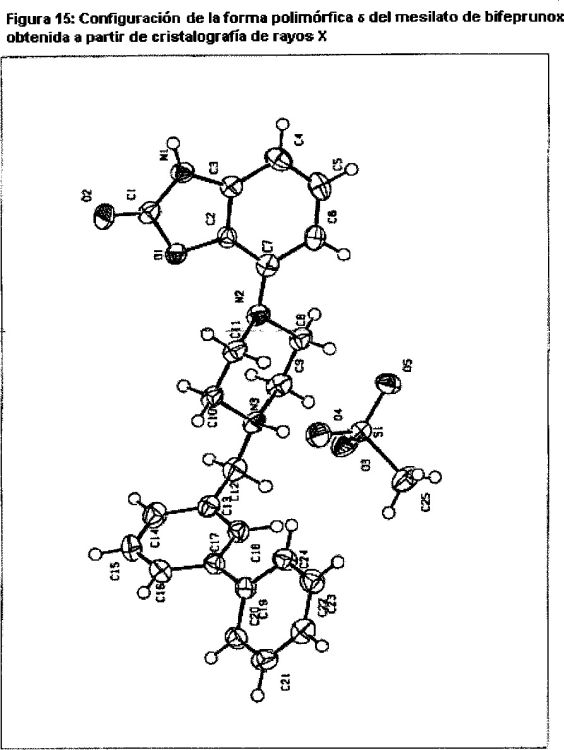
La Fig. 15 muestra la configuración de la forma polimórfica d del mesilato de bifeprunox obtenida a partir de cristalografía de rayos X.
La forma cristalina polimórfica del mesilato de bifeprunox según la presente descripción se define por al menos uno de los parámetros fisicoquímicos siguientes:
Patrones de difracción de rayos X (Tabla 1 y Figura 1);
El punto de fusión de la forma polimórfica a es 277ºC (velocidad de calentamiento DSC 10 K/min) (véase el termograma de DSC, Figura 2);
Espectro de IR (Tabla 2 y Figura 3), en el que las bandas de absorción IR características de la forma a del mesilato de bifeprunox que pueden usarse para distinguir esta forma de las formas ? y d se proporcionan en la Tabla 2a;
Espectro de 13C-RMN en estado sólido (Tabla 3 y Figura 4), en el que los desplazamientos 13C-RMN característicos de la forma a del mesilato de bifeprunox que pueden usarse para distinguir esta forma de las formas ? y d se proporcionan en la Tabla 3a;
Difracción de rayos X de cristal único (Tablas 4 y 5 y Figura 5).
La Tabla 1 muestra las difracciones de rayos X en polvo (XRPD) características de las formas a, ? y d del mesilato de bifeprunox. La Figura 1 proporciona un patrón de XRPD representativo de la forma polimórfica a del mesilato de bifeprunox.

La Tabla 2 muestra las bandas de absorción IR características de las formas a, ? y d del mesilato de bifeprunox. La Figura 2 proporciona un espectro de IR representativo de la forma polimórfica a del mesilato de bifeprunox.

La Tabla 2a también muestra bandas de absorción IR importantes de las formas a, ? y d del mesilato de bifeprunox que pueden usarse para distinguir las tres formas.

La Tabla 3 muestra los desplazamientos químicos característicos de 13C RMN en estado sólido en las formas a, ? y d del mesilato de bifeprunox. La Figura 3 proporciona un espectro de 13C RMN en estado sólido representativo de la forma polimórfica a del mesilato de bifeprunox.

La Tabla 3a también muestra bandas de desplazamientos químicos de 13C RMN en estado sólido importantes de las formas a, ? y d del mesilato de bifeprunox que pueden usarse para distinguir las tres formas.

La Tabla 4 muestra parámetros relevantes de la recogida de datos de Difracción...
Reivindicaciones:
1. Una composición farmacéutica que comprende una cantidad eficaz de un ingrediente activo que comprende mesilato de bifeprunox y al menos un excipiente farmacéuticamente aceptable,
- en la que al menos aproximadamente 90% en peso del compuesto activo es la forma cristalina polimórfica a (alfa) y comprende menos de 10% en peso de las formas d (delta) o ? (gamma), siendo las difracciones de rayos X en polvo de las formas:

- en la que la cantidad eficaz de mesilato de bifeprunox es aproximadamente 0,05 a aproximadamente 40 mg, con la condición de que la cantidad eficaz no es 10 mg, y que comprende además lactosa monohidrato, glicolato sódico de almidón, estearil fumarato sódico y celulosa microcristalina.
2. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es aproximadamente 0,75 a aproximadamente 35 mg.
3. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es aproximadamente 0,1 a aproximadamente 30 mg.
4. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es aproximadamente 0,125 a aproximadamente 20 mg.
5. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es 0,125 mg.
6. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es 1 mg.
7. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es 5 mg.
8. La composición farmacéutica de la reivindicación 1, en la que la cantidad eficaz de mesilato de bifeprunox es 20 mg.
9. Uso de la composición farmacéutica de una cualquiera de las reivindicaciones 1-8 para la preparación de un medicamento para el tratamiento de un trastorno del SNC, en el que la cantidad es eficaz para el tratamiento del trastorno y en el que la administración al paciente resulta en la aparición de al menos uno de:
- (a) un Tmax plasmático de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H) como mucho en aproximadamente 3 horas;
- (b) una Cmax plasmática de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona de al menos a- proximadamente 0,1 ng/ml; o
- (c) una AUC0-24 plasmática de 7-[4-([1,1'-bifenil]-3-ilmetil)-1-piperacinil]-2(3H)-benzoxazolona de al menos aproximadamente 0,9 hr ng/ml.
10. El uso según la reivindicación 9, en el que el trastorno del SNC se elige de un trastorno psicótico y la enfermedad de Parkinson.
11. El uso según la reivindicación 10, en el que el trastorno psicótico es esquizofrenia.
Patentes similares o relacionadas:
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Solución oftálmica de tartrato de brimonidina tópica, del 17 de Junio de 2020, de Sentiss Pharma Private Limited: Una composición oftálmica acuosa que comprende tartrato de brimonidina, hidroxipropilmetilcelulosa y desprovisto de polímero celulósico aniónico, junto con un conservante […]
Compuestos de sulfonamida inversa a base de sulfuro, alquilo y piridilo para el tratamiento del VHB, del 13 de Mayo de 2020, de Novira Therapeutics Inc: compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo; en la que cada R1 se selecciona independientemente de H, halo […]
Sales de xantilio 3,6-disustituidas, del 29 de Abril de 2020, de WISTA LABORATORIES LTD.: Un compuesto de fórmula (II) para usar en un método de tratamiento o profilaxis de una afección de tauopatía o una enfermedad de agregación de proteínas […]
Compuestos monocíclicos sustituidos con heteroarilo, del 29 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Fórmula (I): **(Ver fórmula)** o una de sus sales; en la que: R1 es -OCH3, -OCHF2 o -CH2OCH3; R2 es H, F, Cl, Br, -10 OH, […]
Antagonistas del cisteinil leucotrieno, del 25 de Marzo de 2020, de Sun Pharma Advanced Research Company Ltd: Un compuesto de la fórmula (Ia), o la sal farmacéuticamente aceptable de este, **(Ver fórmula)** en donde, R1 y R2 se seleccionan de hidrógeno y halógeno; […]
Compuestos de amina que tienen actividad anti-inflamatoria, antifúngica, antiparasitaria y anticáncer, del 4 de Marzo de 2020, de WELLSTAT THERAPEUTICS CORPORATION: Un compuesto representado por la Fórmula IA1a o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** caracterizado porque: n es 2, 3, 4, 5, […]
Terapia ocular usando agonistas del receptor adrenérgico alfa 2 que tienen tasas de aclaramiento en la parte anterior mejoradas, del 12 de Febrero de 2020, de ALLERGAN, INC.: Material oftálmicamente terapéutico, que comprende: un componente terapéutico que comprende una cantidad terapéuticamente eficaz de un agonista del receptor […]