ESTRATEGIA AUTOMATIZADA DE IDENTIFICACION DEL PERFIL DE GLUCOSILACION.
Un método in vitro para determinar uno o más marcadores de glucosilación de una enfermedad que comprende las etapas de:
- proporcionar una muestra de enfermo y una muestra de control, donde la muestra de enfermo es una muestra de un sujeto al que se le ha diagnosticado la enfermedad y la muestra de control es una muestra de un control sano;
- inmovilizar las glucoproteínas totales de la muestra de enfermo y de la muestra de control sobre una membrana de unión a proteínas o en un gel sin separar el gel en bandas;
- liberar una combinación de glucanos de las glucoproteínas totales inmovilizadas de la muestra de enfermo y liberar una combinación de glucanos de las glucoproteínas totales inmovilizadas de la muestra de control del gel o la membrana de unión a proteínas sin haber purificado una glucoproteína específica y sin exponer la muestra de enfermo y la muestra de control a hidrazinolisis;
- medir un perfil de glucosilación de la combinación de glucanos de la muestra de enfermo y medir un perfil de glucosilación de la combinación de glucanos de la muestra de control usando cromatografía, espectrometría de masas o una combinación de las mismas; y
- comparar el perfil de glucosilación de la muestra de enfermo con el perfil de glucosilación de la muestra de control para determinar uno o más marcadores de glucosilación de la enfermedad
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2005/002995.
Solicitante: NATIONAL INSTITUTE FOR BIOPROCESSING RESEARCH AND TRAINING LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: ENGINEERING BUILDING BELFIELD,DUBLIN 4.
Inventor/es: DWEK, RAYMOND, A., ZITZMANN,NICOLE, ROYLE,LOUISE, RADCLIFFE,CATHERINE, RUDD,PAULINE M.
Fecha de Publicación: .
Fecha Concesión Europea: 4 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- G01N33/68A
- G01N33/68A8
Clasificación PCT:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
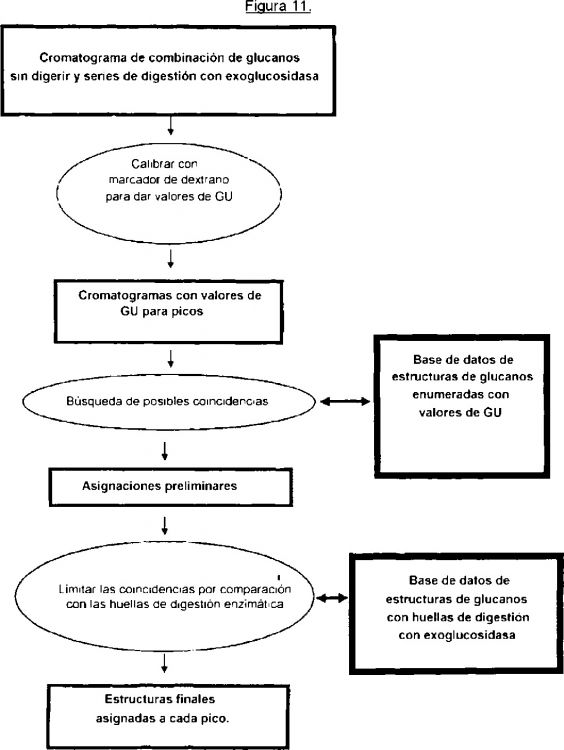
Fragmento de la descripción:
Estrategia automatizada de identificación del perfil de glucosilación.
Antecedentes de la invención
Esta invención se refiere generalmente a métodos de diagnóstico y control de enfermedades y, en particular, a métodos automáticos de diagnóstico y control de enfermedades basados en un análisis detallado de glucanos.
Los cambios en la glucosilación relacionados con enfermedades específicas para glucanos liberados a partir de IgG de suero purificada se describieron por primera vez para la artritis reumatoide, véase Parekh et. al. "Association of Rheumatoid Arthritis and Primary Osteoarthritis with Changes in the Glycosylation Pattern of Total Serum IgG", Nature, 316, págs. 452-457, 1985. Trabajos posteriores demostraron que estos cambios no sólo eran diagnósticos de artritis reumatoide (RA), sino que también podían usarse como indicadores de pronóstico, así como para el control de la actividad de la enfermedad RA, véase, por ejemplo, "Galactosylation of IgG associated oligosaccharides: Reduction in patients with adult and juvenile onset rheumatoid arthritis and relation to disease activity", R. B. Parekh, D. A. Isenberg, B. M. Ansell, I. M. Roitt, R. A. Dwek y T. W. Rademacher (1988) Lancet, 1 (8592), 966-969; "A comparative analysis of disease-associated changes in the galactosylation of serum IgG" R. B. Parekh, D. Isenberg, G. Rook, I. Roitt, R. A. Dwek y T. W. Rademacher (1989) J. Autoimmunity, 2, 101-114; 3rd Jenner International Immunoglycobiology Meeting Abstract R. B. Parekh, Isenberg, D., Dwek, R. A. y Rademacher, T. W. Glycoconjugate Journal (1994) 1, 3195-227. Posteriormente, se demostró que los cambios de glucosilación específicos en la glucosilación en suero total también pueden ser biomarcadores de otras enfermedades. Por ejemplo, Block et. al. determinaron cambios en la glucosilación específicos en el suero total de marmotas infectadas con el virus de la hepatitis B que desarrollaron carcinoma hepatocelular por realización de un análisis de glucosilación en glucanos liberados enzimáticamente a partir de una solución de suero total, véase Block, T. M., Comunale, M. A., Lowman, M., Steel, L. F., Romano, P. R., Fimmel, C., Tennant, B. C., London, W, T., Evans, A. A., Blumberg, B. S., Dwek, R. A., Mattu, T. S. y Mehta, A. S. (2005). "Use of targeted glycoproteomics to identify serum glycoproteins that correlate with liver cancer in woodchucks and humans". Proc Natl Acad Sci U S A 102: 779-84. El análisis de glucosilación de glucoproteínas en suero completo de pacientes y controles sanos usando una combinación de cromatografía líquida de alto rendimiento (HPLC) (véase Guile, G. R., et. al., "A rapid high-resolution high-performance liquid chromatographic method for separating glycan mixtures and analyzing oligosaccharide profiles". Anal. Biochem. 240: 210-26, 1996; Royle, L., et. al. "An analytical and structural database provides a strategy for sequencing O-glycans from microgram quantities of glycoproteins". Anal. Biochem. 304: 70-90, 2002) y la tecnología de Espectrometría de Masas (MS) se usó por primera vez para confirmar el diagnóstico de un paciente con trastornos congénitos de la glucosilación (CDG) tipo II y para establecer la etapa de procesamiento de glucosilación defectuosa en un paciente sin diagnosticar, véase Butler, M., et. al. "Detailed glycan analysis of serum glycoproteins of patients with congenital disorders of glycosylation indicates the specific defective glycan processing step and provides an insight into pathogenesis". Glycobiology 13: 601-22, 2003. El perfil y el análisis de glucanos eran erróneos debido a que se usó hidrazinolisis para liberar los glucanos. El uso de hidrazinolisis da como resultado la desialilación de una proporción significativa de los azúcares y la introducción de varios artefactos tales como pérdida de grupos N-acetilo y N-glicolilo de los restos de aminoazúcares (que posteriormente se vuelven a N-acetilar y esto puede dar como resultado tanto una sub-como una sobre-acetilación), así como pérdida de sustituciones O-acetilo en ácidos siálicos. Callewaert et al. usaron la liberación enzimática en el análisis de glucosilación se suero completo por electroforesis capilar en una plataforma microfluídica, véase, Callewaert, N., Contreras, R., Mitnik-Gankin, L., Carey, L., Matsudaira, P. y Ehrlich, D. (2004). "Total serum protein N-glycome profiling on a capillary electrophoresis-microfluidics platform". Electrophoresis 25: 3128-31 y Callewaert, N., Schollen, E., Vanhecke, A., Jaeken, J., Matthijs, G., y Contreras, R. (2003). "Increased fucosylation and reduced branching of serum glycoprotein N-glycans in all known subtypes of congenital disorder of glycosylation I". Glycobiology 13: 367-375. Aunque la liberación enzimática de Callewaert et. al. es compatible con un formato de alto rendimiento, sus análisis determinaron solamente las estructuras desialiladas principales. Por lo tanto, todavía existe la necesidad de desarrollar un método totalmente automatizado de alto rendimiento para determinar marcadores de glucosilación robustos de enfermedades basadas en un análisis de glucosilación detallado de glucoproteínas totales en muestras de fluido corporal o tejido corporal.
La Publicación de Patente Internacional Nº WO 2004/019040 describe un método de identificación de marcadores de patologías usando espectrometría de masas en muestras que contienen glucanos parcialmente purificadas.
La Publicación de Patente de Estados Unidos Nº US 2004/0253651 describe un método de diagnóstico del cáncer en una muestra biológica por determinación de la presencia de secuencias de oligosacáridos específicas de cáncer en la muestra.
Sumario de la invención
Una realización de la invención es un método in vitro de terminación de uno o más marcadores de glucosilación de una enfermedad que comprende las etapas de:
La muestra puede ser una muestra de un fluido corporal, por ejemplo, suero completo o un tejido corporal. Los glucanos pueden ser glucanos unidos a N o glucanos unidos a O.
El método puede incluir una etapa adicional de marcaje de los glucanos de la combinación de glucanos con un marcador radiactivo o fluorescente antes de medir el perfil de glucosilación.
El método puede comprender además seleccionar un mejor marcador de glucosilación de entre los marcadores de glucosilación, donde el mejor marcador de glucosilación tiene una mayor correlación con uno o más parámetros de la enfermedad.
El método puede comprender además una etapa de segregación y/o amplificación del uno o más marcadores de glucosilación por digestión de los glucanos con una o más exoglucosidasas. Dicha digestión puede realizarse de forma secuencial o con una serie que comprende la una o más exoglucosidasas.
El método puede incluir una etapa de uso de una base de datos para realizar asignaciones preliminares y finales de las estructuras de los glucanos.
El método puede comprender además una etapa de uso del uno o más marcadores de glucosilación de la enfermedad para diagnosticar, pronosticar y/o controlar la enfermedad.
Otra realización de la invención es un método in...
Reivindicaciones:
1. Un método in vitro para determinar uno o más marcadores de glucosilación de una enfermedad que comprende las etapas de:
2. Un método de acuerdo con la reivindicación 1, en el que la muestra es una muestra de un fluido corporal o un tejido corporal.
3. Un método de acuerdo con la reivindicación 2, en el que el fluido corporal es suero completo.
4. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que los glucanos son glucanos unidos a N.
5. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que los glucanos son glucanos unidos a O.
6. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que el método incluye una etapa adicional de marcaje de los glucanos de la combinación de glucanos con un marcador radiactivo fluorescente antes de medir el perfil de glucosilación.
7. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 6, que comprende además seleccionar un mejor marcador de glucosilación de entre los marcadores de glucosilación, donde el mejor marcador de glucosilación tiene una mayor correlación con uno o más parámetros de la enfermedad.
8. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 7, que comprende además una etapa de segregar y/o amplificar el uno o más marcadores de glucosilación por digestión de los glucanos con una o más exoglucosidasas.
9. Un método de acuerdo con la reivindicación 8, en el que dicha digestión se realiza de forma secuencial.
10. Un método de acuerdo con la reivindicación 8, en el que dicha digestión es una digestión con una serie que comprende la una o más exoglucosidasas.
11. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 10, que comprende además el uso de una base de datos para realizar asignaciones preliminares y finales de estructuras de los glucanos.
12. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 11, que comprende además el uso de uno o más marcadores de glucosilación de la enfermedad para diagnosticar, pronosticar y/o controlar la enfermedad.
13. Un método in vitro para diagnosticar y controlar una enfermedad en un sujeto que comprende las etapas de:
14. Un método de acuerdo con la reivindicación 13, en el que la enfermedad es cáncer, una enfermedad autoinmune o un trastorno congénito de la glucosilación.
15. Un método de acuerdo con la reivindicación 14, en el que la enfermedad autoinmune es artritis reumatoide.
16. Un método de acuerdo con una cualquiera de las reivindicaciones 13 a 15, en el que el fluido corporal es suero completo.
17. Un método de acuerdo con la reivindicación 16, cuando depende de la reivindicación 15, en el que el marcador de glucosilación es una relación entre glucanos G0 y glucanos triple-G1.
18. Un método de acuerdo con una cualquiera de las reivindicaciones 13 a 16, que comprende además una etapa de segregar y/o amplificar el uno o más marcadores de glucosilación por digestión de los glucanos con una o más exoglucosidasas.
Patentes similares o relacionadas:
 PROTEÍNAS DE UNIÓN ARTIFICIALES BASADAS EN UNA REGIÓN DE HÉLICE ALFA MODIFICADA DE UBIQUITINA, del 16 de Mayo de 2011, de SCIL PROTEINS GMBH: Un método para la generación de una proteína seleccionada entre el grupo compuesto por proteínas de la superfamilia de proteínas de "proteínas tipo ubiquitina", así como fragmentos […]
PROTEÍNAS DE UNIÓN ARTIFICIALES BASADAS EN UNA REGIÓN DE HÉLICE ALFA MODIFICADA DE UBIQUITINA, del 16 de Mayo de 2011, de SCIL PROTEINS GMBH: Un método para la generación de una proteína seleccionada entre el grupo compuesto por proteínas de la superfamilia de proteínas de "proteínas tipo ubiquitina", así como fragmentos […]
 APARATO Y METODO INFORMATIZADO PARA PREDECIR LA SOLUBILIDAD O AGREGACION DE UN POLIPEPTIDO, del 24 de Junio de 2010, de CAMBRIDGE ENTERPRISE LIMITED: Un método de predicción implementado por ordenador para predecir el efecto de una modificación de aminoácidos sobre la velocidad de agregación (solubilidad) de un […]
APARATO Y METODO INFORMATIZADO PARA PREDECIR LA SOLUBILIDAD O AGREGACION DE UN POLIPEPTIDO, del 24 de Junio de 2010, de CAMBRIDGE ENTERPRISE LIMITED: Un método de predicción implementado por ordenador para predecir el efecto de una modificación de aminoácidos sobre la velocidad de agregación (solubilidad) de un […]
AGENTES DE ETIQUETADO DOBLE BASADOS EN VINILSULFONA, del 4 de Junio de 2010, de UNIVERSIDAD DE GRANADA: Agentes de etiquetado doble basados en vinilsulfona. Agentes de etiquetado que comprenden un compuesto con dos moléculas etiqueta y un grupo vinilsulfona. Además, […]
METODO PARA IDENTIFICAR LA PROTEINA DIANA DE UN AGENTE Y METODO PARA EXPLORAR UN AGENTE TERAPEUTICO PARA DIABETES USANDO LA PROTEINA DIANA, del 14 de Abril de 2010, de ASTELLAS PHARMA INC.: Un método para explorar un agente para tratar diabetes, que comprende [1] una etapa de permitir que un polipéptido que consiste en la secuencia de aminoácidos representada […]
UN PROCEDIMIENTO PARA LA CARACTERIZACION DE UNA LINEA CELULAR POLICLONAL, del 8 de Febrero de 2010, de SYMPHOGEN A/S: Un procedimiento para caracterizar una muestra de una línea celular policlonal que comprende células que producen diferentes proteínas homólogas conocidas que […]
 DETECCION DE PEPTIDOS, del 1 de Diciembre de 2009, de OXFORD GLYCOSCIENCES (UK) LIMITED: Un procedimiento para determinar la presencia de una o más proteínas de interés en una muestra, procedimiento que comprende:
a) someter la muestra a condiciones […]
DETECCION DE PEPTIDOS, del 1 de Diciembre de 2009, de OXFORD GLYCOSCIENCES (UK) LIMITED: Un procedimiento para determinar la presencia de una o más proteínas de interés en una muestra, procedimiento que comprende:
a) someter la muestra a condiciones […]
 METODO DE ANALISIS DE EXPRESION DIFERENCIAL EN CANCER COLORECTAL, del 16 de Junio de 2008, de ORYZON GENOMICS, S.A.: Método de análisis de expresión diferencial en cáncer colorectal.#La presente invención describe un método de análisis de expresión diferencial en cáncer colorectal […]
METODO DE ANALISIS DE EXPRESION DIFERENCIAL EN CANCER COLORECTAL, del 16 de Junio de 2008, de ORYZON GENOMICS, S.A.: Método de análisis de expresión diferencial en cáncer colorectal.#La presente invención describe un método de análisis de expresión diferencial en cáncer colorectal […]
MATRICES DE PROTEÍNA DE DOMINIOS VARIABLES DE INMUNOGLOBULINA DE CADENA PESADA DE CAMELIDAE, del 18 de Noviembre de 2011, de BAC IP B.V: Una matriz de proteína que comprende una pluralidad de dominios variables de cadena pesada derivados de una inmunoglobulina que está naturalmente desprovista de cadenas […]