ENZIMAS DE ADN ACTIVAS Y ESTABLES.
Enzima de ADN de tipo 10-23 que incluye, desde el extremo 5'' hacia el extremo 3'',
un primer brazo de reconocimiento de sustrato ("sección I"), una secuencia de núcleo catalítica ("sección II") y un segundo brazo de reconocimiento de sustrato ("sección III"), estando modificados químicamente en la sección II únicamente uno o más de los nucleótidos 2, 7, 8, 11, 14 y 15, y seleccionándose el o los nucleótidos modificados de entre el grupo consistente en nucleótidos de fosforotioato, timidina invertida, ribonucleótidos de 2''-O-metilo y ribonucleótidos de LNA
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2003/012413.
Solicitante: GRUNENTHAL GMBH.
Nacionalidad solicitante: Alemania.
Dirección: ZIEGLERSTRASSE 6,52078 AACHEN.
Inventor/es: KURRECK,JENS, SCHUBERT,STEFFEN, GRUNWELLER,ARNOLD, ERDMANN,VOLKER.
Fecha de Publicación: .
Fecha Concesión Europea: 13 de Enero de 2010.
Clasificación Internacional de Patentes:
- C12N15/113E
Clasificación PCT:
- A61K31/7088 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que tienen al menos tres nucleósidos o nucleótidos.
- C12N15/11 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A61K31/7088 A61K 31/00 […] › Compuestos que tienen al menos tres nucleósidos o nucleótidos.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Fragmento de la descripción:
Enzimas de ADN activas y estables.
La presente invención se refiere a enzimas de ADN de tipo 10-23 que, gracias a la modificación de determinados nucleótidos en su secuencia núcleo, son especialmente estables y además presentan una eficiencia de disociación frente a su sustrato esencialmente igual o mayor que la de las enzimas de ADN no modificadas correspondientes. Otros objetos de la presente invención se refieren a células huésped que contienen la enzima de ADN según la invención. También se propone un medicamento que contiene las enzimas de ADN o las células huésped según la invención. Las enzimas de ADN y los demás objetos están dirigidos principalmente contra el receptor vainilloide 1 (VR1) o picornavirus. Las células huésped son adecuadas como medicamentos o para la producción de medicamentos, en particular para el tratamiento del dolor y otros estados patológicos relacionados con el VR1.
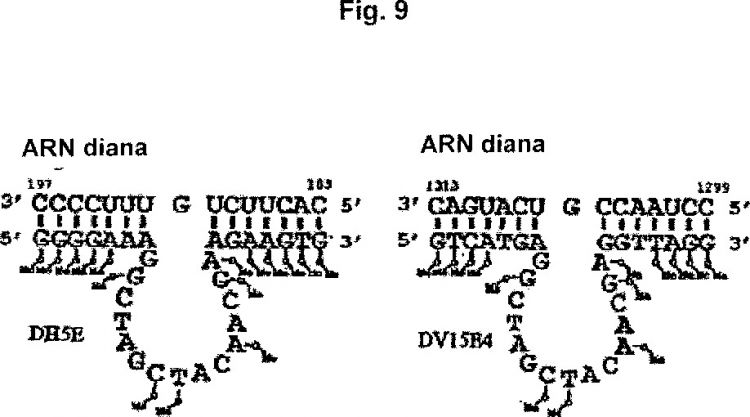
Las enzimas de ADN disociadoras de ARN se desarrollaron a partir de ribozimas cabeza de martillo mediante experimentos de selección in vitro. En comparación con las especies de ARN, las enzimas de ADN son más fáciles de producir y además son más estables, sobre todo en tejidos biológicos. La enzima de ADN conocida de mayor eficiencia de disociación y mayor flexibilidad de reconocimiento de sustrato en el estado actual de la técnica es la denominada enzima de ADN de tipo "10-23" (Santoro y Joice (1997) Proc. Natl. Acad. Sci. EE. UU. 94: 4262-4266). La enzima de ADN de tipo 10-23 contiene un dominio catalítico (secuencia núcleo) de 15 nucleótidos flanqueado por dos dominios o brazos de reconocimiento de sustrato, que incluyen en cada caso 7-10 nucleótidos (véase la Figura 1). La enzima de ADN de tipo 10-23 se une al sustrato de ARN mediante apareamiento de bases de acuerdo con las reglas de Watson-Crick a través de los brazos de reconocimiento de sustrato.
A pesar de la mayor estabilidad de las enzimas de ADN en comparación con las ribozimas, sobre todo para las aplicaciones in vivo, por ejemplo como medicamentos, es necesario estabilizar estas moléculas frente a ataques nucleolíticos.
Por ello, la presente invención tiene por objetivo, por una parte, proponer enzimas de ADN de tipo 10-23 que presenten una mayor estabilidad frente a la descomposición nucleolítica, siendo su actividad catalítica frente al sustrato de ARN correspondiente esencialmente igual, preferentemente mayor, que la de la enzima de ADN no estabilizada.
El tratamiento eficaz del dolor es uno de los grandes retos de la medicina molecular. El dolor agudo y transitorio es una importante señal del cuerpo para preservar a las personas contra daños graves producidos por el entorno o por una sobrecarga del cuerpo. En cambio, el dolor crónico, que perdura más que la causa del dolor y el tiempo previsible de curación, no tiene ninguna función biológica conocida. Cientos de millones de personas en todo el mundo padecen dolores crónicos. Sólo en la República Federal de Alemania, alrededor de 7,5 millones de personas sufren dolores crónicos. Actualmente, el tratamiento farmacológico, en particular del dolor crónico, es insatisfactorio. Con frecuencia, los analgésicos conocidos en el estado actual de la técnica no son lo suficientemente eficaces y, en parte, presentan graves efectos secundarios.
Por ello, a menudo se buscan nuevas dianas (targets), estructuras endógenas, con los que parezca posible lograr un efecto modulador del dolor, por ejemplo principios activos de bajo peso molecular u otros compuestos tales como oligodesoxirribonucleótidos (ODN) antisentido, principalmente para el tratamiento del dolor crónico. El receptor vainilloide 1 (VR1) (también denominado receptor de capsaicina) clonado por Caterina y col. (1997) es un punto de partida prometedor para el desarrollo de nuevos medicamentos contra el dolor. Este receptor consiste en un canal de cationes expresado predominantemente por neuronas sensoriales primarias (Catarina y col. (1997), supra). El VR1 es activado por la capsaicina, un componente de los chiles, por la temperatura (> 43ºC) y por un pH bajo (es decir, protones) debidos a lesiones tisulares y provoca una afluencia de calcio a las neuronas aferentes primarias. Los ratones "VR1-knockout" no desarrollan ninguna hiperalgesia térmica después de sufrir lesiones tisulares o inflamaciones (Caterina y col. (2000) Science 288: 306-313; Davis y col., (2000) Nature 405: 183-187).
En el documento WO 02/18407 se dan a conocer ODN antisentido y también enzimas de ADN de tipo 10-23 incluidas dentro de este concepto, que conducen a la disociación del ARNm de VR1.
Por ejemplo Sioud y col. (J. Mol. Biol. (2000), 296, 937-947) presentan enzimas de ADN de tipo 10-23 que contienen nucleótidos de fosforotioato en la secuencia núcleo catalítica y en los brazos de reconocimiento de sustrato. Sin embargo, Sioud y col. (2000) no describen ninguna enzima de ADN contra el receptor vainilloide 1 (VR1). Del mismo modo, Sioud y col. (2000) no presentan ningún tipo de aplicación de las enzimas de ADN en el tratamiento del dolor o de otros estados patológicos relacionados con el VR-1.
El documento WO 02/18407 describe oligonucleótidos antisentido contra el VR-1 y también la utilización de estos oligonucleótidos en la terapia del dolor. Sin embargo, el documento WO 02/18407 tampoco describe ninguna enzima de ADN contra el receptor vainilloide 1 (VR-1) ni trata en general de la utilización de enzimas de ADN en el tratamiento del dolor o de otros estados patológicos relacionados con el VR-1.
Además, Warashina y col. (Chemistry & Biology, abril de 1999, 6, 237-250) presentan enzimas de ADN de tipo 10-23 parcialmente modificadas que contienen nucleótidos de fosforotioato o nucleótidos de 2'-O-metilo en el extremo 5' y en el extremo 3'. Sin embargo, al igual que en el caso de Sioud y col. (2000), las enzimas de ADN de Warashina y col. (1999) sólo presentan una resistencia elevada contra nucleasas, pero no una actividad catalítica elevada. Warashina y col. (1999) tampoco describen ninguna enzima de ADN contra el receptor vainilloide 1 (VR-1), no muestra la utilización de enzimas de ADN en el tratamiento del dolor o de otros estados patológicos relacionados con el VR-1.
Por ello, la presente invención también tiene por objetivo proponer enzimas de ADN de tipo 10-23 que estén dirigidas contra el ARNm del receptor VR1 y que presenten una mayor estabilidad que los ODN dados a conocer en el estado actual de la técnica con una actividad catalítica comparable o superior.
Entre los picornavirus se encuentran agentes patógenos epidemiológicamente significativos, como rinovirus, numerosos enterovirus (entre otros ecovirus, los tres poliovirus, diferentes coxsackievirus), que provocan diferentes enfermedades, en particular en humanos, como resfriados (rinitis aguda) o inflamaciones crónicas graves de la cavidad nasofaríngea (rinopatías), poliomielitis, enfermedades cardíacas inflamatorias, meningitis vírica, etc. Por consiguiente, otro objetivo de la presente invención consiste en proponer enzimas de ADN de tipo 10-23 especialmente activas y estables contra los picornavirus.
Los objetivos arriba mencionados se resuelven mediante las formas de realización de la presente invención, caracterizadas en las reivindicaciones.
En particular se propone una enzima de ADN de tipo 10-23 (denominada en lo sucesivo "enzima de ADN") que incluye, desde el extremo 5' hacia el extremo 3', un primer brazo de reconocimiento de sustrato (en lo sucesivo "sección I"), una secuencia núcleo catalítica (en lo sucesivo "sección II") y un segundo brazo de reconocimiento de sustrato (en lo sucesivo "sección III"), estando modificados químicamente en la sección II únicamente uno o más de los nucleótidos 2, 7, 8, 11, 14 y 15 (que en total contiene preferentemente 15 nucleótidos), y seleccionándose el o los nucleótidos modificados de entre el grupo consistente en nucleótidos de fosforotioato, timidina invertida, ribonucleótidos de 2'-O-metilo y ribonucleótidos de LNA.
La presente invención se basa en la comprobación sorprendente de que se pueden introducir nucleótidos modificados químicamente de forma adecuada en enzimas de ADN, en particular enzimas de ADN contra VR1 o picornavirus, en la secuencia núcleo en las posiciones 2, 7, 8, 11, 14 y/o 15, y, como se describe más detalladamente más abajo, también se pueden introducir en los brazos de reconocimiento de sustrato (secciones I y III), en caso dado adaptando la longitud de estos brazos de reconocimiento de sustrato, para obtener así enzimas de ADN estabilizadas que...
Reivindicaciones:
1. Enzima de ADN de tipo 10-23 que incluye, desde el extremo 5' hacia el extremo 3', un primer brazo de reconocimiento de sustrato ("sección I"), una secuencia de núcleo catalítica ("sección II") y un segundo brazo de reconocimiento de sustrato ("sección III"), estando modificados químicamente en la sección II únicamente uno o más de los nucleótidos 2, 7, 8, 11, 14 y 15, y seleccionándose el o los nucleótidos modificados de entre el grupo consistente en nucleótidos de fosforotioato, timidina invertida, ribonucleótidos de 2'-O-metilo y ribonucleótidos de LNA.
2. Enzima de ADN según la reivindicación 1, caracterizada porque todos los nucleótidos 2, 7, 8, 11, 14 y 15 de la sección II están modificados.
3. Enzima de ADN según la reivindicación 1 ó 2, caracterizada porque uno o más de los nucleótidos de la sección I y/o la sección III están modificados.
4. Enzima de ADN según la reivindicación 3, caracterizada porque 3 a 5 nucleótidos de la sección I y/o de la sección III están modificados.
5. Enzima de ADN según la reivindicación 4, caracterizada porque los nucleótidos modificados se encuentran en el extremo 5' de la sección I y/o en el extremo 3' de la sección III.
6. Enzima de ADN según la reivindicación 4 ó 5, caracterizada porque los nucleótidos modificados de la sección I y/o de la sección III son ribonucleótidos de 2'-O-metilo o de LNA.
7. Enzima de ADN según una de las reivindicaciones 1 a 6, caracterizada porque la sección I y/o la sección III no incluyen más de 8 nucleótidos.
8. Enzima de ADN según la reivindicación 7, caracterizada porque la sección I y/o la sección III incluyen 7 nucleótidos.
9. Enzima de ADN según la reivindicación 3, caracterizada porque todos los nucleótidos de la sección I y/o de la sección III son nucleótidos de fosforotioato o ribonucleótidos de 2'-O-metilo.
10. Enzima de ADN según una de las reivindicaciones 3 a 9, caracterizada porque la temperatura de fusión de las cadenas dobles formadas entre las secciones I y III y la molécula diana oscila entre aproximadamente 33 y aproximadamente 42ºC.
11. Enzima de ADN según una de las reivindicaciones 1 a 10, caracterizada porque la sección II presenta la siguiente secuencia consenso desde el extremo 5' hacia el extremo 3':
GGMTMGH(N)DNNNMGD
siendo
M = A o C;
H = A, C o T;
D = G, A o T; y
N = cualquier base.
12. Enzima de ADN según una de las reivindicaciones 1 a 11, caracterizada porque está dirigida contra el ARNm del receptor vainilloide 1 (VR1).
13. Enzima de ADN según la reivindicación 12, caracterizada porque las secciones I y III presentan, desde el extremo 5' hacia el extremo 3', las siguientes secuencias o una secuencia diferente a éstas en un nucleótido, con la condición de que el nucleótido que difiere de las secuencias indicadas no se encuentre en una de las tres últimas posiciones de la sección I ni en una de las tres primeras posiciones de la sección III:



con N = cualquier base.
14. Célula huésped que contiene al menos una enzima de ADN según una de las reivindicaciones 1 a 13, caracterizada porque la célula huésped no es un gameto humano ni una célula madre embrionaria humana.
15. Célula huésped según la reivindicación 14, caracterizada porque consiste en una célula de mamífero.
16. Célula huésped según la reivindicación 15, caracterizada porque consiste en una célula humana.
17. Procedimiento ex vivo para la inhibición de la expresión de un gen, que incluye la introducción de al menos una enzima de ADN según una de las reivindicaciones 1 a 15 en una célula que expresa el gen.
18. Procedimiento ex vivo según la reivindicación 17, caracterizado porque el gen es el gen de VR1 y en la célula se introduce al menos una enzima de ADN según la reivindicación 12 ó 13.
19. Medicamento que contiene al menos una enzima de ADN según una de las reivindicaciones 1 a 13 y/o una célula huésped según una de las reivindicaciones 14 a 16, en caso dado en combinación con uno o más materiales soporte y/o vehículos farmacéuticamente compatibles.
20. Utilización de la enzima de ADN según la reivindicación 12 ó 13 o de la célula huésped según una de las reivindicaciones 14 a 16 para producir un medicamento para la prevención y/o el tratamiento del dolor, en particular del dolor crónico, alodinia táctil, dolor provocado térmicamente y/o dolor inflamatorio.
21. Utilización de la enzima de ADN según la reivindicación 12 ó 13 o de la célula huésped según una de las reivindicaciones 14 a 16 para producir un medicamento para la prevención y/o el tratamiento de síntomas neurógenos de la vejiga, incontinencia urinaria, trastornos de sensibilidad asociados con el VR1, inflamaciones asociadas con el VR1 y tumores asociados con el VR1.
Patentes similares o relacionadas:
INHIBIDORES SELECTIVOS DE LA EXPRESIÓN Y/O LA ACTIVIDAD DEL RECEPTOR CB2 PARA EL TRATAMIENTO DE LA OBESIDAD Y LOS TRASTORNOS RELACIONADOS CON LA OBESIDAD, del 13 de Febrero de 2012, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Inhibidor selectivo de la expresión del receptor CB2 seleccionado de entre el grupo constituido por moléculas de ADN o ARN antisentido, ARN inhibidores pequeños (ARNip) […]
CARBOHIDRATO U OLIGONUCLEOTIDOS MODIFICADOS EN POSICIÓN 2' QUE TIENEN ENLACES INTERNUCLEOSIDICOS ALTERNOS, del 7 de Diciembre de 2011, de ISIS PHARMACEUTICALS, INC.: Un compuesto que comprende una pluralidad de nucleósidos modificados en posición 2' unidos covalentemente que tienen la fórmula: en la que : cada […]
SIRNA Y SHRNA PARA LA ELABORACION DE MEDICAMENTOS FRENTE A LA PRESIONINTRAOCULAR ELEVADA, del 20 de Junio de 2011, de UNIVERSIDAD COMPLUTENSE DE MADRID: siRNA y shRNA para la elaboración de medicamentos frente a la presión intraocular elevada. La presente invención proporciona moléculas de siRNA y de shRNA para […]
 MODULACIÓN DE NIVELES DE EXPRESIÓN DE TRPV, del 11 de Mayo de 2011, de SYLENTIS S.A.U: Uso de una dosis farmacéuticamente eficaz de ANsi dirigido frente a TRPV1 en la preparación de un fármaco para su uso en el tratamiento de un estado ocular caracterizado […]
MODULACIÓN DE NIVELES DE EXPRESIÓN DE TRPV, del 11 de Mayo de 2011, de SYLENTIS S.A.U: Uso de una dosis farmacéuticamente eficaz de ANsi dirigido frente a TRPV1 en la preparación de un fármaco para su uso en el tratamiento de un estado ocular caracterizado […]
 OLIGORRIBONUCLEÓTIDOS PARA INFLUIR EN EL CRECIMIENTO DEL CABELLO, del 11 de Mayo de 2011, de BEIERSDORF AG: Oligorribonucleótidos, que inducen la degradación del mRNA de estructuras, que influyen de forma estimuladora en el ciclo del cabello, dichas estructuras forman parte […]
OLIGORRIBONUCLEÓTIDOS PARA INFLUIR EN EL CRECIMIENTO DEL CABELLO, del 11 de Mayo de 2011, de BEIERSDORF AG: Oligorribonucleótidos, que inducen la degradación del mRNA de estructuras, que influyen de forma estimuladora en el ciclo del cabello, dichas estructuras forman parte […]
 COMPUESTOS DE ARN DE DOBLE HEBRA ESPECIFICOS DE VGLUT, del 2 de Noviembre de 2010, de GRUNENTHAL GMBH: Moléculas de ARNsi específicas de VGLUT con una secuencia seleccionada entre **Fórmula**
COMPUESTOS DE ARN DE DOBLE HEBRA ESPECIFICOS DE VGLUT, del 2 de Noviembre de 2010, de GRUNENTHAL GMBH: Moléculas de ARNsi específicas de VGLUT con una secuencia seleccionada entre **Fórmula**
COMPOSICIONES Y METODOS PARA INHIBICION DE ANGIOGENESIS POR ARN-SI, del 10 de Junio de 2010, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un ácido ribonucleico de interferencia corto aislado (ARNsi) que comprende una cadena de ARN sentido de aproximadamente 19 a aproximadamente 25 nucleótidos […]
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]