Derivados de quinazolina como inhibidores de PARP.
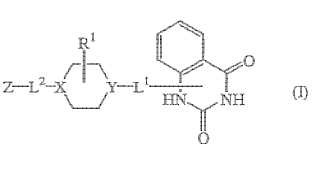
Un compuesto de fórmula (I) **Fórmula**
las formas de N-óxidos,
las sales por adición farmacéuticamente aceptables o sus formas estereoquímicamenteisómeras, en donde:
cada X es independientemente , o ; y cuando X es entonces Y es
cada Y es independientemente , o ; excepto cuando X es entonces Y es
L1 es un enlace directo o un radical bivalente seleccionado entre -alcanodiilo C1-6;
L2 es un enlace directo o un radical bivalente seleccionado entre carbonilo, alcanodiilo C1-6, -(hidroxi)-alcanodiilo C1-6,
-C(O)-alcanodiilo C1-6 o -alcanodiilo C1-6-C(O)-;
R1 es hidrógeno o hidroxi;
Z es hidrógeno o un radical seleccionado entre **Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/053031.
Solicitante: JANSSEN PHARMACEUTICA N.V..
Nacionalidad solicitante: Bélgica.
Dirección: TURNHOUTSEWEG 30 2340 BEERSE BELGICA.
Inventor/es: KENNIS, LUDO, EDMOND, JOSEPHINE, MERTENS, JOSEPHUS, CAROLUS, WOUTERS, WALTER, BOUDEWIJN, LEOPOLD, VAN DUN,Jacobus,Alphonsus,Josephus, SOMERS,Maria,Victorina,Francisca.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D401/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › directamente unidos por un enlace entre dos miembros cíclicos.
- C07D401/14 C07D 401/00 […] › que contienen tres o más heterociclos.
PDF original: ES-2415771_T3.pdf
Fragmento de la descripción:
Derivados de quinazolina como inhibidores de PARP
Campo de la invención La presente invención se refiere a inhibidores de PARP y proporciona compuestos y composiciones que contienen los compuestos descritos. Además de ello, la presente invención proporciona métodos para usar los inhibidores de PARP descritos, por ejemplo, en una medicina.
Antecedentes de la invención La enzima nuclear poli (ADE-ribosa) polimerasa-1 (PARP-1) es un miembro de la familia de enzimas PARP. Esta familia creciente de enzimas consiste en PARPs como, por ejemplo: PARP-1, PARP-2, PARP-3 y Vault-PARP y
tankirasas (TANKs) , por ejemplo: TANK-1, TANK-2 y TANK-3. La PARP se denomina también poli (adenosino-5’difosfo-ribosa) polimerasa o PARS (poli (ADP-ribosa) sintetasa) .
Las tankirasas (TANKs) fueron identificadas como componentes del complejo telómero humano. Se ha propuesto que tienen una función en el tránsito en la vesícula y pueden servir como pasarelas para proteínas involucradas en otros diversos procesos celulares. Los telómeros, que son esenciales para el mantenimiento y la estabilidad de los cromosomas, son mantenidos por la teloinerasa, una transcriptasa inversa especializada. Las TANKs son (ADP ribosa) transferasas con algunas características de las proteínas señalizadoras y citoesqueléticas. Contienen el dominio de PARP, que cataliza la poli-ADP-ribosilación de proteínas de sustratos, el resto alfa estéril, que es compartido con ciertas moléculas señalizadoras y el dominio ANK, que contiene 24 homólogos repetidos de anquirina para la anquirina de las proteínas citoesqueléticas. El dominio ANK interacciona con una proteína telómera, factor 1 de unión repetida a telómeros (TRF-1) . Por lo tanto, estas proteínas fueron denominadas ADPribosa polimerasa relacionadas con anquirina que interaccionan con TRF1 (TANKs) .
Una de las funciones más específicas de la TANK es la ADP-ribosilación de TRF-1. La función telómera humana necesita dos proteínas de unión a DNA específicas para telómeros, TRF-1 y TRF-2. La TRF-2 protege algunos extremos de cromosomas y la TRF-1 regula la longitud del telómero. La ADP-ribosilación inhibe la capacidad de la TRF-1 para unirse a DNA telómero. Esta poli-ADP-ribosilación de TRF-1 libera TRF-1 de los telómeros, abriendo el complejo telómero y permite el acceso a telomerasa. Por lo tanto, la TANK funciona como un regulador positivo de la longitud del telómero, permitiendo el alargamiento de telómeros por la telomerasa.
La PARP-1 es una proteína nuclear principal de 116 kDa que consiste en tres dominios: el dominio de unión a DNA N-terminal que contiene dos dedos de zinc, el dominio de auto-modificación y el dominio catalítico C-terminal. Está presente en casi todos los eucariotas. La enzima sintetiza poli (ADP-ribosa) , un polímero ramificado que consiste en más de 200 unidades de ADP-ribosa. Los aceptores de proteínas de poli (ADP-ribosa) están directa o indirectamente involucrados en el mantenimiento de la integridad del DNA. Incluyen histonas, topoisomerasas, DNA y RNA polimerasas, DNA ligasas y endonucleasas dependientes de Ca2+ y Mg2+. La proteína de PARP es expresada a un nivel elevado en muchos tejidos, lo más apreciablemente en el sistema inmune y células del corazón, cerebro y células de líneas germinales. Bajo condiciones fisiológicas normales, hay una actividad mínima de PARP. Sin embargo, el deterioro del DNA provoca una activación inmediata de PARP en hasta 500 veces.
Entre las muchas funciones atribuidas a la PARP, y especialmente a la PARP-1, está su función principal para facilitar la reparación de DNA mediante ADP-ribosilación y, por tanto, la coordinación de un cierto número de proteínas para reparar DNA. Como consecuencia de la activación de PARP, disminuyen significativamente los niveles de NAD+. La activación extensiva de PARP conduce a un agotamiento grave de NAD+ en células que sufren un deterioro masivo de DNA. La semi-vida corta de la poli (ADP-ribosa) , da lugar a una elevada velocidad de transformación. Una vez que se forma la poli (ADP-ribosa) , es rápidamente degradada por la poli (ADP-ribosa) glicohidrolasa (PARG) constitutivamente activa, junto con la fosfodiesterasa y (ADP-ribosa) proteína liasa. La PARP y la PARG forman un ciclo que convierte una gran cantidad de NAD+ en ADP-ribosa. En menos de una hora, la sobre-estimulación de PARP puede provocar una caída de NAD+ y ATP hasta menos de 20% del nivel normal. Esta 55 situación es especialmente perjudicial durante una isquemia, cuando la ausencia de oxígeno ya ha comprometido considerablemente la producción de energía celular. La posterior producción de radicales libres durante la reperfusión se supone que es una causa principal del deterioro de tejidos. Parte de la caída de ATP, que es típica de muchos órganos durante la isquemia y reperfusión, podría estas asociada al agotamiento de NAD+ debido a la transformación de poli (ADP-ribosa) . Por tanto, la inhibición de PARP o PARG se espera que mantenga el nivel de energía celular, potenciando así la supervivencia de tejidos isquémicos después del ataque.
La síntesis de poli (ADP-ribosa está involucrada también en la expresión inducida de un cierto número de genes esenciales para una respuesta inflamatoria. Los inhibidores de PARP suprimen la producción de sintasa de óxido nítrico inducible (iNOS) en macrófagos, selectina de tipo P y molécula 1 de adhesión intercelular (ICAM-1) en células 65 endoteliales. Esta actividad sirve de apoyo a los fuertes efectos de anti-inflamación mostrados por los inhibidores de PARP. La inhibición de PARP es capaz también de reducir la necrosis evitando la translocación e infiltración de neutrófilos a los tejidos lesionados.
La PARP es activada por fragmentos de DNA deteriorado y, una vez activada, cataliza la unión de hasta 100 unidades de ADP-ribosa a una diversidad de proteínas nucleares, que incluyen histonas y la propia PARP. Durante las tensiones celulares principales, la activación extensiva de PARP puede conducir fácilmente a un deterioro o muerte celular a través del agotamiento de las reservas de energía. Como son consumidas cuatro moléculas de ATP por cada molécula de NAD+ regenerada, la NAD+ es agotada por la activación masiva de PARP, en los esfuerzos para volver a sintetizar NAD+, la ATP puede resultar también agotada.
Se ha descrito que la activación de PARP desempeña una función clave en la neurotoxicidad inducida por NMDA y NO . Esto se ha demostrado en cultivos corticales y en corte hipocampales en los que la prevención de la toxicidad está directamente correlacionada con la potencia de inhibición de PARP. La función potencial de los inhibidores de PARP para tratar enfermedades neurodegenerativas y traumas craneales ha sido por tanto reconocida incluso aunque el mecanismo de acción exacto todavía no ha sido dilucidado.
Análogamente, se ha demostrado que las inyecciones únicas de inhibidores de PARP redujo el tamaño del infarto provocado por la isquemia y la reperfusión del músculo cardíaco o esquelético en conejos. En estos estudios, una inyección única de 3-amino-benzamida (10 mg/kg) , sola o un minuto antes de la oclusión o un minuto antes de la reperfusión, provocó reducciones similares en el tamaño del infarto en el corazón (32-42%) mientras que la 1, 5dihidroxiisoquinolina (1 mg/kg) , otro inhibidor de PARP, redujo el tamaño del infarto en un grado comparable (3848%) . Estos resultados hacen que sea razonable suponer que los inhibidores de PARP podrían salvar un corazón previamente isquémico o una lesión por reperfusión de tejido muscular esquelético.
La activación de PARP puede ser usada también como una medida del deterioro que sigue a agresiones neurotóxicas que resultan de una exposición a cualquiera de los siguientes inductores como glutamato (a través de estimulación de receptores de NMDA) , intermedios de oxígeno reactivos, º-proteína amiloide, N-metil-4-fenil-1, 2, 3, 6tetrahidropiridina (MPTP) o su metabolito activo N-metil-4-fenilpiridina (MPP+) que participan en estados patológicos como apoplejía, enfermedad de Alzheimer o enfermedad de Parkinson. Otros estudios han continuado explorando la función de la activación de PARP en células de gránulos cerebelosos in vitro y en la neurotoxicidad de MPTP. La exposición neuronal excesiva al glutamato, que sirve como neurotransmisor predominante del sistema nervioso central y actúa sobre los receptores de N-metil-D-aspartato (NMDA) y otros receptores de subtipos, se produce lo más frecuentemente como consecuencia de una apoplejía u otros procesos neurodegenerativos. Las neuronas desprovistas de oxígeno liberan glutamato en grandes cantidades durante un ataque cerebral isquémico, como durante una apoplejía... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de fórmula (I)
las formas de N-óxidos, las sales por adición farmacéuticamente aceptables o sus formas estereoquímicamente isómeras, en donde:
cada X es independientemente , o ; y cuando X es entonces Y es cada Y es independientemente , o ; excepto cuando X es entonces Y es L1 es un enlace directo o un radical bivalente seleccionado entre -alcanodiilo C1-6; L2 es un enlace directo o un radical bivalente seleccionado entre carbonilo, alcanodiilo C1-6, - (hidroxi) -alcanodiilo C1-6,
-C (O) -alcanodiilo C1-6 o -alcanodiilo C1-6-C (O) -; R1 es hidrógeno o hidroxi;
en que cada R2 se selecciona independientemente entre hidrógeno, halo o alquilo C1-6; con la condición de que el resto quinazolinodiona está unido al resto de la molécula en el resto -NH- en la posición 1, en cuyo caso el átomo de hidrógeno está sustituido; y con la condición de que no están incluidos 1-[1-[ (2S) -2-
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Formas en estado sólido de sales de Nilotinib, del 15 de Julio de 2020, de PLIVA HRVATSKA D.O.O: Una forma cristalina de fumarato de Nilotinib designada como Forma III, caracterizada por datos seleccionados de uno o más de los siguientes: a. un patrón de […]
Inhibidores de Bcl-2/Bcl-xL y su uso en el tratamiento de cáncer, del 15 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF MICHIGAN: Compuesto que tiene una estructura **(Ver fórmula)**
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]