Procedimiento para cuantificar la presencia de un antígeno de Helicobacter pylori en una muestra biológica de origen fecal y kit para cuantificar la presencia de dicho antígeno mediante dicho método.
Procedimiento para cuantificar la presencia de un antígeno de helicobacter pylori en una muestra biológica de origen fecal y kit para cuantificar la presencia de dicho antígeno mediante dicho método.
El procedimiento comprende las etapas de; a) dispersar una muestra de heces en una solución de extracción de dicho antígeno (3), b) diluir una cantidad predeterminada de la dispersión de la etapa a) en una solución diluyente que comprende un compuesto potenciador que incluye polivinil pirrolidona, c) añadir una cantidad predeterminada de una suspensión de reactivo a la dilución de la etapa b) para obtener una mezcla, comprendiendo dicha suspensión de reactivo una dispersión de partículas (1) de látex que están unidas a un anticuerpo (2) monoclonal específico contra dicho antígeno (3), d) detectar en la mezcla de la etapa c) una señal resultante de la formación de un inmunocomplejo (7) antígeno (3)-anticuerpo (2) sobre las mencionadas partículas (1) de látex, potenciando dicho compuesto potenciador la formación de dicho inmunocomplejo (7) sobre dichas partículas (1), e) determinar la concentración de antígeno (3) de dicha muestra de heces.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201331209.
Solicitante: LINEAR CHEMICALS, S.L.
Nacionalidad solicitante: España.
Inventor/es: RODRIGUEZ LOPEZ,MANUEL, MENDOZA VILASECA,Carlos, CAPDEVILA MORAGAS,Mª José.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/546 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › bajo forma de partículas que pueden ser puestas en suspensión en el agua.
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
Fragmento de la descripción:
PROCEDIMIENTO PARA CUANTIFICAR LA PRESENCIA DE UN ANTÍGENO DE HEUCOBACTER PYLORI EN UNA MUESTRA BIOLÓGICA DE ORIGEN FECAL Y KIT 5 PARA CUANTIFICAR LA PRESENCIA DE DICHO ANTÍGENO MEDIANTE DICHO
MÉTODO
La presente invención se refiere a un procedimiento y a un kit para implementar dicho procedimiento que permite cuantificar la presencia de un antígeno de Helicobacter pylorí en ío una muestra biológica de origen fecal, como por ejemplo, una muestra de heces humanas.
Antecedentes de la invención
Helicobacter pylorí es una bacteria que reside en la parte superior del tracto gastrointestinal 15 del ser humano y está implicada en trastornos gastrointestinales como úlceras pépticas, gastritis, y otras enfermedades que finalmente pueden derivar a cáncer de estómago.
La detección y el diagnóstico de la infección por Helicobacter pylorí Ag se puede llevar a cabo mediante técnicas invasivas y no invasivas.
Las técnicas invasivas se basan en biopsias gástricas (supone una pequeña intervención al 20 paciente con el objetivo de obtener una muestra gástrica) y cultivo posterior de las muestras, examen histológico, prueba de la ureasa o métodos de PCR. Todas ellas muestran la presencia del microorganismo de forma directa o indirecta. Aunque desde el punto de vista diagnóstico, estas técnicas pueden ser métodos suficientemente sensibles y específicos, la dificultad de la obtención de la muestra, la incomodidad para el paciente (hay que practicar 25 endoscopia), el tiempo necesario y el coste del método, dificultan en gran medida el uso de estas técnicas. Además, a diferencia de otros microorganismos fecales que pueden cultivarse fácilmente en medios de cultivo ordinarios, en el caso de Helicobacter pylorí, este cultivo presenta ciertas dificultades y el microorganismo tiene la capacidad de mutar a formas morfológicas distintas, por lo que es preferible que acudir a otras formas más 30 sencillas de detección del microorganismo.
Entre las técnicas no-invasivas se encuentra la técnicas EIA o técnicas de enzymainmunoensayo que ofrecen la posibilidad de detectar antígenos o anticuerpos de H. pylorí o Hp que genera el cuerpo del paciente debido a la infección. Las técnicas EIA que detectan anticuerpos anti-H. pylorí emplean antígenos de H. pylorí. Sin embargo, se ha
observado que algunos de los antígenos mayoritarios de H. pylori utilizados en los inmunoensayos EIA son comunes a otras bacterias del mismo grupo que H. pylori, como Campylobacter jeuni y Campylobacter coli, por lo que pueden resultar reacciones inespecíficas. Otro de los problemas de utilizar el antígeno como elemento reactivo de los 5 inmunoensayos para detectar el anticuerpo, es la variabilidad de cepas de este microorganismo que conlleva una gran variación antigénica, por lo que para que el ensayo sea lo suficientemente sensible y específico se precisa utilizar mezclas antigénicas constituidas por diferentes fragmentos de antígenos Helicobacter pylori. Además, los métodos que detectan anticuerpo ar\t\-Helicobacter pylori, son sólo indicativos de la ío respuesta del paciente frente a la infección, por lo que habiendo eliminado el antígeno (paciente curado) puede ser que el título (concentración de anticuerpos en sangre) sea todavía elevado, cosa que sucede normalmente, ya que el anticuerpo se mantiene algún tiempo después de haberse eliminado la infección (en muchos casos después de 6 meses). Por este motivo, los métodos que detectan anticuerpos son sólo válidos en el estudio de la 15 evolución de la enfermedad, siendo necesario, en la mayoría de casos que se observa un título elevado de anticuerpos ar\i\-Helicobacter pylori, un ensayo invasivo (biopsia) para confirmar el diagnostico.
Los métodos que detectan el antígeno son mejores que los que detectan anticuerpos, puesto que suministran una información real del estado de la infección. La presencia del 20 antígeno en la muestra fecal, significa que la infección persiste.
Entre los métodos que detectan el antígeno de H. pylori en heces, se encuentran métodos cualitativos o de "screening" y métodos cuantitativos. Entre cualitativos destacan los métodos inmunocromatográficos, cuyos resultados muestran la presencia o ausencia del antígeno, con tiempos de ensayo de unos 10-15 min. Los métodos EIA, cuyos tiempos de 25 ensayo son próximos a las 2 horas y precisan instrumentación apropiada, detectan la presencia de antígeno de forma cualitativa y cuantitativa. Sin embargo, estos métodos EIA son bastante más costosos que los anteriores, aunque son mejores en cuanto a sensibilidad y especificidad.
Descripción de la invención
El objetivo de presente invención es el de resolver los inconvenientes mencionados proporcionando un procedimiento y kit para cuantificar la presencia de un antígeno de Helicobacter pylori en un rango de concentraciones del orden de pig/L (ng/mL) que presenta
la ventaja de ser rápido, automatizadle y fácil de usar.
De acuerdo con este objetivo, según un primer aspecto, la presente invención proporciona un procedimiento para cuantificar la presencia de un antígeno de Helicobacter pylori en una muestra biológica de origen fecal que comprende las etapas de;
a) dispersar la muestra de heces en una solución de extracción de dicho antígeno,
b) diluir una cantidad predeterminada de la dispersión de la etapa a) en una solución diluyente que comprende un compuesto potenciador que incluye polivinil pirrolidona,
c) añadir una cantidad predeterminada de una suspensión de reactivo a la dilución de la etapa b) para obtener una mezcla, comprendiendo dicha suspensión de reactivo una dispersión de partículas de látex que están unidas a un anticuerpo monoclonal específico contra dicho antígeno,
d) detectar en la mezcla de la etapa c) una señal resultante de la formación de un inmunocomplejo antígeno-anticuerpo sobre las mencionadas partículas de látex, potenciando dicho compuesto potenciador la formación de dicho inmunocomplejo sobre dichas partículas, y
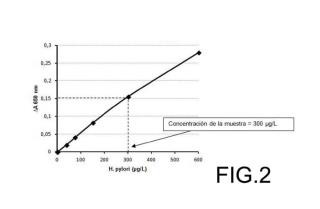
e) determinar la concentración de antígeno de dicha muestra de heces mediante una curva de calibración que correlaciona dicha señal con la concentración de antígeno de Helicobacter pylori.
De acuerdo con el mismo objetivo, según un segundo aspecto, la presente invención proporciona un Kit para cuantificar la presencia de un antígeno de Helicobacter pylori en una muestra biológica de origen fecal, que se caracteriza por el hecho de que comprende;
- una solución diluyente para diluir una cantidad predeterminada de muestra dispersa en una solución de extracción de dicho antígeno, comprendiendo dicha solución un compuesto potenciador que incluye polivinil pirrolidona, y una suspensión de reactivo para añadir a dicha solución diluyente al objeto de obtener una mezcla, comprendiendo dicha suspensión de reactivo una pluralidad de partículas de látex que están unidas a un anticuerpo monoclonal anti-Hp específico contra dicho antígeno, siendo susceptible de potenciar dicho compuesto potenciador la formación de inmunocomplejos antígeno-anticuerpo sobre dichas partículas de látex.
Opcionalmente, este kit puede comprender un tubo de toma de muestras con una cavidad
para depositar la muestra que está provista de una solución de extracción de dicho antígeno. Esta solución de extracción está formulada para evitar las reacciones cruzadas con otros microorganismos fecales y, preferiblemente, comprende un compuesto diluyente seleccionado entre un tampón fosfato, un tampón glicina, un tampón borato y un tampón tris, una sustancia estabilizadora de dicho antígeno seleccionada entre una albúmina bovina, un suero fetal bovino, una caseína, una gelatina, un glicerol y un suero de caballo.
El procedimiento de la presente invención presenta la ventaja de que permite cuantificar de un modo muy rápido y eficiente una baja concentración de Helicobacter pylori de una muestra fecal de heces humanas, en un orden de magnitud de mg/L o ng/mL.
Se ha observado que la adición del mencionado compuesto potenciador en la solución diluyente favorece e incrementa la unión del antígeno disperso presente en la muestra fecal con los complejos anticuerpo-partícula de látex. Esto se traduce en un incremento de la avidez de la formación del inmunocomplejos y en consecuencia un aumento significativo de la sensibilidad del ensayo.
Gracias a todo ello, el procedimiento de la presente invención permite cuantificar concentraciones de Helicobacter pylori en un orden de magnitud de mg/L o ng/mL, y en un tiempo de reacción muy corto, del orden de unos minutos. De este modo se proporciona un procedimiento de cuantificación alternativo a los existentes que permite...
Reivindicaciones:
1. Procedimiento para cuantificar la presencia de un antígeno (3) de Helicobacter pylori en una muestra biológica de origen fecal que comprende las etapas de;
a) dispersar una muestra de heces en una solución de extracción de dicho antígeno (3),
b) diluir una cantidad predeterminada de la dispersión de la etapa a) en una solución diluyente que comprende un compuesto potenciador que incluye polivinil pirrolidona,
c) añadir una cantidad predeterminada de una suspensión de reactivo a la dilución de la etapa b) para obtener una mezcla, comprendiendo dicha suspensión de reactivo una dispersión de partículas (1) de látex que están unidas a un anticuerpo (2) monoclonal específico contra dicho antígeno (3),
d) detectar en la mezcla de la etapa c) una señal resultante de la formación de un inmunocomplejo (7) antígeno (3)-anticuerpo (2) sobre las mencionadas partículas (1) de látex, potenciando dicho compuesto potenciador la formación de dicho inmunocomplejo (7) sobre dichas partículas (1), y
e) determinar la concentración de antígeno (3) de dicha muestra de heces mediante una curva de calibración que correlaciona dicha señal con la concentración de antígeno (3) de Helicobacter pylori.
2. Procedimiento según la reivindicación 1, en el que dicho compuesto potenciador está presente en la solución diluyente de la etapa b) en una concentración comprendida entre 1 g/L y 15 g/L.
3. Procedimiento según la reivindicación 1, donde, en la etapa b), el compuesto potenciador de la solución diluyente comprende polivinil pirrolidona de peso molecular igual o superior a 50.000 Da.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dicha solución
diluyente de la etapa b) incluye además,
- un compuesto diluyente seleccionado entre un tampón fosfato, un tampón glicina, un tampón borato y un tampón tris.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que, en la etapa d), dicha señal es un incremento de absorbancia de dicha mezcla producido por la formación de dicho inmunocomplejo (7) después de un tiempo de incubación (T), siendo susceptible dicho incremento de absorbancia de ser medido mediante un instrumento espectrofotómetro o similar.
6. Procedimiento según la reivindicación 5, en el que dicho incremento de absorbancia se lleva a cabo después de un tiempo de incubación (T) igual o inferior a 12 minutos.
7. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que dichas partículas (1) de látex que están unidas a dicho anticuerpo (2) monoclonal anti- Helicobacter pylori están presentes en la suspensión de reactivo de la etapa d) en un porcentaje en peso comprendido entre 0,05% y 0,5%.
8. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que dichas partículas de látex (1) son de un tamaño comprendido entre 70 nm y 350 nm.
9. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que, en la etapa a), la dispersión de la muestra de heces fecales se lleva a cabo en una solución de extracción de dicho antígeno (3) que está contenida en un tubo de toma de muestra de dichas heces.
10. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que, en la etapa a), dicha solución de extracción comprende;
- un compuesto diluyente seleccionado entre un tampón fosfato, un tampón glicina, un tampón borato y un tampón tris, y
- una sustancia estabilizadora de dicho antígeno seleccionada entre albúmina bovina (BSA), suero fetal bovino, caseína, gelatina y suero de caballo, suero de cabra y glicerol.
11. Kit para cuantificar la presencia de un antígeno (3) de Helicobacter pylori en una muestra biológica de origen fecal según el procedimiento de las reivindicaciones 1 a 10, caracterizado por el hecho de que comprende;
- una solución diluyente para diluir una cantidad predeterminada de muestra
dispersa en una solución de extracción de dicho antígeno (3), comprendiendo dicha solución un compuesto potenciador que incluye polivinil pirrolidona, y - una suspensión de reactivo para añadir a dicha solución diluyente al objeto de obtener una mezcla, comprendiendo dicha suspensión de reactivo una pluralidad de partículas (1) de látex que están unidas a un anticuerpo (2) monoclonal específico contra dicho antígeno (3), siendo susceptible de potenciar dicho compuesto potenciador la formación de un inmunocomplejo (7) antígeno (3)-anticuerpo (2) sobre dichas partículas (1) de látex.
12. Kit según la reivindicación 11, que comprende un tubo de toma de dicha muestra, incluyendo dicho tubo una cavidad provista de una solución de extracción de dicho antígeno (3).
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]
Bebidas energéticas y otras ayudas nutricionales derivadas de licores a base de agave, del 1 de Julio de 2020, de Roar Holding, LLC: Una composición que comprende compuestos inhibidores de monoamino oxidasa (MAO), cuya composición se prepara mediante la eliminación de etanol de una bebida […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Marcadores celulares para el diagnóstico de la enfermedad de Alzheimer y para la progresión de la enfermedad de Alzheimer, del 17 de Junio de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un método para el diagnóstico de la probabilidad de la enfermedad de Alzheimer (EA) en un individuo examinado, que comprende: (i) medir los […]
Biomarcadores de TB, del 22 de Abril de 2020, de United Kingdom Research and Innovation: Un método para el diagnóstico de TB en un sujeto, comprendiendo el método: (a) proporcionar una muestra de dicho sujeto, siendo dicha muestra seleccionada […]
Procedimiento para detectar bacterias coliformes contenidas en la leche, del 15 de Abril de 2020, de ASAHI KASEI KABUSHIKI KAISHA: Procedimiento para lisar bacterias coliformes contenidas en la leche, que comprende la etapa de mezclar un agente de lisis que contiene lisozima, un surfactante aniónico […]