CONSTRUCTOS DE FUSION, QUE CONTIENEN SECCIONES ACTIVAS DE LIGANDOS TNF.
Proteína de fusión recombinante, que contiene una secuencia de aminoácidos,
que comprende: (a) en la sección de la proteína de fusión situada por el extremo N-terminal, la sección Fc de una inmunoglobulina o una parte de una sección Fc de una inmunoglobulina que mantiene su capacidad de dimerización como componente (A), (b) en la sección de la proteína de fusión más C-terminal la parte extracelular de un ligando TNF o una secuencia parcial de la parte extracelular de un ligando TNF como componente (B) y, si se desea, una zona de transición entre el componente (A) y el componente (B), que contiene un ligador,
caracterizada porque, el componente (B) es la parte extracelular del ligando TNF EDA1 o una secuencia parcial de la parte extracelular del ligando TNF EDA1 que presenta por lo menos la secuencia de aminoácidos 246 a 391 de la secuencia nativa de EDA1
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP02/09354.
Solicitante: TOPOTARGET SWITZERLAND SA.
Nacionalidad solicitante: Suiza.
Dirección: AVENUE DE SEVELIN 18-20,1004 LAUSANNE.
Inventor/es: SCHNEIDER, PASCAL, TSCHOPP, JURG, GAIDE,OLIVER.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/705R
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K19/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
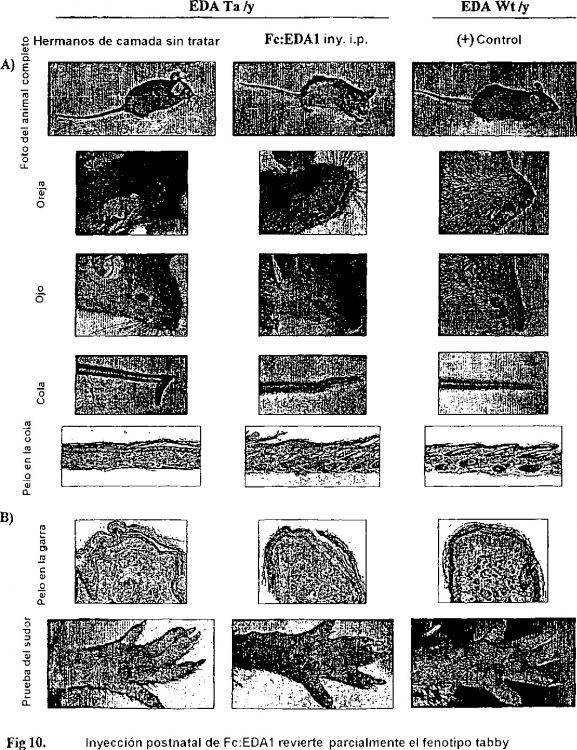
Fragmento de la descripción:
Constructos de fusión, que contienen secciones activas de ligandos TNF.
En el estado de la técnica, se conocen un gran número de receptores que pertenecen a la clase de los receptores de TNF y que cada uno interactúa con por lo menos un ligando TNF como ligando fisiológico. Los receptores de la familia de receptores de TNF son proteínas de membrana del tipo I (Nagata et al, Science, 267: 1449, 1995). Un ejemplo de un sistema de receptor de TNF/ligando TNF bien investigado es el receptor Fas (Fas, FasR, CD95), que entra en interacción con el ligando natural Fas y por ese camino dispara una señal intracelular. En particular, se ha investigado detalladamente la importancia del sistema FasL/FasR para la muerte celular específica de la célula. El ligando Fas de la rata (Suda et al, Cell 75. 1169, 1993; Lynch et al, Immunity 1: 131, 1994) y la forma humana (Takahashi et al, International Immunology 6: 1567, 1994) se han clonado a nivel de ADNc. Como miembro de la familia de los ligandos TNF, FasL pertenece a la categoría de las proteínas de membrana del tipo II, es decir, FasL presenta un dominio carboxi-terminal extracelular y un dominio amino-terminal intracelular. A la familia de los ligandos TNF pertenecen también, por ejemplo, las proteínas TNFa (factor de necrosis tumoral a) o TNFß (factor de necrosis tumoral ß, Eck et al, Journal of Biological Chemistry 264: 17595, 1989). Cada ligando TNF se une a su receptor de TNF fisiológico. Entre los otros ejemplos de ligandos de este tipo del estado de la técnica, se incluyen OX40L (se une a OX40R), CD27L (se une a CD27R), CD30L (se une a CD30R), RANKL (se une a RANK-R), CD40L (se une a CD40R), TRAIL (se une a TRAIL-R1, R2, R3 o R4) o TWEAK (se une a Fn14).
Sin embargo, las formas nativas de los ligandos de la familia de proteínas de membrana del tipo II no son aptas como tales para ser utilizadas en la medicina. Como proteínas de membrana, no pueden administrarse como tales, en particular también debido al dominio transmembrana hidrófobo. Por tanto, en el estado de la técnica, se ha intentado poner a disposición fragmentos de ligandos TNF que todavía podrían presentar una actividad fisiológica, pero sin presentar las secciones intracelulares o el dominio transmembrana. Por ejemplo, se han realizado experimentos in vitro e in vivo con fragmentos de FasL que presentaban exclusivamente zonas de los dominios FasL dispuestas en su forma nativa en la parte extracelular (sFasL, "soluble FasL", FasL soluble). Sin embargo, los fragmentos de proteína de este tipo han podido cumplir la función fisiológica de los ligandos, en particular en el caso de FasL, sólo de forma insuficiente, observándose en parte incluso efectos inversos no deseados del dominio de FasL soluble extracelular frente a la proteína transmembrana FasL, que en las condiciones fisiológicas estaba presente en su forma activa obviamente como trímero.
En la patente US nº 6 316 256, se han descrito proteínas de fusión que contienen una parte de un ligando FasL así como una región Fc. En la patente US nº 6.046.310 se han descrito también proteínas de fusión con un ligando Fc:Fas. Bulfone-Paus et al. (Transplantation, 2000, 7: 1386-1391) han descrito una proteína de fusión con un ligando IL-2-IgG-Fas. Fanslow et al. (Seminars in Immunology, 1994, 5: 267-278) han descrito una proteína de fusión CD40L-Fc. Baum et al. (EMBO J., 1994, 13: 3992-4001) ha descrito una proteína de fusión murina OX40L-Fc. En el documento WO 01/83525, se han descrito proteínas de fusión que contienen una sección Fc y una sección de un ligando de la familia TNF. En el documento WO01/49866, se han descrito proteínas de fusión que contienen una sección de una TNF-citoquina y una sección multimerizante de una proteína seleccionada del grupo constituido por la familia de proteínas C1q y de las collectinas. Holler et al. ha descrito proteínas de fusión Fas:COMP y CD40:COMP.
Los documentos citados anteriormente no describen ninguna proteína de fusión según la reivindicación 1 de la presente solicitud de patente.
Por tanto, el objetivo de la presente invención es proporcionar secuencias que no sólo imiten y reproduzcan los efectos fisiológicos de los ligandos TNF, sino también sean solubles y, por tanto, aptas para ser utilizadas como agente farmacéutico, en particular también para la preparación de un medicamento.
Según la invención, se proporcionan constructos de fusión, es decir, tanto secuencias de nucleótidos como las secuencias de proteínas derivadas a partir de las mismas, que permiten en particular también eliminar el fenotipo de las enfermedades causadas por factores genéticos. Los constructos de fusión del tipo según la invención presentan una estructura según la reivindicación 1. La sección de inmunoglobulina (Ig) situada en el constructo de fusión en el extremo N-terminal, es decir, el componente (A), no presenta, según la invención, la región variable característica de las inmunoglobulinas, que es responsable del reconocimiento de antígenos, sino exclusivamente dominios o secciones de dominios de la región constante de las inmunoglobulinas, por ejemplo el dominio o los dominios de CH1, CH2 y/o CH3. Por tanto, según la invención, las secciones de los dominios CH citados anteriormente pueden unirse según la invención entre sí como componente (A), es decir, por ejemplo el dominio CH1 y el dominio CH3, con lo cual el componente (A), al ser utilizado según la invención para la preparación de un medicamento para el tratamiento en útero, no debería perder su capacidad de unirse a los receptores Fc fisiológicos. En caso de ser utilizado para la preparación de un medicamento para el tratamiento postnatal, la situación puede ser tal que fuese ventajoso si los constructos según la invención no se uniesen a los receptores Fc. Por tanto, al ser utilizado para la preparación de un medicamento destinado a la terapia postnatal, puede ser preferible si el componente (A) precisamente ya no presenta la propiedad de unirse funcionalmente a los receptores Fc. Una pérdida de funcionalidad de este tipo puede conseguirse, por ejemplo, por inserción, deleción o sustitución de las secuencias Fc funcionales.
La secuencia de inmunoglobulina presente en el constructo de fusión según la invención como componente (A) y constituida por la región Fc es capaz de dimerizar con otro constructo de fusión. Preferentemente, el componente (A) es capaz de dimerizar con un constructo de fusión según la invención preferentemente idéntico, pero, de forma alternativa, también con otro constructo de fusión según la invención, por ejemplo un constructo de fusión que contiene otro componente (B). La dimerización puede realizarse por medio de la región "hinge", situada en su forma nativa entre los dominios CH1 y CH2, a través de un puente de disulfuro o también a través de una secuencia introducida artificialmente (o, por ejemplo, también por sustitución/inserción de una cisteína), que puede dimerizar de forma covalente (puente de disulfuro) o no covalente (por ejemplo cremallera de leucina u otras secciones de secuencias aptas para dimerizar).
En una forma de realización preferida, la región constante del anticuerpo en la proteína de fusión puede ser de origen humana, por ejemplo proceder del anticuerpo GI2765420, y pertenecer a la clase de inmunoglobulinas IgG, en particular de las clases IgG1, IgG2, IgG3 o IgG4, preferentemente de las clases IgG2 o IgG4. De forma alternativa, pueden utilizarse también regiones constantes de inmunoglobulinas de la clase IgG de otros mamíferos, en particular de roedores o primates, pero pueden utilizarse según la invención también regiones constantes de las clases de inmunoglobulinas IgD, IgM, IgA o IgE. Típicamente, los fragmentos de anticuerpos contenidos en el constructo según la invención comprenden el dominio CH3 de la región Fc o partes del mismo y por lo menos secciones parciales del dominio CH2 de la región Fc. Opcionalmente, constructos de fusión según la invención que presentan el dominio CH3 y la región "hinge" como componente (A) para la dimerización también son posibles.
Sin embargo, pueden utilizarse también derivados de las secuencias de inmunoglobulinas que ocurren en su forma nativa, en particular las variantes que presentan por lo menos una sustitución, deleción y/o inserción (aquí denominadas globalmente con el término "variante"). Típicamente, las variantes de este tipo presentan una identidad de secuencia con la secuencia nativa de por lo menos un...
Reivindicaciones:
1. Proteína de fusión recombinante, que contiene una secuencia de aminoácidos, que comprende: (a) en la sección de la proteína de fusión situada por el extremo N-terminal, la sección Fc de una inmunoglobulina o una parte de una sección Fc de una inmunoglobulina que mantiene su capacidad de dimerización como componente (A), (b) en la sección de la proteína de fusión más C-terminal la parte extracelular de un ligando TNF o una secuencia parcial de la parte extracelular de un ligando TNF como componente (B) y, si se desea, una zona de transición entre el componente (A) y el componente (B), que contiene un ligador,
caracterizada porque, el componente (B) es la parte extracelular del ligando TNF EDA1 o una secuencia parcial de la parte extracelular del ligando TNF EDA1 que presenta por lo menos la secuencia de aminoácidos 246 a 391 de la secuencia nativa de EDA1.
2. Proteína de fusión recombinante según la reivindicación 1, caracterizada porque el componente (B) contiene la secuencia de aminoácidos 140-391, 157-391, 160-391, 181-391, 182-391, 200-391 ó 245-391 de la secuencia nativa de EDA1.
3. Proteína de fusión recombinante según la reivindicación 1 ó 2, caracterizada porque el componente (A) presenta la región "hinge", el dominio CH2 y el dominio CH3 de la sección de Fc de una inmunoglobulina de la clase de IgG, en particular de IgG humana.
4. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque el componente (A) presenta la secuencia de aminoácidos

5. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque la zona de transición entre el componente (A) y el componente (B) contiene la secuencia PQPQPKPQPKPEPE.
6. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque la zona de transición presenta un punto de corte de proteasa.
7. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque el extremo N-terminal de la proteína de fusión recombinante presenta una secuencia señal, por ejemplo una secuencia señal de secreción, y/o un marcador del tipo "tag", por ejemplo "flag-tag" o "his-tag".
8. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque el extremo N-terminal presenta la secuencia MAIIYLILLFTAVRG.
9. Proteína de fusión recombinante según una de las reivindicaciones anteriores, caracterizada porque la secuencia de la proteína de fusión recombinante une seis componentes (B) funcionalmente entre sí.
10. Complejo de constructos de fusión según una de la reivindicaciones 1 a 9, caracterizado porque el complejo presenta 6 cadenas del componente (A).
11. Secuencia de ADN, caracterizada porque la secuencia de ADN codifica para una proteína de fusión recombinante según una de las reivindicaciones 1 a 9.
12. Vector de expresión, caracterizado porque el vector de expresión contiene una secuencia de ADN según la reivindicación 11.
13. Célula hospededora, caracterizada porque la célula hospededora se ha transfectado con un vector de expresión según la reivindicación 12.
14. Medicamento que contiene una proteína de fusión recombinante según una de las reivindicaciones 1 a 9, un complejo según la reivindicación 10, una secuencia de ADN según la reivindicación 11, un vector de expresión según la reivindicación 12 o una célula hospededora según la reivindicación 13.
15. Utilización de una proteína de fusión recombinante según una de las reivindicaciones 1 a 9, de un complejo según la reivindicación 10, una secuencia de ADN según la reivindicación 11, de un vector de expresión según la reivindicación 12 o de una célula hospededora según la reivindicación 13 para la preparación de un medicamento destinado al tratamiento de enfermedades genéticas, en particular de una displasia ectodérmica, o enfermedades, defectos o anomalías de las estructuras ectodérmicas, tales como por ejemplo, anomalías del pelo, de los dientes o de las glándulas, en particular para el tratamiento de la alopecia o para la curación de heridas.
16. Utilización según la reivindicación 15 para la preparación de un medicamento destinado al tratamiento de la displasia ectodérmica, en particular la displasia ectodérmica hipohidrótica ligada a X.
17. Utilización según la reivindicación 15 para la preparación de un medicamento destinado al tratamiento de la alopecia, el hirsutismo, para el tratamiento de heridas o de disfunciones de las glándulas sudoríparas o sebáceas, o de una deficiencia de las glándulas sudoríparas o sebáceas.
18. Utilización según una de la reivindicaciones 15 a 17 para la preparación de un medicamento destinado al tratamiento de la madre/del animal madre durante el embarazo/preñez, administrándose el medicamento proporcionado de forma parenteral en una dosificación adecuada.
Patentes similares o relacionadas:
REDUCCIÓN DE LA INMUNOGENICIDAD DE LAS PROTEÍNAS DE FUSIÓN, del 11 de Abril de 2011, de MERCK PATENT GMBH: Método para la reducción de la inmunogenicidad mediante la eliminación de epítopos de células T no propias de una proteína de fusión, que comprende una primera […]
RECEPTOR HUMANO H4-1BB, del 23 de Junio de 2010, de INDIANA UNIVERSITY FOUNDATION: EL RECEPTOR HUMANO H4-1BB HA SIDO AISLADO, SECUENCIADO Y PRESENTADO AQUI. EL CDNA DEL RECEPTOR HUMANO H4-1BB ES ALREDEDOR DE UN 65% HOMOLOGO […]
USOS TERAPEUTICOS DE RECEPTORES SOLUBLES BR43X2, del 11 de Mayo de 2010, de ZYMOGENETICS, INC.: Uso de un polipéptido que comprende la secuencia de SEQ ID Nº: 10 para la fabricación de un medicamento para el tratamiento de asma, bronquitis, enfisema, nefritis, […]
OSTEOPROTEGERINA EN LA LECHE, del 28 de Abril de 2010, de SOCIETE DES PRODUITS NESTLE S.A.: Osteoprotegerina obtenida por aislamiento a partir de leche bovina
PROTEINAS DE FUSION DE TACI-INMUNOGLOBULINA, del 16 de Marzo de 2010, de ZYMOGENETICS, INC.: Utilización de una proteína de fusión de activador transmembrana e interaccionador con el modulador del calcio y el ligando de la ciclofilina […]
POLIPEPTIDOS SECRETADOS Y TRANSMEMBRANA Y ACIDOS NUCLEICOS QUE LOS CODIFICAN, del 2 de Marzo de 2010, de GENENTECH, INC.: Ácido nucleico aislado que: (i) codifica un polipéptido que tiene la secuencia de aminoácidos mostrada en la figura 2, con o sin la secuencia señal y/o la metionina de […]
RECEPTOR RTD, del 19 de Enero de 2010, de GENENTECH, INC.: Polipéptido RTD aislado que tiene al menos un 95% de identidad en la secuencia de aminoácidos con la secuencia nativa del polipéptido RTD […]
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]