Compuesto de cefem.
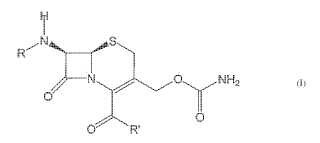
Un compuesto de cef-3-em caracterizado por la fórmula [I]
o una sal o éster del mismo,
en el que R se selecciona del grupo que consiste en
a) HOOC-X-COen
el que X se define como (CH2)4
o en el que X es (CH2)m-CH≥A-(CH2)n o (CH2)m-C≡C-(CH2)n, en el que m y n son cada uno individualmente 0,1, 2 ó 3, y m + n ≥ 2 ó 3, y A es CH o N,
o en el que X es (CH2)p-CH≥CH-CH≥C-(CH2)q, en el que p y q son cada uno individualmente 0 ó 1, y p + q ≥0, o
b) Y-CH2-CO-, en el que Y es fenilo, fenoxi o tetrazoliloy en el que R' se selecciona del grupo que consiste en
c) OH
d) O-(alquilo de C1-6), en el que el alquilo puede ser lineal o ramificado, y
e) O-C(alquilo de C1-6)-O-(alquilo de C1-6), en el que los grupos alquilo pueden ser lineales o ramificados.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2004/000367.
Solicitante: DSM Sinochem Pharmaceuticals Netherlands B.V.
Nacionalidad solicitante: Países Bajos.
Dirección: Alexander Fleminglaan 1 2613 AX Delft PAISES BAJOS.
Inventor/es: DE VROOM, ERIK, BOVENBERG, ROELOF, ARY, LANS, SUTHERLAND,JOHN,DAVID, VAN DEN BERG,MARCO ALEXANDER, RAAMSDONK,LOURINA MADELEINE LEONIE, VOLLINGA,ROELAND CHRISTIAAN ROEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D501/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen sistemas cíclicos tia-5 aza-1 biciclo [4.2.0] octano, es decir, compuestos que contienen un sistema cíclico de fórmula: , p. ej. cefalosporinas; Estando estos sistemas cíclicos adicionalmente condensados, p. ej. condensados en posición 2, 3 con heterociclos que contienen oxígeno, nitrógeno o azufre.
PDF original: ES-2400562_T3.pdf
Fragmento de la descripción:
Compuesto de cefem
La presente invención se refiere a nuevos compuestos de cef-3-em y a un bioprocedimiento para la producción de estos compuestos. Un compuesto de cef-3-em según la presente invención se caracteriza por la fórmula [I]:
o una sal o éster del mismo,
en el que R se selecciona del grupo que consiste en a) HOOC-X-CO
en el que X se define como (CH2) 4
o en el que X es (CH2) m-CH=A- (CH2) n o (CH2) m-C!C- (CH2) n, en el que m y n son cada uno individualmente 0, 1, 2 ó 3, y m + n = 2 ó 3, y A es CH o N,
o en el que X es (CH2) p-CH=CH-CH=C- (CH2) q, en el que p y q son cada uno individualmente 0 ó 1, y p + q = 0, o b) Y-CH2-CO-, en el que Y es fenilo, fenoxi o tetrazolilo y en el que R’ se selecciona del grupo que consiste en c) OH
d) O- (alquilo de C1-6) , en el que el alquilo puede ser lineal o ramificado, y
e) O-C (alquilo de C1-6) -O- (alquilo de C1-6) , en el que los grupos alquilo pueden ser lineales o ramificados.
Este compuesto de cef-3-em [I] se puede usar como intermedio en la producción de antibióticos de cef-3-em 20 comerciales. Como alternativa, este compuesto de cef-3-em [I] se puede convertir en otro intermedio, a saber, ácido 7-amino-3-carbamoiloximetil-3-cefem-4-carboxílico, o una sal o éster del mismo.
Una ventaja particular de este compuesto de cef-3-em [I] es su estabilidad mejorada en las condiciones de purificación del compuesto, y/o la síntesis posterior de antibióticos de cef-3-em comercialmente atractivos en comparación con cefalosporina C. En virtud de ello, el compuesto preferido se puede aislar más fácilmente que la cefalosporina C.
Los ejemplos de antibióticos de cef-3-em comerciales son cefacetrilo, cefaclor, cefaloglicina, cefalonio, cefaloridina, cefalotina, cefamandol, cefapirina, cefapirina, cefatrizina, cefazedona, cefazolina cefbuperazona, cefcapeno pivoxilo, cefdinir, cefditoren pivoxilo, cefepima, cefixima, cefmenoxima, cefmetazol, cefminox, cefodizima, cefonicid, cefoperazona, ceforanid, cefotaxima, cefotiam, cefotiam hexetilo, cefpiramida, cefpiroma, cefpodoxima proxetilo,
cefprozilo, cefroxadina, cefsulodina, ceftazidima, cefteram pivoxilo, ceftezol, ceftibuteno, ceftiofur, ceftizoxima, ceftriaxona, cefuroxima, cefuroxima axetilo, cefuzonam.
La cefuroxima, cefoxitina y cefcapeno povoxilo son ejemplos de antibióticos cefalosporínicos, que comparten un grupo 3-carbamoiloximetilo, y que no se pueden producir fácilmente a partir de los intermedios de cef-3-em actualmente disponibles, tales como 7-ACA. Los compuestos de cef-3-em según la presente invención poseen un grupo 3-carbamoiloximetilo, y se pueden convertir fácilmente en estos antibióticos cefalosporínicos así como en otros antibióticos de cef-3-em usando técnicas bien conocidas.
La cefazolina, ceftazidina y ceftriaxona son otros antibióticos cefalosporínicos muy preferidos que se pueden preparar a partir de un compuesto de fórmula [1] según técnicas bien conocidas.
Además, el compuesto según la fórmula [I] se puede usar él mismo como un antibiótico.
Un compuesto muy preferido según la presente invención es el compuesto de la fórmula [II] (ácido adipoil-7-amino-3carbamoiloximetil-3-cefem-4-carboxílico) .
El compuesto de cef-3-em según la presente invención se puede producir químicamente según métodos conocidos 5 en la técnica, o mediante fermentación o mediante una combinación de una o más etapas de biotransformación y una o más etapas de fermentación y/o una o más etapas de conversión química.
La presente invención también comprende un método fermentativo para la producción de un compuesto de cef-3-em
[I] como metabolito secundario a partir de un microorganismo adecuado genéticamente alterado.
Para la producción fermentativa de los compuestos de cef-3-em según la presente invención, preferiblemente se puede hacer uso de microorganismos, que poseen inherentemente al menos parte de la ruta metabólica para la producción de ∀-lactama. Por ejemplo, se pueden usar microorganismos que poseen al menos parte de la ruta metabólica para la producción de compuestos ∀-lactámicos de penam o cef-3-em. Los organismos adecuados para este fin son, por ejemplo, hongos del género Penicillium, tales como P. chr y sogenum, o del género Acremonium, tal como A. chr y sogenum, o del género Aspergillus, tal como A. nidulans, o bacterias del género Streptomyces, tal
como S. clavuligeris, o del género Nocardia, tal como N. lactamdurans, o del género Lysobacter, tal como L. lactamgenus.
Se cree que la biosíntesis del compuesto de cef-3-em O-carbamoilado cefamicina C en microorganismos tiene lugar según el esquema representado en la Fig. 1. La síntesis de cefalosporina C se representa en el esquema según Fig.2
Preferiblemente, tales organismos genéticamente alterados se cultivan en condiciones en las que, en el compuesto de cef-3-em resultante, la cadena lateral #-amino-adipílica que está presente en la posición 7 en los compuestos de cef-3-em naturales se sustituirá por una cadena lateral deseada según la presente invención. Para este fin, se suministra a la conversión enzimática in vivo una composición capaz de proporcionar esta cadena lateral.
De forma adecuada, la conversión enzimática in vivo se puede suministrar mediante un precursor de cadena lateral 25 seleccionado del grupo que consiste en i) un compuesto Y-CH2-COOH, o una sal o éster del mismo, en el que Y es fenilo, fenoxi o tetrazolilo,
ii) un compuesto de la fórmula general HOOC-X-COOH, o una sal o éster del mismo,
en el que X se define como (CH2) 4
o en el que X es (CH2) m-CH=A- (CH2) n o (CH2) m-C!C- (CH2) n, en el que m y n son cada uno individualmente 0, 30 1, 2 ó 3, y m + n = 2 ó 3, y A es CH o N,
o en el que X es (CH2) p-CH=CH-CH=C- (CH2) q, en el que p y q son cada uno individualmente 0 ó 1, y p + q = 0 ó 1
Si se usa A. chr y sogenum como el organismo productor manipulado genéticamente, se debería introducir penDE, que codifica isopenicilina N aciltransferasa (Alvarez, E., B. Meesschaert, E. Montenegro, S. Gutiérrez, 35 B. Diez, J. L. Barredo, y J. F. Martin. 1993. Eur. J. Biochem. 215:323-332) y cmcH, que codifica carbamoiltransferasa (Coque, J.J. R., F. J. Perez-Llarena, F. J. Enguita, J. L. Fuente, J. F. Martin, y P. Liras. 1995. Gene 162:21-27) . Adicionalmente, a fin de evitar productos secundarios indeseados, se debería inactivar al menos el gen cefG que codifica DAC acetiltransferasa (Felix, H.R., J. Neusch, y W. Wehrli. 1980. FEMS Microbiol. Lett. 8: 55-58; Fujisawa, Y., y T. Kanzaki. 1975. Agric. Biol. Chem. 39:2043-2048) y también preferiblemente los genes cefD1 y cefD2 juntos, que codifican IPN epimerasa (Ullan RV, Casqueiro J, Banuelos O, Fernandez FJ, Gutierrez S, Martin JF. 2002. J Biol Chem 277 (48) :46216-25) .
Si se escoge N. lactamdurans o S. clavuligerus como el organismo productor genéticamente manipulado, se requiere la introducción y expresión del penDE y preferiblemente se puede inactivar el gen cefD (Jayatilake, S., J.A. Huddleston, y E.P. Abraham. 1981. Biochem. J. 195:645-647; Konomi, T., S. Herchen, J.E. Baldwin,
M. Yoshida, N.A. Hunt, y A.L. Demain. 1979. Biochem. J. 184:427-430) y el gen cmcI que codifica OCDAC hidroxilasa (Xiao, X., G. Hintermann, A. Hausler, P. J. Barker, F. Foor, A. L. Demain, y J. Piret. 1993. Agents Chemother. 37:84-88) , y opcionalmente también el gen cmcJ que codifica metil transferasa o cefamicina C sintetasa (Coque, J.J. R., F. J. Perez-Llarena, F. J. Enguita, J. L. Fuente, J. F. Martin, y P. Liras. 1995. Gene 162:21-27) , de las cuales estas dos últimas son las enzimas tardías de la biosíntesis de cefamicina (tal como se describe en el documento WO 95/29253) , a fin de evitar productos secundarios indeseados.
Si se escoge L. lactamgenus como hospedante, al menos se debería introducir penDE y cmcH, y preferiblemente se debería de inactivar cefD.
La inserción e inactivación de genes en organismos a fin de proporcionar el genotipo para la producción de un compuesto según la presente invención se puede llevar a cabo mediante métodos conocidos en la técnica. Para la inserción, se puede hacer uso de secuencias de ADN genómico o, si se desea, se puede hacer uso de ADNc.
Los microorganismos preferidos para la producción fermentativa de compuesto de la presente invención son P. chr y sogenum y A. chr y sogenum, que mediante ingeniería genética se han proporcionado con fragmentos de ADN que codifican enzimas adecuadas para la producción del actual compuesto y en los que, en el caso de A. chr y sogenum, se han inactivado los genes apropiados.
Más preferiblemente, la producción... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de cef-3-em caracterizado por la fórmula [I]
o una sal o éster del mismo,
en el que R se selecciona del grupo que consiste en a) HOOC-X-COen el que X se define como (CH2) 4
o en el que X es (CH2) m-CH=A- (CH2) n o (CH2) m-C!C- (CH2) n, en el que m y n son cada uno individualmente 0, 1, 2 ó 3, y m + n = 2 ó 3, y A es CH o N, 10 o en el que X es (CH2) p-CH=CH-CH=C- (CH2) q, en el que p y q son cada uno individualmente 0 ó 1, y p + q = 0, o b) Y-CH2-CO-, en el que Y es fenilo, fenoxi o tetrazolilo y en el que R’ se selecciona del grupo que consiste en c) OH
d) O- (alquilo de C1-6) , en el que el alquilo puede ser lineal o ramificado, y e) O-C (alquilo de C1-6) -O- (alquilo de C1-6) , en el que los grupos alquilo pueden ser lineales o ramificados.
2. Compuesto según la reivindicación 1 o una sal o éster del mismo, en el que el grupo R’ es OH, y en el que el grupo R se selecciona de adipoílo, fenoxiacetilo y tetrazolacetilo.
3. Ácido adipoil-7-amino-3-carbamoiloximetil-3-cefem-4-carboxílico según la reivindicación 1, o una sal o éster del 20 mismo.
4. Un bioprocedimiento para la producción fermentativa de un compuesto de cef-3-em, caracterizado por la fórmula [I]:
o una sal o éster del mismo, en el que R se selecciona del grupo que consiste en a. HOOC-X-COen el que X se define como (CH2) 4
b. Y-CH2-CO-, en el que Y es fenilo, fenoxi o tetrazolilo
y en el que R’ se selecciona del grupo que consiste en c. OH
d. O- (alquilo de C1-6) , en el que el alquilo puede ser lineal o ramificado, y
e. O-C (alquilo de C1-6) -O- (alquilo de C1-6) , en el que los grupos alquilo pueden ser lineales o ramificados,
que comprende las etapas de:
A) mantener, en un medio de cultivo capaz de sostener su crecimiento, una cepa de P. chr y sogenum que produce isopenicilina N y añadir a dicho medio de cultivo una materia prima que comprende uno cualquiera o más precursores de cadena lateral seleccionados del grupo que consiste en ∋ Y-CH2-COOH, o una sal o éster del mismo, en el que Y es fenilo, fenoxi o tetrazolilo,
∋ un compuesto de la fórmula general HOOC-X-COOH, o una sal o éster del mismo, en el que X se define como (CH2) 4
∋ o en el que X es (CH2) m-CH=A- (CH2) n o (CH2) m-C!C- (CH2) n, en el que m y n son cada uno individualmente 0, 1, 2 ó 3, y m + n = 2 ó 3, y A es CH o N,
∋ o en el que X es (CH2) p-CH=CH-CH=C- (CH2) q, en el que p y q son cada uno individualmente 0 ó 1, y p + q = 0 ó 1
que son capaces de ser asimilados y utilizados por dicha cepa de P. chr y sogenum para producir el 20 ácido acil-6-aminopenicilánico (acil-6-APA) correspondiente, con lo que se produce dicho acil-6-APA;
B) llevar a cabo la siguiente conversión enzimática mediante la expresión in situ de los genes correspondientes:
i) el acil-6-APA se expande anularmente in situ para formar el ácido acil-7-aminodesacetoxicefalosporánico (acil-7-ADCA) correspondiente mediante la enzima expandasa, en el que dicha cepa de P. chr y sogenum se ha transformado mediante ADN que codifica la enzima expandasa capaz de aceptar como sustrato dicho acil-6-APA, con lo que, como resultado de su expresión, dicho acil-6-APA producido por dicha cepa es también después expandido anularmente in situ para formar el acil-7-ADCA correspondiente;
ii) la cadena lateral 3-metílica de dicho acil-7-ADCA es hidroxilada in situ para producir el acil-7-amino
desalquilcefalosporánico (acil-7-ADAC) correspondiente mediante la enzima hidroxilasa, en el que dicha cepa de P. chr y sogenum se ha transformado mediante ADN que codifica la enzima hidroxilasa capaz de aceptar como sustrato dicho acil-7-ADCA, con lo que, como resultado de su expresión, dicho acil-7-ADCA producido por dicha cepa es también después hidroxilado in situ para formar el acil-7-ADAC correspondiente;
iii) la cadena lateral 3-hidroximetílica de dicho acil-7-ADAC es O-carbamoilada in situ para producir el compuesto según la fórmula [I] mediante la enzima O-carbamoil transferasa, en el que dicha cepa de P. chr y sogenum se ha transformado mediante ADN que codifica la enzima O-carbamoil transferasa capaz de aceptar como sustrato dicho acil-7-ADAC, con lo que, como resultado de su expresión, dicho acil-7-ADAC producido por dicha cepa es también después carbamoilado in situ para formar un compuesto según la presente invención.
5. Uso de un compuesto según la reivindicación 1, en la producción de un antibiótico de cef-3-em.
6. Uso del compuesto según la reivindicación 1, en la producción de un antibiótico de 3-carbamoiloximetil-3-cefem.
7. Uso según la reivindicación 6, en el que el antibiótico de 3-carbamoiloximetil-3-cefem se selecciona del grupo que consiste en:
a. Cefuroxima,
b. Cefoxitina
c. Cefcapeno pivoxilo.
8. Uso del compuesto según la reivindicación 1, en la producción de ácido 7-amino-3-carbamoiloximetil-3-cefem-4carboxílico o una sal o éster del mismo.
9. Microorganismo de la especie P. chr y sogenum capaz de producir isopenicilina N y adecuado para la producción de los compuestos según las reivindicaciones 1-3, y que se ha proporcionado con fragmentos de ADN que codifican:
a. una enzima expandasa
b. una enzima hidroxilasa
c. una enzima O-carbamoil transferasa.
10. Microorganismo de la especie P. chr y sogenum capaz de producir isopenicilina N y adecuado para la producción de los compuestos según las reivindicaciones 1-3, y que se ha proporcionado con fragmentos de ADN que codifican:
a. una enzima expandasa/hidroxilasa combinada b. una enzima O-carbamoil transferasa.
COOH
Crecimiento (%)
Patentes similares o relacionadas:
Proceso para la producción de compuestos 3-alquenilcefem, del 10 de Mayo de 2017, de OTSUKA CHEMICAL CO., LTD.: Un proceso para la preparación del ácido 7-amino-3-[(E/Z)-2-(4-metiltiazol-5-il)vinil]-3-cefem-4-carboxílico de fórmula y una sal de un metal alcalino del […]
Sales de clorhidrato de un compuesto antibiótico, del 20 de Enero de 2016, de Theravance Biopharma Antibiotics IP, LLC: Un compuesto de fórmula I:**Fórmula** en el que x está en el intervalo de 1 a 2.
 Compuestos de cefem, del 1 de Abril de 2015, de ASTELLAS PHARMA INC.: Un compuesto de la fórmula [I]: (Ver fórmula) en la que R 1 es alquilo C1-C6, hidroxialquilo (C1-C6) o haloalquilo (C1-C6), y R 2 es hidrógeno o un grupo protector amino, […]
Compuestos de cefem, del 1 de Abril de 2015, de ASTELLAS PHARMA INC.: Un compuesto de la fórmula [I]: (Ver fórmula) en la que R 1 es alquilo C1-C6, hidroxialquilo (C1-C6) o haloalquilo (C1-C6), y R 2 es hidrógeno o un grupo protector amino, […]
Producción mejorada de cefalosporina, del 20 de Septiembre de 2013, de DSM Sinochem Pharmaceuticals Netherlands B.V: Una cepa de Penicillium productora de cefalosporina que ha adquirido la capacidad de producir cefalosporinasdespués de haber sido transformada con un […]
 Compuestos de 3-alquenilcefem y procedimiento para su producción, del 16 de Mayo de 2012, de OTSUKA CHEMICAL CO., LTD.: Un compuesto de 3-alquenilcefem de fórmula **Formula**
en la que R1 es bencilo o fenoximetilo, R2, R3 y R4 son iguales o diferentes, siendo cada uno de ellos un […]
Compuestos de 3-alquenilcefem y procedimiento para su producción, del 16 de Mayo de 2012, de OTSUKA CHEMICAL CO., LTD.: Un compuesto de 3-alquenilcefem de fórmula **Formula**
en la que R1 es bencilo o fenoximetilo, R2, R3 y R4 son iguales o diferentes, siendo cada uno de ellos un […]
 Antibióticos entrecruzados de glucopéptidos y cefalosporinas, del 2 de Mayo de 2012, de THERAVANCE, INC.: Un compuesto con la fórmula I:
O una sal farmacológicamente aceptable del mismo, en el que R1 es -Ya- (W) n-Yb-; R2 es hidrógeno o un alquilo C1-6; cada R3 se […]
Antibióticos entrecruzados de glucopéptidos y cefalosporinas, del 2 de Mayo de 2012, de THERAVANCE, INC.: Un compuesto con la fórmula I:
O una sal farmacológicamente aceptable del mismo, en el que R1 es -Ya- (W) n-Yb-; R2 es hidrógeno o un alquilo C1-6; cada R3 se […]
Procesos para producir compuestos de 3-cefem, del 18 de Abril de 2012, de OTSUKA KAGAKU KABUSHIKI KAISHA: Un proceso para preparar un compuesto de 3-halogenometilcefem de la fórmula o una sal del mismo en la que X1 es un átomo de halógeno, caracterizado por que […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE CEFOTETÁN, del 2 de Noviembre de 2011, de ACS DOBFAR S.P.A.: Procedimiento para la obtención de cefotetán purificado, de fórmula (l) **Fórmula** que contiene no más del 0,2% del tautómero de fórmula (ll) **Fórmula** […]