COMPRIMIDOS PEDIÁTRICOS DE CAPECITABINA.
Una composición farmacéutica recubierta por una película que comprende capecitabina y al menos un disgregante,
dicha composición se disgrega en agua a 37ºC en un aparato de disgregación USP en menos de 2 minutos y tiene una dureza de alrededor de 56-91N (8-13 unidades de fuerza Cobb)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/060186.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL SUIZA.
Inventor/es: INFELD, MARTIN, HOWARD, SHAH, NAVNIT, HARGOVINDAS, BACHYNSKY,Maria Oksana , RASHED,Mohammad.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Septiembre de 2007.
Clasificación PCT:
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/28 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Grageas; Píldoras o comprimidos con revestimientos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Comprimidos pediátricos de capecitabina.
La presente invención está relacionada con una nueva forma de dosificación farmacéutica de disgregación rápida, que tiene como ingrediente activo la 5'-desoxi-5-fluoro-N-[(pentiloxi)-carbonil]-citidina (capecitabina). La nueva forma de dosificación es adecuada para cualquier paciente y especialmente para pacientes que tienen dificultad para tragar las formas de dosificación sólidas orales, lo que incluye a las poblaciones pediátricas y geriátricas.
La capecitabina es un carbamato de fluoropirimidina con actividad antineoplásica. Es un profármaco sistémico administrado por vía oral de la 5'-desoxi-5-fluorouridina (5'-DFUR), que es un agente antineoplásico. La capecitabina es comercializada en los Estados Unidos por Roche Laboratories bajo el nombre comercial de Xeloda®. El nombre químico de la capecitabina es 5'-desoxi-5-fluoro-N-[(pentiloxi)-carbonil]-citidina y posee la siguiente fórmula estructural:
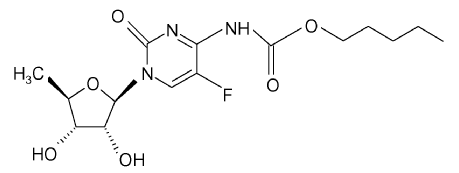
La capecitabina está protegida por patentes Estadounidenses, lo que incluye la Patente Estadounidense Nº 4.966.891, 5.472.949 y USSN 60/667.509, depositada el 1 de Abril de 2005. Métodos mejorados para la elaboración de capecitabina se exponen en las Patentes Estadounidenses Nº 5.453.497 y 5.476.932, y en la solicitud USSN 60/532.266, depositada el 22 de diciembre de 2003. En la extensión necesaria, cualquiera de las patentes y solicitudes anteriores se incorporan aquí como referencia.
En los Estados Unidos, la Capecitabina está aprobada actualmente para el tratamiento del cáncer de colon y mama. La dosis aprobada/recomendada actualmente de capecitabina en esas indicaciones es de 1250 mg/m2 administrados por vía oral dos veces al día (equivalente a 2500 mg/m2 de dosis diaria total) durante 14 días seguido de un periodo de descanso de 7 días administrado en ciclos de tres semanas, tanto tiempo como sea necesario. Véase el prospecto aprobado. Normalmente la duración media del tratamiento es de 3 a 6 ciclos de tres semanas. Las formas de dosificación unitarias aprobadas actualmente son unos comprimidos recubiertos por una película de color melocotón claro que contienen 150 mg de capecitabina y unos comprimidos recubiertos por una película de color melocotón claro que contienen 500 mg de capecitabina.
El comprimido de capecitabina que actualmente está en el mercado (Xeloda® Roche) normalmente necesita aproximadamente unos 7-12 minutos para disgregarse en agua (Prueba de Disgregación, USP), dependiendo del tamaño del comprimido. Los excipientes tradicionales utilizados actualmente en estos comprimidos, como la lactosa y la croscarmelosa sódica, no superan por sí mismos la propiedad cohesiva de la capecitabina en el comprimido. El resultado final es que el comprimido comercializado se disgrega lentamente por erosión de la superficie y por lo tanto no es muy adecuado para la dispersión o disgregación rápida en agua antes de la administración oral en pacientes comprometidos para tragar.
Por lo tanto, los comprimidos de capecitabina actualmente comercializados pueden ser difíciles de tragar por las poblaciones pediátricas y geriátricas, así como por pacientes con dificultad y bloqueos al tragar.
Así es deseable un comprimido que se disgregue fácilmente, como uno que tenga una matriz rápidamente dispersable, y más preferiblemente un comprimido que se disgregue rápidamente y con sabor, para remediar la mencionada dificultad de la lenta erosión del comprimido en agua antes de su administración oral.
La presente invención proporciona una forma de dosificación farmacéutica que se disgrega rápidamente para la administración oral de 5'-desoxi-5-fluoro-N-[(pentiloxi)-carbonil]-citidina (capecitabina) que es adecuada para la administración a pacientes que tienen dificultad en tragar formas de dosificación sólidas orales.
La presente invención proporciona una forma de dosificación farmacéutica de capecitabina recubierta por una película que se disgrega rápidamente para su administración oral. Preferiblemente, el comprimido se disgrega en agua a 37ºC (Prueba de Disgregación, USP) en menos de 2 minutos, más preferiblemente en menos de 1 minuto, y posee una dureza de alrededor de 8-13 unidades de fuerza de Cobb (scu). Mediante agitación manual en agua a temperatura ambiente, el comprimido se disgrega en menos o en alrededor de 3 minutos. En una realización preferida, la composición comprende, en base al peso total de la forma de dosificación unitaria final, entre alrededor del 10% y alrededor del 50%, más preferiblemente entre alrededor del 25% y alrededor del 35%, y más preferiblemente el 30%, de capecitabina y entre alrededor del 10% y alrededor del 50%, más preferiblemente entre alrededor del 20% y alrededor del 40%, y más preferiblemente el 30%, de al menos un disgregante por forma de dosificación unitaria.
Otra realización preferida de la presente invención está relacionada con una composición de comprimido libre de lactosa para individuos intolerantes a la lactosa en la que la lactosa está sustituida por manitol adicional.
Además, son esenciales un alcohol polihídrico directamente comprimible, como el manitol, y una celulosa microcristalina para mantener la fuerza del comprimido sin comprometer la disgregación del comprimido. La composición de manitol comprende entre alrededor del 2% y alrededor del 25%, más preferiblemente entre alrededor del 4% y alrededor del 20% y lo más preferible entre alrededor del 6% y alrededor del 16%, y la celulosa microcristalina comprende entre alrededor del 4% y alrededor del 30%, más preferiblemente entre alrededor del 8% y alrededor del 25% y lo más preferible entre alrededor del 12% y alrededor del 22% por forma de dosificación unitaria.
Preferiblemente, la composición comprende entre alrededor de 50 mg y alrededor de 1500 mg, preferiblemente entre 100 mg y alrededor de 750 mg, y más preferiblemente entre alrededor de 125 mg y alrededor de 500 mg de capecitabina. Más preferiblemente, la composición comprende, por forma de dosificación unitaria, 125 mg, 150 mg, 175 mg, 250 mg, 350 mg o 500 mg de capecitabina.
Los disgregantes útiles incluyen, pero no están limitados a, crospovidona, con un tamaño de partícula inferior a 15 micras en el rango del 90% y hasta un tamaño de partícula inferior a 400 micras en el rango del 90%, croscarmelosa sódica, glicolato de almidón sódico, hidroxipropilcelulosa poco sustituida, o cualquier otro disgregante comercialmente disponible, como el Pharmaburst CTM, una combinación de manitol/sorbitol descrita y reivindicada en la Patente Estadounidense Nº 7.118.765 incorporada aquí como referencia (disponible de SPI Pharma, New Castle, Delaware) o cualquier combinación de los mismos.
Las composiciones farmacéuticas de la invención pueden incluir transportadores y excipientes adicionales, orgánicos o inorgánicos terapéuticamente inertes. Por ejemplo, tales composiciones pueden incluir aromatizantes como la vainillina, mezcla enmascarante del sabor amargo, sabor a fresa o cualquier otro aromatizante o combinaciones de aromatizantes que se añaden normalmente a las preparaciones farmacéuticas para hacerlas agradables al gusto para su administración oral.
Las composiciones pueden también incluir agentes endulzantes como la sacarina sódica, aspártamo, sucralosa, acesulfamo-K y sacarosa.
Las composiciones pueden también incluir aglutinantes como la hidroxipropilmetilcelulosa, hidroxipropilcelulosa, povidona, almidón pregelatinizado o cualquier otro almidón de maíz de expansión en frío.
Las composiciones pueden también incluir material de relleno como la lactosa anhidra o celulosa microcristalina.
Las composiciones también pueden incluir agentes colorantes, agentes de recubrimiento, antioxidantes, estabilizantes, lubricantes (por ejemplo, estearato magnésico), coadyuvantes de granulación, coadyuvantes del flujo, y cualquier otro agente y material conocido por los expertos en la materia de la fabricación de formas de dosificación farmacéutica para consumo oral humano.
En una realización, la forma de dosificación unitaria es un comprimido, preferiblemente un comprimido recubierto por una película. El recubrimiento puede contener excipientes como un formador de película (polímero), un plastificante, un agente oscurecedor, pigmentos,...
Reivindicaciones:
1. Una composición farmacéutica recubierta por una película que comprende capecitabina y al menos un disgregante, dicha composición se disgrega en agua a 37ºC en un aparato de disgregación USP en menos de 2 minutos y tiene una dureza de alrededor de 56-91N (8-13 unidades de fuerza Cobb).
2. La composición de la reivindicación 1 en la que la capecitabina comprende entre alrededor del 10% y alrededor del 50% del peso total de la composición del núcleo.
3. La composición de la reivindicación 2 que comprende entre alrededor de 50 mg y alrededor de 1500 mg de capecitabina.
4. La composición de la reivindicación 3 que comprende entre alrededor de 100 mg y alrededor de 750 mg de capecitabina.
5. La composición de la reivindicación 3 que comprende 125 mg, 175 mg, 250 mg, 350 mg o 500 mg de capecitabina.
6. La composición farmacéutica de la reivindicación 1, en la que se selecciona al menos un disgregante del grupo que consiste en crospovidona con un tamaño de partícula inferior a 15 micras en el rango de un 90% a un tamaño de partícula inferior a 400 micras en el rango de un 90%, croscarmelosa sódica, glicolato de almidón sódico, hidroxipropilcelulosa poco sustituida, Pharmaburst C o cualquier combinación de dichos disgregantes.
7. La composición de la reivindicación 5 en que el disgregante está entre alrededor del 10 y alrededor del 50% de cada forma de dosificación unitaria.
8. La composición de la reivindicación 6 en la que el disgregante está entre alrededor del 20% a alrededor del 40% de cada forma de dosificación unitaria.
9. La composición de la reivindicación 7 en la que el disgregante está entre alrededor del 30% de cada forma de dosificación unitaria.
10. La composición farmacéutica de la reivindicación 1 que contiene además un alcohol polihídrico directamente comprimible.
11. La composición de la reivindicación 9 en la que el alcohol es manitol y comprende entre alrededor del 2% y alrededor del 25% de cada forma de dosificación unitaria.
12. La composición de la reivindicación 10 en la que el manitol comprende entre alrededor del 4% y alrededor del 20% de cada forma de dosificación unitaria.
13. La composición de la reivindicación 11 en la que el manitol comprende entre alrededor del 6% y alrededor del 16% de cada forma de dosificación unitaria.
14. La composición farmacéutica de la reivindicación 1 que contiene entre alrededor del 4% y alrededor del 30% de celulosa microcristalina de cada forma de dosificación unitaria.
15. La composición de la reivindicación 13 que contiene entre alrededor del 8% y alrededor del 25% de celulosa microcristalina de cada forma de dosificación unitaria.
16. La composición de la reivindicación 14 que contiene entre alrededor del 12% y alrededor del 22% de celulosa microcristalina de cada forma de dosificación unitaria.
17. La composición de la reivindicación 1 en la que la composición farmacéutica se disgrega en menos de 1 minuto.
18. La composición de la reivindicación 1 que contiene un aglutinante que se selecciona del grupo que consiste en hidroxipropilmetilcelulosa, hidroxipropilcelulosa, povidona, almidón pregelatinizado y almidón de maíz de expansión en frío.
19. La composición de la reivindicación 17 en la que la capecitabina comprende entre alrededor de 50 mg y alrededor de 1500 mg por forma de dosificación unitaria.
20. La composición de la reivindicación 19 en la que la capecitabina comprende entre alrededor de 100 mg y alrededor de 750 mg por forma de dosificación unitaria.
21. La composición de la reivindicación 18 en la que la capecitabina comprende 125 mg, 150 mg, 175 mg, 250 mg, 350 mg o 500 mg por forma de dosificación unitaria.
22. Una composición farmacéutica que se disgrega en agua a 37ºC en un aparato de disgregación USP en menos de un minuto que comprende capecitabina, al menos un disgregante, un aglutinante, al menos un relleno, un lubricante, al menos un agente endulzante y al menos un aromatizante.
23. Una composición farmacéutica de acuerdo con la reivindicación 22, que se caracteriza porque está recubierta por una película.
24. Una composición farmacéutica de acuerdo con la reivindicación 1 o 22, que se caracteriza porque está libre de lactosa.
25. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 125 mg de capecitabina, 35,72 mg de lactosa anhidra, 3,57 mg de hipromelosa, 37,50 mg de crospovidona, 89,30 mg de Pharmaburst C, 23,21 mg de manitol, 46,82 mg de celulosa microcristalina, 8,22 mg de estearato magnésico, 15,54 mg de aspártamo, 3,22 mg de sacarina sódica, 7,86 mg de vainillina, 1,47 mg de mezcla enmascarante del sabor amargo y 2,97 mg de aroma de fresa.
26. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 150 mg de capecitabina, 42,90 mg de lactosa anhidra, 4,28 mg de hipromelosa, 45,00 mg de crospovidona, 107,16 mg de Pharmaburst C, 27,85 mg de manitol, 56,18 mg de celulosa microcristalina, 9,86 mg de estearato magnésico, 18,64 mg de aspártamo, 3,86 mg de sacarina sódica, 9,43 mg de vainillina, 1,76 mg de mezcla enmascarante del sabor amargo y 3,56 mg de aroma de fresa.
27. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 175 mg de capecitabina, 50,06 mg de lactosa anhidra, 5,00 mg de hipromelosa, 52,50 mg de crospovidona, 125,00 mg de Pharmaburst C, 32,50 mg de manitol, 65,54 mg de celulosa microcristalina, 11,50 mg de estearato magnésico, 21,75 mg de aspártamo, 4,50 mg de sacarina sódica, 11,00 mg de vainillina, 2,06 mg de mezcla enmascarante del sabor amargo y 4,15 mg de aroma de fresa.
28. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 250 mg de capecitabina, 71,49 mg de lactosa anhidra, 7,14 mg de hipromelosa, 75,00 mg de crospovidona, 178,60 mg de Pharmaburst C, 46,43 mg de manitol, 93,63 mg de celulosa microcristalina, 16,43 mg de estearato magnésico, 31,07 mg de aspártamo, 6,43 mg de sacarina sódica, 15,71 mg de vainillina, 2,94 mg de mezcla enmascarante del sabor amargo y 5,93 mg de aroma de fresa.
29. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 350 mg de capecitabina, 100,12 mg de lactosa anhidra, 10,00 mg de hipromelosa, 105,00 mg de crospovidona, 250,00 mg de Pharmaburst C, 65,00 mg de manitol, 131,08 mg de celulosa microcristalina, 23,00 mg de estearato magnésico, 43,50 mg de aspártamo, 9,00 mg de sacarina sódica, 22,00 mg de vainillina, 4,12 mg de mezcla enmascarante del sabor amargo y 8,30 mg de aroma de fresa.
30. La composición farmacéutica de acuerdo con la reivindicación 23, que comprende 500 mg de capecitabina, 142,88 mg de lactosa anhidra, 14,28 mg de hipromelosa, 150,00 mg de crospovidona, 357,20 mg de Pharmaburst C, 92,84 mg de manitol, 187,28 mg de celulosa microcristalina, 32,88 mg de estearato magnésico, 62,16 mg de aspártamo, 12,88 mg de sacarina sódica, 31,44 mg de vainillina, 5,88 mg de mezcla enmascarante del sabor amargo y 11,88 mg de aroma de fresa.
31. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 125,00 mg de capecitabina, 3,57 mg de hipromelosa, 37,50 mg de crospovidona, 89,30 mg de Pharmaburst C, 58,93 mg de manitol, 46,82 mg de celulosa microcristalina, 8,22 mg de estearato magnésico, 15,54 mg de aspártamo, 3,22 mg de sacarina sódica, 7,86 mg de vainillina, 1,47 mg de mezcla enmascarante del sabor amargo y 2,97 mg de aroma de fresa.
32. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 150,00 mg de capecitabina, 4,28 mg de hipromelosa, 45,00 mg de crospovidona, 107,16 mg de Pharmaburst C, 70,75 mg de manitol, 56,18 mg de celulosa microcristalina, 9,86 mg de estearato magnésico, 18,64 mg de aspártamo, 3,86 mg de sacarina sódica, 9,43 mg de vainillina, 1,76 mg de mezcla enmascarante del sabor amargo y 3,56 mg de aroma de fresa.
33. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 175,00 mg de capecitabina, 5,00 mg de hipromelosa, 52,50 mg de crospovidona, 125,00 mg de Pharmaburst C, 82,56 mg de manitol, 65,54 mg de celulosa microcristalina, 11,50 mg de estearato magnésico, 21,75 mg de aspártamo, 4,50 mg de sacarina sódica, 11,00 mg de vainillina, 2,06 mg de mezcla enmascarante del sabor amargo y 4,15 mg de aroma de fresa.
34. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 250,00 mg de capecitabina, 7,14 mg de hipromelosa, 75,00 mg de crospovidona, 178,60 mg de Pharmaburst C, 117,92 mg de manitol, 93,63 mg de celulosa microcristalina, 16,43 mg de estearato magnésico, 31,07 mg de aspártamo, 6,43 mg de sacarina sódica, 15,71 mg de vainillina, 2,94 mg de mezcla enmascarante del sabor amargo y 5,93 mg de aroma de fresa.
35. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 350,00 mg de capecitabina, 10,00 mg de hipromelosa, 105,00 mg de crospovidona, 250,00 mg de Pharmaburst C, 165,12 mg de manitol, 131,08 mg de celulosa microcristalina, 23,00 mg de estearato magnésico, 43,50 mg de aspártamo, 9,00 mg de sacarina sódica, 22,00 mg de vainillina, 4,12 mg de mezcla enmascarante del sabor amargo y 8,30 mg de aroma de fresa.
36. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 500,00 mg de capecitabina, 14,28 mg de hipromelosa, 150,00 mg de crospovidona, 357,20 mg de Pharmaburst C, 235,72 mg de manitol, 187,28 mg de celulosa microcristalina, 32,88 mg de estearato magnésico, 62,16 mg de aspártamo, 12,88 mg de sacarina sódica, 31,44 mg de vainillina, 5,88 mg de mezcla enmascarante del sabor amargo y 11,88 mg de aroma de fresa.
37. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 125,00 mg de capecitabina, 3,57 mg de hipromelosa, 62,50 mg de crospovidona, 58,93 mg de manitol, 82,26 mg de celulosa microcristalina, 7,41 mg de estearato magnésico, 15,54 mg de aspártamo, 3,22 mg de sacarina sódica, 7,86 mg de vainillina, 1,47 mg de mezcla enmascarante del sabor amargo y 2,97 mg de aroma de fresa.
38. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 150,00 mg de capecitabina, 4,28 mg de hipromelosa, 75,01 mg de crospovidona, 70,75 mg de manitol, 98,71 mg de celulosa microcristalina, 8,90 mg de estearato magnésico, 18,64 mg de aspártamo, 3,86 mg de sacarina sódica, 9,43 mg de vainillina, 1,76 mg de mezcla enmascarante del sabor amargo y 3,56 mg de aroma de fresa.
39. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 175,00 mg de capecitabina, 5,00 mg de hipromelosa, 87,50 mg de crospovidona, 82,50 mg de manitol, 115,16 mg de celulosa microcristalina, 10,37 mg de estearato magnésico, 21,76 mg de aspártamo, 4,50 mg de sacarina sódica, 11,00 mg de vainillina, 2,06 mg de mezcla enmascarante de amargo y 4,15 mg de aroma de fresa.
40. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 250,00 mg de capecitabina, 7,14 mg de hipromelosa, 125,00 mg de crospovidona, 117,86 mg de manitol, 164,52 mg de celulosa microcristalina, 14,82 mg de estearato magnésico, 31,08 mg de aspártamo, 6,44 mg de sacarina sódica, 15,72 mg de vainillina, 2,94 mg de mezcla enmascarante del sabor amargo y 5,94 mg de aroma de fresa.
41. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 350,00 mg de capecitabina, 10,00 mg de hipromelosa, 175,00 mg de crospovidona, 165,00 mg de manitol, 230,32 mg de celulosa microcristalina, 20,74 mg de estearato magnésico, 43,52 mg de aspártamo, 9,00 mg de sacarina sódica, 22,00 mg de vainillina, 4,12 mg de mezcla enmascarante del sabor amargo y 8,30 mg de aroma de fresa.
42. La composición farmacéutica de acuerdo con la reivindicación 1, que comprende 500,00 mg de capecitabina, 14,28 mg de hipromelosa, 250,00 mg de crospovidona, 235,72 mg de manitol, 329,04 mg de celulosa microcristalina, 29,64 mg de estearato magnésico, 62,16 mg de aspártamo, 12,88 mg de sacarina sódica, 31,44 mg de vainillina, 5,88 mg de mezcla enmascarante del sabor amargo y 11,88 mg de aroma de fresa.
Patentes similares o relacionadas:
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]