COMPOSICIONES Y METODOS PARA ADMINISTRAR FARMACOS FOTOSENSIBLES.
Nanopartícula cargada con un fotosensibilizador que comprende una o más porfirinas verdes y uno o más polímeros de poliéster,
en la que las nanopartículas son un vehículo de administración de liberación rápida del fotosensibilizador en un medio que contiene suero
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA03/00740.
Solicitante: QLT, INC..
Nacionalidad solicitante: Canadá.
Dirección: 887 GREAT NORTHERN WAY,VANCOUVER, BRITISH COLUMBIA V5.
Inventor/es: GURNY, ROBERT, BOCH,RONALD,ERWIN, ALLEMANN,ERIC, KONAN,YVETTE.
Fecha de Publicación: .
Fecha Concesión Europea: 3 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K41/00W
Clasificación PCT:
- A61K41/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales obtenidas por tratamiento de sustancias mediante energía ondulatoria o por radiación corpuscular.
- A61K9/51 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Nanocápsulas.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
Clasificación antigua:
- A61K41/00 A61K […] › Preparaciones medicinales obtenidas por tratamiento de sustancias mediante energía ondulatoria o por radiación corpuscular.
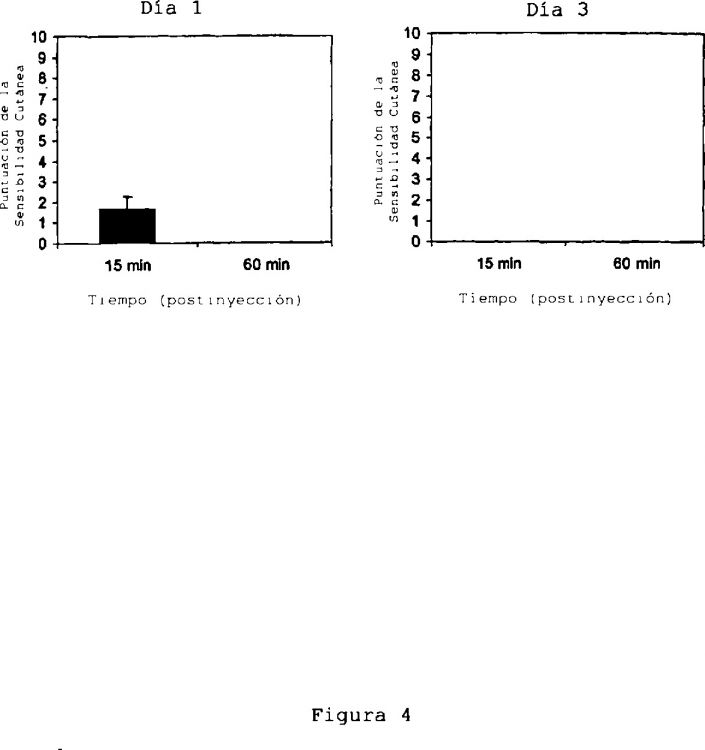
Fragmento de la descripción:
Composiciones y métodos para administrar fármacos fotosensibles.
Campo técnico
La invención se refiere al campo de la terapia fotodinámica (PDT), y en particular a unas composiciones y métodos para la administración local o parenteral de porfirinas verdes. Se proporcionan unas composiciones de nanopartículas biodegradables que contienen unos polímeros de poliéster para administrar porfirinas verdes como agente activable en la PDT. También se proporcionan unos métodos para la preparación y uso de tales composiciones de nanopartículas.
Técnica anterior
La terapia fotodinámica (PDT) es un proceso en dos etapas. Primero, se administra un agente o fármaco fotoactivable (denominado "fotosensibilizador" o "PS" de manera intercambiable en la presente memoria) bien sistémicamente o localmente. A continuación tras un intervalo apropiado, tiempo en el que el fármaco fotoactivable se acumula en un tejido diana más que en un tejido no diana, se aplica radiación con radiación electromagnética, como la luz visible (no térmica) a una zona de tratamiento durante un período de tiempo corto. Durante el tiempo de radiación el fármaco actúa como fotosensibilizador catalítico, que absorbe un fotón y que transfiere esta energía al oxígeno. Este proceso convierte el oxígeno molecular benigno estable disponible en oxígeno en estado singlete citotóxico u otra especie de oxígeno tóxico, que mata las células diana o modifica o modula la actividad celular en ellas. La PDT se utiliza ampliamente en el tratamiento del cáncer, y en determinadas enfermedades oftálmicas caracterizadas por la neovascularización en el ojo, por ejemplo, la degeneración macular relacionada con la edad (AMD). Visudyne® (Novartis Ophthalmics, Inc.), que contiene un fotosensibilizador de porfirina verde, verteporfina, está aprobado en muchos países para el tratamiento de la neovascularización coroidea y la AMD.
Aunque muchos fotosensibilizadores son hidrófobos o insolubles en agua, a menudo resultan necesarios en medios acuosos o basados en agua en los que se encuentran las células diana. Así pues, se han desarrollado múltiples sistemas como vehículos de administración para tales agentes. Preferentemente, se fabrican vehículos para la administración farmacéuticamente aceptables de fotosensibilizadores de manera simple y rentable, a la vez que se mantienen las propiedades de administración eficaz del fármaco.
Las nanopartículas son partículas coloidales sólidas formadas por la asociación de polímeros adecuados. Las nanopartículas son producidas por medios mecánicos o químicos y pueden formularse para contener una sustancia activa como un fármaco hidrófobo en asociación con los polímeros. De esta manera las nanopartículas proporcionan una alternativa a otros portadores coloidales como los liposomas, micelas, niosomas (vesículas surfactantes no iónicas), y microemulsiones.
Los polímeros sintéticos utilizados en la preparación de nanopartículas incluyen poliésteres como el ácido (poli)láctico, copolímero de láctido y glicólido y poli(
Se han investigado ampliamente las partículas biodegradables basadas en polímeros de poliéster como el copolímero de D,L-láctido y glicólido (PLGA) y el polímero de D,L-láctido (PLA) como sistemas de administración parenteral (Allémann et al., 1.998; Kawashima et al., 1.998; Rodrigues Jr et al., 1.995; Scholes et al., 1.993; Smith et al., 1.986). Los polímeros de poliéster, aprobados por la Administración de Alimentos y Medicamentos, resultan de interés debido a sus propiedades biológicas y fisicoquímicas (Vert 1.987; Vert et al., 1.998). Se han utilizado las nanopartículas para modificar la farmacocinética de los fármacos, como se detalla en los siguientes: Roland, Clinical pharmacokinetics of doxorubicin in hepatoma patients after a single intravenous injection of free or nanoparticles bound anthracycline, Int. J. Pharm., 54:113(1.989); J. Kattan, J.P. Droz, P. Couvreur, J.P. Marino, A.B. Laroze, P. Rougier, P. Brault, H. Vranckx, J. M. Grognet, X. Morge and H. Sancho-Carnier, Phase I clinical trial and pharmacokinetic evaluation of doxorubicin carried by polyisohexylcyanoacrylate nanoparticles, Invest. New Drugs, 10:191 (1.992); H.S. Yoo, J.E. Oh, T.G. Park, Biodegradable nanoparticles containing doxorubicin-PLGA conjugate for sustained release, Pharm. Res., 16: 1114 (1.999); E. Allémann, R. Gurny, E. Doelker, F.S. Skinner, H. Schutz, Distrubution, kinetics and elimination of radioactivity after intravenous and intramuscular injection of 14C-savoxepine loaded poly(D,L-lactic acid) nanospheres to rats, J. Controlled Release 29: 97-104 (1.994); R. Jalil, Biodegradable poly(lactic acid) and poly(lactide-co-glycolide) polymers in sustained drug delivery, Drug Dev. Ind Pharm., 16:2353 (1.990), C. Tasset; N. Barette; S. Thysman; J.M. Ketelslegers; V. Preat et al, Polyisobutylcyanoacrylate nanoparticles as sustained release system for calcitonin, J. Control. Rel., 33: 23 (1.995); T. Harmia; P. Speiser, J. Kreuter, Nanoparticles as drug carriers in ophthalmology, Pharm. Acta. Helv., 62: 322(1987); and M. El-Samaligy; P. Rohdewald, Triamcinolone diacetate nanoparticles, sustained release drug delivery system suitable for parenteral administration Pharm. Acta. Helv., 57(7): 201-4 (1.982).
Tradicionalmente, las nanopartículas biodegradables han servido como depósitos de fármacos inmovilizados que se liberan lentamente de la matriz del polímero. Se creía que esto era un efecto de una degradación lenta del polímero para resultar en una liberación lenta del fármaco a lo largo del tiempo. Por ejemplo, las inyecciones intramusculares en mujeres de microcápsulas inyectables de acción prolongada compuestas por copolímero de D,L-láctido y glicólido que contenían contraceptivos proporcionaban una liberación controlada (Beck LR et al., A. J. Obstet. Gynecol. 147, 815-821, 1.983). Además, se creía que las nanopartículas de doxorubicina se depositaban en un reservorio intrahepático y se liberaban lentamente al administrase en nanopartículas de poliisohexilcianoacrilato y polimetacrilato (Kattan J. et al., Investigational New Drugs, 10, 191-199, 1.992, Rolland A International Journal of Pharmaceutics, 54, 113-121, 1.989).
Para la administración parenteral, las formulaciones de nanopartículas deben satisfacer los requisitos farmacopeicos de esterilidad. Sin embargo, la esterilización de tales dispositivos poliméricos mediante una técnica satisfactoria sigue siendo un reto. La labilidad química o física de la matriz del polímero suele limitar los métodos más convencionales para obtener unos productos estériles aceptables. Por ejemplo, la esterilización mediante autoclavado puede inducir la degradación de los poliésteres y el fármaco por hidrólisis. Estos polímeros también son sensibles al calor debido a su naturaleza termoplástica (Athanasiou et al., 1.996). La esterilización química mediante gases como el óxido de etileno puede resultar en problemas de toxicidad a residuos tóxicos. Numerosos estudios han demostrado los efectos de la radiación ? en la estabilidad y la seguridad de los portadores coloidales basados en poliésteres, principalmente las micropartículas (Hausberger et al., 1.995; Mohr et al., 1.999; Montanari et al., 1.998; Volland et al., 1.994). Se demostró que la radiación gamma alteraba las propiedades de las micropartículas de poliéster cargadas con el fármaco de varias maneras como las reacciones radiolíticas, escisión de cadenas y reticulación (Volland et al., 1.994). Estas reacciones pueden tener consecuencias en el contenido nominal de fármaco, el patrón de liberación del fármaco y la bioresorción del sistema. Además, el fármaco encapsulado puede degradarse tras la exposición a radiación gamma. Por tanto, la selección de un método de esterilización adecuado para ese tipo de formulaciones resulta crucial para asegurar su integridad física y química, su rendimiento y seguridad in vivo.
Como técnica alternativa, se ha utilizado la filtración estéril a través de...
Reivindicaciones:
1. Nanopartícula cargada con un fotosensibilizador que comprende una o más porfirinas verdes y uno o más polímeros de poliéster, en la que las nanopartículas son un vehículo de administración de liberación rápida del fotosensibilizador en un medio que contiene suero.
2. Nanopartícula según la reivindicación 1, en la que dicha una o más porfirinas verdes se selecciona de entre BPD-MA, QLT 0074 ó QLT 0069.
3. Nanopartícula según la reivindicación 1 ó 2, en la que los polímeros se seleccionan de entre el copolímero de D,L-láctido y glicólido y el polímero de D,L-láctido.
4. Nanopartícula según la reivindicación 1 ó 2, en la que los polímeros son copolímero de D,L-láctido y glicólido.
5. Nanopartícula según cualquiera de las reivindicaciones 1-4, con un diámetro medio inferior a aproximadamente 200 nm.
6. Nanopartícula según la reivindicación 5, con un diámetro medio de entre 100 y 200 nm.
7. Nanopartícula según cualquiera de las reivindicaciones 1-4, que comprende adicionalmente un lioprotector.
8. Nanopartícula según la reivindicación 7, en la que el lioprotector es trehalosa.
9. Nanopartícula según cualquiera de las reivindicaciones 1-4, en forma liofilizada.
10. Nanopartícula según cualquiera de las reivindicaciones 1-4, en la que las porfirinas verdes comprenden desde aproximadamente un 1% hasta aproximadamente un 20% en peso de la nanopartícula.
11. Nanopartícula según la reivindicación 10, en la que las porfirinas verdes comprenden desde aproximadamente un 5 hasta aproximadamente un 10% en peso de la nanopartícula.
12. Método para preparar nanopartículas cargadas con una porfirina verde, que comprende:
13. Método según la reivindicación 12, en el que dicho polímero de poliéster es copolímero de D,L-láctido y glicólido y/o polímero de D,L-láctido.
14. Método según la reivindicación 12, en el que dicho polímero de poliéster es copolímero de D,L-láctido y glicólido.
15. Método según cualquiera de las reivindicaciones 12-14, en el que dicho disolvente orgánico es THF.
16. Método según cualquiera de las reivindicaciones 12-14, en el que dicho coloide estabilizante es PVAL.
17. Método según cualquiera de las reivindicaciones 12-14, en el que dicha agitación mecánica enérgica se da a más de 2.000 rpm.
18. Método según cualquiera de las reivindicaciones 12-14, en el que dicho aislamiento se da mediante filtración de flujo cruzado.
19. Método según cualquiera de las reivindicaciones 12-14, que comprende adicionalmente la filtración estéril de las nanopartículas.
20. Método según cualquiera de las reivindicaciones 12-14, que comprende adicionalmente la liofilización de las nanopartículas.
21. Método según la reivindicación 20, en el que se añade un lioprotector antes de la liofilización.
22. Nanopartícula según la reivindicación 1, en la que el medio que contiene suero es un fluido corporal de un animal.
23. Nanopartícula según la reivindicación 22, en la que el medio que contiene suero es sangre humana.
24. Nanopartícula según cualquiera de las reivindicaciones 22-23, con un tamaño medio de partícula menor que aproximadamente 200 nm de diámetro.
25. Nanopartícula según la reivindicación 24, en la que el tamaño medio de partícula se encuentra entre aproximadamente 100 nm y 200 nm de diámetro.
26. Nanopartícula según cualquiera de las reivindicaciones 1-11 ó 22-25 para su uso en una terapia fotodinámica.
27. Nanopartícula según la reivindicación 26, en la que dicha terapia fotodinámica se da en un ser humano aquejado de un tumor o una neovasculatura no deseada.
28. Composición farmacéutica que comprende la nanopartícula según cualquiera de las reivindicaciones 1-11 ó 22-25 y un excipiente farmacéuticamente aceptable.
29. Uso de una nanopartícula según cualquiera de las reivindicaciones 1-11 ó 22-25 para preparar una composición farmacéutica para su uso en una terapia fotodinámica.
30. Uso de la reivindicación 29, en la que dicha terapia fotodinámica se da en un ser humano aquejado de un tumor o una neovasculatura no deseada.
Patentes similares o relacionadas:
MEDICAMENTOS TÓPICOS MEJORADOS Y MÉTODOS PARA EL TRATAMIENTO FOTODINÁMICO DE UNA ENFERMEDAD, del 11 de Enero de 2012, de PROVECTUS PHARMATECH, INC: Uso de al menos un xanteno halogenado para la fabricación de un medicamento para aplicación tópica, para el tratamiento fotodinámico de enfermedades seleccionadas […]
PROCEDIMIENTO PARA LA INACTIVACIÓN DE PATÓGENOS EN SANGRE DE DONANTES, EN PLASMA SANGUÍNEO O EN CONCENTRADOS DE ERITROCITOS EN RECIPIENTES FLEXIBLES BAJO AGITACIÓN, del 24 de Noviembre de 2011, de BLUTSPENDEDIENST DER LANDESVERBANDE DES DRK NIEDERSACHSEN, SACHSEN-ANHALT, THURINGEN, OLDENBURG UN: Procedimiento para la inactivación de patógenos en sangre de donantes, en plasma sanguíneo y/o en concentrados de eritrocitos, que comprende las etapas siguientes: […]
 MEDICAMENTOS PARA EL TRATAMIENTO FOTODINAMICO DE ENFERMEDADES, del 14 de Octubre de 2010, de PHOTOGEN, INC.: Un medicamento intracorpóreo para su uso en el tratamiento de tejido humano o animal usando terapia fotodinámica, comprendiendo dicho medicamento […]
MEDICAMENTOS PARA EL TRATAMIENTO FOTODINAMICO DE ENFERMEDADES, del 14 de Octubre de 2010, de PHOTOGEN, INC.: Un medicamento intracorpóreo para su uso en el tratamiento de tejido humano o animal usando terapia fotodinámica, comprendiendo dicho medicamento […]
PROCEDIMIENTO PARA LA INACTIVACION DE PATOGENOS EN SANGRE DE DONANTES, EN PLASMA SANGUINEO O EN CONCENTRADOS DE ERITROCITOS EN RECIPIENTES FLEXIBLES BAJO AGITACION, del 18 de Junio de 2010, de BLUTSPENDEDIENST DER LANDESVERBANDE DES DRK NIEDERSACHSEN, SACHSEN-ANHALT, THURINGEN, OLDENBURG UN: Procedimiento para la inactivación de patógenos en sangre de donantes, en plasma sanguíneo y/o en concentrados de eritrocitos, que comprende […]
 SULFENATOS COLORANTES PARA FOTOTERAPIA DUAL, del 5 de Mayo de 2010, de MALLINCKRODT INC.: Agente fototerápico que tiene la fórmula,
SULFENATOS COLORANTES PARA FOTOTERAPIA DUAL, del 5 de Mayo de 2010, de MALLINCKRODT INC.: Agente fototerápico que tiene la fórmula,
MACROCICLOS TETRAPIRROLICOS COMO AGENTES FOTODINAMICOS, del 16 de Febrero de 2010, de CIPAN-COMPANHIA INDUSTRIAL PRODUTORA DE ANTIBIOTICOS, S.A.: Compuestos tetrapirrólicos macrocíclicos de la familia de porfirinas (estructura I), clorinas (estructura II) y bacterioclorinas (estructura III) caracterizados por […]
NUEVO DERIVADO DE ACIDO LIPOICO Y SU USO, del 18 de Enero de 2010, de SENJU PHARMACEUTICAL CO., LTD.: Un quelato de N-(6,8-dimercaptooctanoil)aminoácido de zinc representado por la siguiente fórmula (I), en la que M denota zinc y A denota un aminoácido que está […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]