Composiciones y procedimientos para la terapia y el diagnóstico de enfermedad inflamatoria del intestino.
Polinucleótido aislado que comprende una secuencia seleccionada de entre el grupo que consiste en:
(a) la secuencia proporcionada en SEC ID Nº 75;
(b) el complemento de la secuencia proporcionada en SEC ID Nº 75;
(c) secuencias que presentan al menos el 75% de identidad con la secuencia de SEC ID Nº 75; y
(d) secuencias que presentan al menos el 90% de identidad con la secuencia de SEC ID Nº 75.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/040422.
Solicitante: CORIXA CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2711 CENTERVILLE ROAD, SUITE 400 WILMINGTON, DE 19808 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LODES, MICHAEL, J., HERSHBERG,ROBERT M, HOSKEN,NANCY ANN, MOHAMATH,RAODOH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/195 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de origen bacteriano.
- C07K14/205 C07K 14/00 […] › de Campylobacter (G).
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2405405_T3.pdf
Fragmento de la descripción:
Composiciones y procedimientos para la terapia y el diagnóstico de enfermedad inflamatoria del intestino.
Antecedentes de la invención Campo de la invención La presente invención se refiere de manera general a la terapia y al diagnóstico de la enfermedad de Crohn y la colitis ulcerosa (denominadas colectivamente enfermedad inflamatoria del intestino, o EII) . La invención se refiere más particularmente a polipéptidos que comprenden al menos una parte de una proteína que se reconoce, y frente a la cual individuos con EII montan una respuesta inmunitaria aberrante, y a polinucleótidos que codifican para tales polipéptidos. Tales polipéptidos y polinucleótidos son útiles en composiciones farmacéuticas, por ejemplo, vacunas, y otras composiciones para el diagnóstico y el tratamiento de EII.
Descripción de la técnica relacionada La enfermedad de Crohn y la colitis ulcerosa (denominadas colectivamente enfermedad inflamatoria del intestino, o EII) son enfermedades inflamatorias crónicas del tubo gastrointestinal. Aunque las características clínicas varían algo entre estos dos trastornos, ambos se caracterizan por dolor abdominal, diarrea (con frecuencia con hemorragia) , un grupo variable de manifestaciones “extraintestinales” (tales como artritis, uveitis, cambios en la piel, etc.) y la acumulación de células inflamatorias dentro del intestino delgado y el colon (observada en muestras quirúrgicas o de biopsia patológica) .
La EII afecta tanto a niños como a adultos y presenta una distribución por edades bimodal (un máximo alrededor de 20 y otro alrededor de 40) . La EII es una enfermedad crónica de por vida, y con frecuencia se agrupa con otros trastornos denominados “autoinmunitarios” (por ejemplo artritis reumatoide, diabetes mellitus tipo I, esclerosis múltiple, etc.) . La EII se encuentra casi exclusivamente en los países industrializados. Los datos más recientes de la Clínica Mayo sugieren una incidencia global superior a 1 de cada 100.000 personas en los Estados Unidos, con datos de prevalencia en algunos estudios superiores a 1 de cada 1000. Hay una clara tendencia hacia el aumento de la incidencia de EII en los EE.UU. y en Europa, particularmente la enfermedad de Crohn. La base para este aumento no está clara en la actualidad. Como tal, la EII representa la 2ª enfermedad autoinmunitaria más común en los Estados Unidos (tras la artritis reumatoide) .
El tratamiento de EII es diverso. La terapia de primera línea incluye normalmente derivados de salicilato (por ejemplo 5-ASA) administrados por vía oral o por vía rectal. Las tasas de respuesta en enfermedad de Crohn sin complicaciones son de aproximadamente el 40% (en comparación con el 20% para placebo) . Los corticosteroides siguen siendo la piedra angular en el tratamiento de pacientes con enfermedad más “resistente”, a pesar de los efectos secundarios desfavorables. Las opciones de tratamiento más recientes incluyen anti-metabolitos (por ejemplo metotrexato, 6-mercaptopurina) e inmunomoduladores (por ejemplo Remicade: un anticuerpo humano quimérico dirigido al receptor de TNFa) .
A pesar de la considerable investigación sobre terapias para estos trastornos, la EII sigue siendo difícil de diagnosticar y de tratar eficazmente. Además, no hay pruebas de laboratorio claras para diagnosticar la EII, ni tampoco hay pruebas de laboratorio adecuadas que sirvan como “marcador sustituto” que sean útiles de manera uniforme para realizar un seguimiento del transcurso de la enfermedad en pacientes. Por consiguiente, existe una necesidad en la materia de procedimientos mejorados para detectar y tratar tales enfermedades inflamatorias del intestino. La presente invención cumple estas necesidades y proporciona además otras ventajas relacionadas.
Breve descripción de las figuras
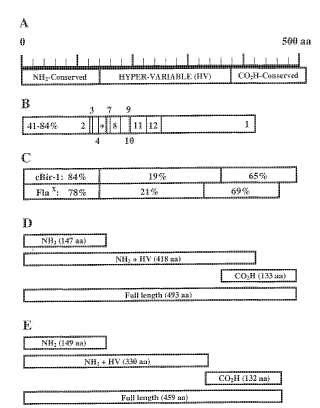
La figura 1 muestra un esquema de clones de flagelina con porcentaje de similitud con flagelina B relacionada de la bacteria ruminal anaerobia, Butyrivibrio fibrisolvens.
La figura 2a muestra análisis de inmunotransferencia de tipo Western de respuesta de anticuerpos en suero contra flagelinas recombinantes cBir-1 y Flax y fragmentos.
La figura 2b muestra la titulación de anticuerpo anti-flagelina en suero contra flagelinas recombinantes cBir-1 y Flax.
La figura 2c muestra la correlación de puntuación de colitis con anticuerpo anti-Flax en suero.
Las figuras 3a y b muestran la liberación de citocinas por donantes estimulados con flagelina.
Breve sumario de la invención En un aspecto, la presente invención proporciona un polinucleótido aislado que comprende una secuencia seleccionada de entre el grupo que consiste en:
(a) la secuencia proporcionada en SEC ID Nº: 75;
(b) el complemento de la secuencia proporcionada en SEC ID Nº: 75;
(c) secuencias que presentan al menos el 75% o el 90% de identidad con la secuencia de SEC ID Nº: 75.
La presente invención, en otro aspecto, proporciona un polipéptido aislado que comprende una secuencia de aminoácidos que se codifica por una secuencia de polinucleótido descrita anteriormente.
La presente invención proporciona además un polipéptido aislado que comprende una secuencia de aminoácidos seleccionada de entre el grupo que consiste en a) la secuencia mencionada en SEC ID Nº: 79; y b) secuencias que presentan al menos el 70%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% o el 99% de identidad con la secuencia expuesta en SEC ID Nº: 79.
La invención también proporciona un fragmento de polipéptido aislado que comprende al menos 25, 50, 100 o más aminoácidos contiguos de la secuencia de SEC ID Nº 79, siendo el fragmento de polipéptido inmunológicamente reactivo con un anticuerpo que se une al polipéptido de longitud completa de SEC ID Nº 79.
En determinadas realizaciones preferidas, los polipéptidos y/o polinucleótidos de la presente invención son inmunogénicos, es decir, pueden provocar una respuesta inmunitaria, particularmente una respuesta inmunitaria humoral y/o celular, tal como se describe adicionalmente en la presente memoria.
En la presente memoria se dan a conocer fragmentos, variantes y/o derivados de las secuencias de polipéptido y/o de polinucleótido dadas a conocer, presentando los fragmentos, variantes y/o derivados preferentemente un nivel de actividad inmunogénica de al menos aproximadamente el 50%, preferentemente al menos aproximadamente el 70% y más preferentemente al menos aproximadamente el 90% del nivel de actividad inmunogénica de una secuencia de polipéptido expuesta en SEC ID Nº: 79 o una secuencia de polipéptido codificada por una secuencia de polinucleótido expuesta en SEC ID Nº: 75.
La presente invención proporciona además polinucleótidos que codifican para un polipéptido descrito anteriormente, vectores de expresión que comprenden tales polinucleótidos y células huésped transformadas o transfectadas con tales vectores de expresión.
La invención proporciona además un procedimiento de preparación de un polipéptido de la invención que comprende cultivar una célula huésped transformada o transfectada con un vector de expresión que comprende un polinucleótido de la invención funcionalmente unido a una secuencia de control de la expresión en condiciones mediante las cuales se expresa el polinucleótido y se produce el polipéptido; y recuperar el polipéptido.
Otro aspecto de la presente invención proporciona anticuerpos aislados, o fragmento de unión a antígeno de los mismos, que se unen específicamente al polipéptido de SEC ID Nº: 79. En una realización de la invención, el anticuerpo puede ser un anticuerpo monoclonal. En una realización adicional el anticuerpo es un anticuerpo humano o un anticuerpo que se ha humanizado. En realizaciones aún adicionales, los anticuerpos de la presente invención se unen a proteínas de flagelina y en una realización los anticuerpos son anticuerpos neutralizantes contra proteínas de flagelina. En una realización adicional, dichos anticuerpos bloquean la interacción entre una proteína de flagelina y un receptor tipo Toll. En una realización particular, el receptor tipo Toll es TLR5.
La presente invención proporciona además, en otros aspectos, proteínas de fusión que comprenden al menos un polipéptido tal como se describió anteriormente, así como polinucleótidos que codifican para tales proteínas de fusión, normalmente en forma de composiciones farmacéuticas, por ejemplo, composiciones de vacuna, que comprenden un portador fisiológicamente aceptable y/o un inmunoestimulante. Las proteínas de fusión pueden comprender múltiples polipéptidos inmunogénicos o partes/variantes de los mismos, tal como se describe en la presente... [Seguir leyendo]
Reivindicaciones:
1. Polinucleótido aislado que comprende una secuencia seleccionada de entre el grupo que consiste en:
(a) la secuencia proporcionada en SEC ID Nº 75;
(b) el complemento de la secuencia proporcionada en SEC ID Nº 75;
(c) secuencias que presentan al menos el 75% de identidad con la secuencia de SEC ID Nº 75; y
(d) secuencias que presentan al menos el 90% de identidad con la secuencia de SEC ID Nº 75.
2. Polipéptido aislado que comprende una secuencia de aminoácidos seleccionada de entre el grupo que consiste en:
(a) secuencias codificadas por un polinucleótido según la reivindicación 1;
(b) la secuencia expuesta en SEC ID Nº 79; y
(c) secuencias que presentan al menos el 70%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% o el 99% de identidad con la secuencia expuesta en SEC ID Nº 79.
3. Fragmento de polipéptido aislado que comprende al menos 25, 50, 100 o más aminoácidos contiguos de la secuencia de SEC ID Nº 79, siendo el fragmento de polipéptido inmunológicamente reactivo con un anticuerpo que se une al polipéptido de longitud completa de SEC ID Nº 79.
4. Fragmento de polipéptido aislado según la reivindicación 3, en el que el fragmento de polipéptido comprende:
(a) SEC ID Nº 80, que corresponde a la región conservada amino-terminal de la secuencia expuesta en SEC ID Nº 79; o
(b) SEC ID Nº 81, que corresponde a la región conservada amino-terminal más la región variable de la secuencia expuesta en SEC ID Nº 79.
5. Proteína de fusión que comprende un fragmento de polipéptido según la reivindicación 3 o la reivindicación 4.
6. Proteína de fusión que consiste en un fragmento de polipéptido según la reivindicación 4 y una etiqueta de seis histidinas (SEC ID Nº 87) .
7. Vector de expresión que comprende un polinucleótido según la reivindicación 1 unido funcionalmente a una secuencia de control de la expresión.
8. Célula huésped transformada o transfectada con un vector de expresión según la reivindicación 7.
9. Procedimiento de preparación de un polipéptido según la reivindicación 2, que comprende:
cultivar una célula huésped transformada o transfectada con un vector de expresión según la reivindicación 7 en condiciones mediante las cuales se expresa el polinucleótido y se produce el polipéptido; y recuperar el polipéptido.
10. Anticuerpo aislado, o fragmento de unión a antígeno del mismo, que se une específicamente al polipéptido de SEC ID 79, opcionalmente siendo dicho anticuerpo un anticuerpo monoclonal, por ejemplo un anticuerpo humano o un anticuerpo que se ha humanizado.
11. Anticuerpo según la reivindicación 10, en el que dicho anticuerpo se selecciona de entre el grupo que consiste en:
(i) un anticuerpo neutralizante contra dicho polipéptido; y
(ii) un anticuerpo que bloquea la interacción entre dicho polipéptido y un receptor tipo Toll, opcionalmente en el que dicho receptor tipo Toll es TLR5.
12. Proteína de fusión, que comprende al menos un polipéptido según la reivindicación 2.
13. Procedimiento ex vivo de estimulación y/o expansión de células T específicas para una proteína bacteriana
entérica, por ejemplo una proteína de flagelina, que comprende poner en contacto células T con al menos un componente seleccionado de entre el grupo que consiste en:
(a) polipéptidos según la reivindicación 2;
(b) polinucleótidos según la reivindicación 1; y
(c) células presentadoras de antígeno que expresan un polinucleótido según la reivindicación 1, en unas condiciones y durante un tiempo suficiente para permitir la estimulación y/o la expansión de células T.
14. Procedimiento según la reivindicación 13, en el que dichas células T son células T CD4+, en el que opcionalmente dichas células T CD4+ pueden mediar una disminución de una inflamación en el colon.
15. Composición, que comprende un primer componente seleccionado de entre el grupo que consiste en portadores fisiológicamente aceptables y un segundo componente seleccionado de entre el grupo que consiste en:
(a) polipéptidos según la reivindicación 2
(b) polinucleótidos según la reivindicación 1;
(c) anticuerpos según la reivindicación 10;
(d) proteínas de fusión según la reivindicación 12;
(e) células presentadoras de antígeno según se define en la reivindicación 13 (c) , y
(f) células presentadoras de antígeno que expresan un polipéptido según la reivindicación 2.
16. Composición según la reivindicación 15, que comprende además un inmunoestimulante, en la que opcionalmente dicho inmunoestimulante es un adyuvante seleccionado de entre el grupo que consiste en un adyuvante incompleto de Freund; adyuvante completo de Freund; adyuvante 65 de Merck; AS-1, AS-2; gel de hidróxido de aluminio; fosfato de aluminio; una sal de calcio, hierro o zinc; una suspensión insoluble de tirosina acilada, azúcares acilados; polisacáridos derivados catiónica o aniónicamente; polifosfacenos; microesferas biodegradables; monofosforil lípido A, QS21, 4-fosfatos de aminoalquil-glucosaminida y Quil A.
17. Procedimiento de detección de la presencia de una enfermedad inflamatoria del intestino en un mamífero, que comprende las etapas siguientes:
(a) poner en contacto una muestra biológica obtenida de dicho mamífero que comprende anticuerpos con un polipéptido según la reivindicación 2;
(b) detectar en la muestra una cantidad de anticuerpo que se une al polipéptido; y
(c) comparar la cantidad de anticuerpo unido con un valor de corte predeterminado y a partir de ello, determinar la presencia de una enfermedad inflamatoria del intestino en el mamífero.
18. Procedimiento según la reivindicación 17, en el que dicho polipéptido comprende un polipéptido de flagelina.
19. Procedimiento para diagnosticar una enfermedad inflamatoria del intestino (EII) , que comprende las etapas siguientes:
(a) poner en contacto una muestra biológica obtenida de un mamífero con un polipéptido según la reivindicación 2;
(b) detectar en la muestra una cantidad de anticuerpo que se une al polipéptido; y
(c) comparar la cantidad de anticuerpo unido con un valor de corte predeterminado y a partir de ello diagnosticar que el mamífero presenta EII.
20. Procedimiento ex vivo de estimulación y/o expansión de células B que producen anticuerpos específicos para una proteína bacteriana entérica, que comprende poner en contacto células B con al menos un componente seleccionado de entre el grupo que consiste en:
(a) polipéptidos según la reivindicación 2; y
(b) polinucleótidos según la reivindicación 1;
en unas condiciones y durante un tiempo suficiente para permitir la estimulación y/o la expansión de células B.
21. Procedimiento según la reivindicación 20, en el que dichas células B producen anticuerpos seleccionados de entre el grupo que consiste en:
(i) anticuerpos que se unen a una proteína de flagelina, en el que opcionalmente dichos anticuerpos son anticuerpos neutralizantes contra dicha proteína de flagelina; y
(ii) anticuerpos que bloquean la interacción entre una proteína de flagelina y un receptor tipo Toll, en el que opcionalmente dicho receptor tipo Toll comprende TLR5.
22. Composición según la reivindicación 15 o la reivindicación 16, para su utilización en el tratamiento de una inflamación gastrointestinal asociada con una enfermedad inflamatoria del intestino en un mamífero, pudiendo dicha composición estimular una respuesta inmunitaria en dicho mamífero.
23. Composición según la reivindicación 22, en la que dicha respuesta inmunitaria comprende células T que producen una citocina seleccionada de entre el grupo que consiste en interleucina 10 (IL-10) , interleucina 4 (IL-4) , interleucina 5 (IL-5) y factor de crecimiento transformante beta (TGF ) , produciendo preferentemente dichas células T IL-10 y/o TGF .
24. Procedimiento de identificación de antígenos bacterianos asociados con una enfermedad inflamatoria del intestino en un mamífero, que comprende las etapas siguientes:
(a) poner en contacto una muestra biológica obtenida de dicho mamífero que comprende células T con al menos un componente seleccionado de entre el grupo que consiste en:
(i) polipéptidos según la reivindicación 2;
(ii) polinucleótidos según la reivindicación 1; y
(iii) células presentadoras de antígeno que expresan un polinucleótido según la reivindicación 1;
en unas condiciones y durante un tiempo suficiente para permitir la estimulación y/o la expansión de células T;
(b) detectar en la muestra la magnitud de dicha estimulación y/o expansión de células T; y
(c) comparar la magnitud de dicha estimulación y/o expansión con un valor de corte predeterminado, y a partir de ello, identificar antígenos bacterianos asociados con una enfermedad inflamatoria del intestino en el mamífero.
25. Procedimiento según la reivindicación 24, en el que dicho mamífero es un ratón, en el que opcionalmente dicho ratón es de una cepa seleccionada de entre el grupo que consiste en C3H/HeJ Bir, BALB/c IL-10 -/-, B6 IL-10 -/-, B10 IL-10 -/-, MDR1a -/-, TCRa -/-, IL-2 -/-, IL-2R -/-, ratones con colitis inducida por DSS (dextrano-sulfato de sodio) , Gaai -/- y ratones transgénicos CD45 RB, siendo preferentemente dicho ratón de la cepa C3H/HeJ Bir.
26. Procedimiento de monitorización de la progresión de una enfermedad inflamatoria del intestino en un mamífero, que comprende las etapas siguientes:
(a) poner en contacto una muestra biológica obtenida de dicho mamífero que comprende anticuerpos con un polipéptido según la reivindicación 2;
(b) detectar en la muestra una cantidad de anticuerpo que se une al polipéptido; y
(c) repetir las etapas (a) y (b) utilizando una muestra biológica obtenida del mamífero en un punto temporal posterior; y
(d) comparar la cantidad de anticuerpo unido en la etapa (b) con la cantidad de anticuerpo unido en la etapa (c) y a partir de ello, monitorizar la progresión de una enfermedad inflamatoria del intestino en el mamífero.
27. Procedimiento según la reivindicación 17 o la reivindicación 19, en el que dicha muestra biológica se selecciona de entre el grupo que consiste en sueros, heces, tejido u otro material obtenido mediante colonoscopia, tejido u otro material obtenido mediante ileoscopia, tejido u otro material obtenido mediante esofagogastroduodenoscopia (EGP) , y tejido u otro material obtenido mediante cirugía.
28. Kit de diagnóstico, que comprende:
(a) al menos un anticuerpo según la reivindicación 10 y un reactivo de detección, en el que el reactivo de detección comprende un grupo indicador; o 5
(b) al menos uno o más polipéptidos según la reivindicación 2 y un reactivo de detección que comprende un grupo indicador y opcionalmente inmovilizado sobre un soporte sólido.
29. Kit según la reivindicación 28, en el que el reactivo de detección comprende un anticuerpo anti-inmunoglobulina, 10 proteína G, proteína A o una lectina.
30. Kit según la reivindicación 28, en el que el grupo indicador se selecciona de entre el grupo que consiste en grupos radiactivos, grupos fluorescentes, grupos luminiscentes, enzimas, biotina y tintes.
31. Composición inmunogénica que comprende un polipéptido según la reivindicación 2, un antígeno y un portador adecuado.
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]