COMPOSICIONES LIPÍDICAS TERNARIAS NO LAMINARES.
Una composición en partículas que comprende: a) al menos 50% de al menos un anfífilo formador de estructura seleccionado de fosfolípidos,
glicolípidos, y diglicéridos, b) 2 a 40% de al menos un anfífilo dilatador de estructura seleccionado de polioxietilen-éteres de alquilo, ésteres de ácido graso con polioxietilen-sorbitán, polioxietilen-ésteres de ácido graso, derivados de polioxietilen-aceite de ricino o derivados lipídicos de polioxietileno, y c) 2 a 20% de al menos un anfífilo polímero estabilizante de dispersión seleccionado de poloxámeros, PEG-dioleato de glicerol, PEG-ésteres de ácido graso o PEG-fosfolípidos, en donde todas las partes se dan en peso con respecto a la suma de los pesos de a+b+c y en donde la composición comprende partículas no laminares o forma partículas no laminares cuando es puesta en contacto con un fluido acuoso
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/000202.
Solicitante: CAMURUS AB.
Nacionalidad solicitante: Suecia.
Dirección: Ideon, Gamma 1, Sölvegatan 41 223 70 Lund.
Inventor/es: TIBERG,FREDRIK, JOHNSSON,MARKUS.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Enero de 2005.
Clasificación PCT:
- A61K38/11
- A61K9/127 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
Clasificación antigua:
- A61K38/11
- A61K9/127 A61K 9/00 […] › Liposomas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
PDF original: ES-2356920_T3.pdf
Fragmento de la descripción:
La presente invención se refiere a la protección, estabilización, solubilización y suministro de agentes activos en composiciones farmacéuticas y nutracéuticas. En particular, la invención se refiere a composiciones y formulaciones anfifílicas, y a sistemas de suministro de agente activo basadas en éstas. 5
Las formulaciones basadas en anfífilos presentan un potencial considerable para el suministro de muchas sustancias, en especial para el suministro in vivo al organismo humano o animal. Gracias a que el anfífilo tiene tanto grupos polares como grupos apolares, que se agrupan para formar regiones polares y apolares, puede solubilizar eficazmente compuestos tanto polares como apolares. Además, muchas de las estructuras formadas por anfífilos/agentes estructurantes en disolventes polares y/o apolares tienen una superficie muy considerable de límite 10 polar/apolar en el que se pueden adsorber y estabilizar otros compuestos anfifílicos.
La formación de regiones no laminares en los diagramas de fase anfífilo/agua, anfífilo/aceite y anfífilo/aceite/agua es un fenómeno bien conocido. Tales fases incluyen fases cristalinas líquidas tales como la fases P cúbica, D cúbica, G cúbica y hexagonal, que son fluidas a nivel molecular, pero muestran un significativo orden de largo alcance, y la fase "esponja" L3 que comprende una red bicontinua tridimensional múltiplemente interconectada 15 de láminas bicapa que carecen del orden de largo alcance de las fases cristalinas líquidas. Dependiendo de su curvatura, estas fases pueden ser descritas como normales (con curvatura media hacia la región apolar) o invertidas (con curvatura media hacia la región polar). Cuando la curvatura espontánea del sistema lipídico es próxima a cero, las estructuras son típicamente laminares, por ejemplo vesículas/liposomas uni- o multilaminares, y allí donde la curvatura espontánea es más negativa o positiva, dominan típicamente fases micelares, cúbicas y hexagonales. 20
Las fases cristalinas líquidas no laminares y L3 son sistemas termodinámicamente estables. Es decir, no son simplemente un estado metaestable que se va a separar y/o reconfigurar en capas, fases laminares o similares, sino que son la forma termodinámicamente estable de la mezcla.
Se han estudiado tanto sistemas laminares como no laminares en cuanto a sus propiedades como vehículos y/o excipientes para agentes dietéticos, cosméticos, nutricionales, de diagnóstico y farmacéuticos, pero se 25 piensa que los sistemas no laminares presentan ventajas considerables en términos de su elevada superficie específica interna entre regiones polares y apolares. Esto ha conducido a una notable investigación sobre las fases no laminares, en particular en formulaciones de liberación controlada y para solubilizar compuestos de solubilidad relativamente baja.
Tal como se ha discutido más arriba, una fase no laminar voluminosa es típicamente un sistema 30 termodinámicamente estable. Además, esta fase voluminosa puede estar dispersada en un disolvente polar o no polar, para formar partículas de una fase no laminar (especialmente cristalina líquida) en un disolvente principal. Esto permite que las ventajas de las fases no laminares voluminosas se apliquen en situaciones en las cuales el uso de una fase no miscible voluminosa originaría problemas, por ejemplo en aplicaciones parenterales. Mediante una dispersión semejante de partículas no laminares también se puede conseguir un control adicional del perfil de 35 liberación de un compuesto.
La fase cristalina líquida o L3 puede estar en equilibrio termodinámico, o cerca del mismo, con el disolvente en exceso, y puede estar dispersada en forma de dispersiones coloidalmente estables de partículas no laminares. Tales partículas pueden ser completamente (es decir, termodinámicamente) estables, o bien se pueden degradar gradualmente, proporcionando de este modo control sobre el perfil de liberación para agentes activos formulados 40 junto con las mismas. La formación de dispersiones puede ser espontánea o bien como resultado de una fuerza mecánica tal como la cizalladura o los ultrasonidos. Estas partículas no laminares tienen un notable interés en el suministro de agentes activos, y han sido propuestas como vehículos para muchos de tales agentes activos.
En el documento US 5,531,925 se describe un método para formar partículas dispersadas de fase no laminar en disolventes tales como agua. Tales partículas tienen una fase interior cristalina líquida no laminar o L3 y 45 una fase superficial laminar o L3, y pueden contener también ingredientes activos. Los documentos US 6482517, US 6537575 y WO 95/34287 describen diversas composiciones que contienen lípidos.
Se pueden formar partículas conocidas con fase interior cristalina líquida o L3 mediante métodos tales como añadir a esta fase una disolución de agente formador de fase superficial, agitar para formar una dispersión gruesa y fragmentar la mezcla resultante. 50
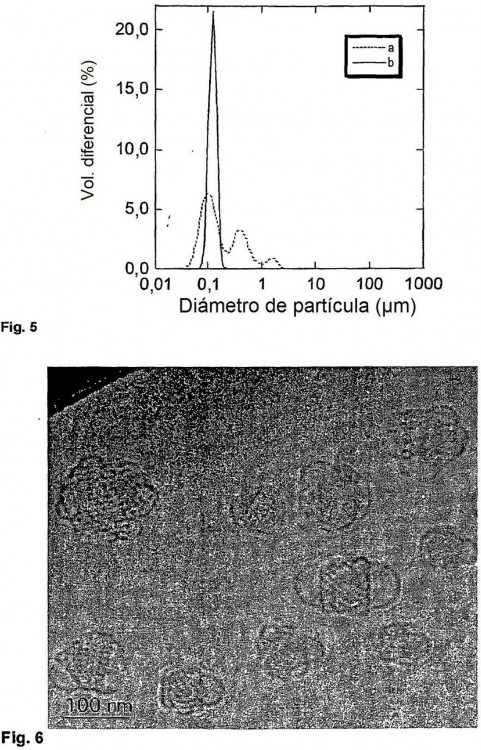
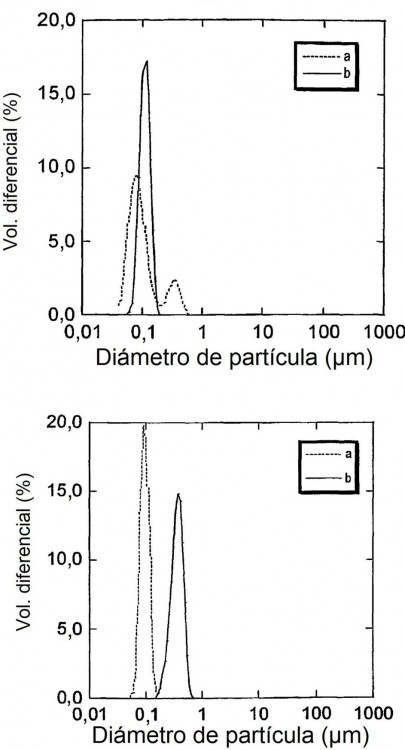
Para evaluar la presencia de una fase cristalina líquida, se puede examinar el potencial material cristalino líquido mediante el uso de difracción de rayos X de pequeño ángulo (siglas inglesas SAX), criomicroscopía electrónica de transmisión (siglas inglesas cryo-TEM) o estudios de espectroscopía de resonancia magnética nuclear (siglas inglesas NMR). Los tamaños y distribuciones de tamaño de las partículas dispersadas pueden ser examinados mediante dispersión luminosa, en particular mediante el empleo de instrumentos de dispersión de luz 55 láser.
Las dispersiones que contienen ingredientes activos y en particular aquellas destinadas a la administración intravenosa al organismo humano o animal son deseablemente coloidales, es decir, deben tener un tamaño de partícula no superior a 10 µm, en especial no superior a 5 µm y en particular no superior a 1 µm. Si hay partículas dentro de la suspensión que superen este tamaño, entonces la dispersión puede no ser coloidalmente estable y existe un riesgo considerable de provocar embolias cuando se administra por vía intravenosa la preparación. 5 Además, es deseable que la distribución de tamaño de partícula sea estrecha para maximizar el control sobre la liberación de cualquier agente activo. Cuando una composición en partículas ha de ser administrada por un método distinto de la vía intravenosa (por ejemplo por vía oral, intramuscular, subcutánea, rectal, o por inhalación), entonces no se requiere que las partículas sean necesariamente coloidales, pero sigue siendo ventajoso proporcionar una distribución de tamaño de partícula bien caracterizada y reproducible con el fin de controlar la velocidad de 10 descomposición de las partículas y/o de liberación de los agentes activos.
El tamaño de partícula de una composición en partículas debería también ser estable frente el almacenamiento durante un período prolongado de tiempo. Si la distribución de tamaño de partícula cambia significativamente, entonces la velocidad de transporte eficaz para la composición (por ejemplo debida a la difusión y la velocidad de liberación de cualquier agente activo) puede verse afectada adversamente. Es aún más preocupante 15 la estabilidad de los tamaños de partícula en una dispersión coloidal para administración intravenosa. Si la distribución de tamaño de partícula de una dispersión semejante no es estable (por ejemplo frente al almacenamiento y la distribución), entonces se pueden formar con el tiempo partículas grandes que pueden resultar peligrosas cuando se administra. Incluso aunque no sea directamente peligrosa, la inestabilidad durante el almacenamiento puede provocar una variabilidad significativa en la farmacocinética, dinámica y/o eficacia. 20
Además del control sobre el tamaño de partícula, es deseable maximizar la proporción de partículas que se encuentran en la fase no laminar deseada, a fin de maximizar los efectos beneficiosos de ésta en términos de capacidad de carga, encapsulación protectora, liberación controlada, reproducibilidad, etc. Por tanto, debe minimizarse la proporción de partículas laminares tales como vesículas uni- o multi-laminares.
Los métodos conocidos para la formación de partículas dispersadas de fase no laminar son sumamente 25 eficaces, pero típicamente producen una distribución de tamaño de partícula relativamente ancha y una proporción considerable de partículas vesiculares laminares "contaminantes".
Para estrechar la distribución de tamaño de partícula se pueden emplear el aumento de la proporción... [Seguir leyendo]
Reivindicaciones:
1. Una composición en partículas que comprende:
a) al menos 50% de al menos un anfífilo formador de estructura seleccionado de fosfolípidos, glicolípidos, y diglicéridos,
b) 2 a 40% de al menos un anfífilo dilatador de estructura seleccionado de polioxietilen-éteres de alquilo, ésteres 5 de ácido graso con polioxietilen-sorbitán, polioxietilen-ésteres de ácido graso, derivados de polioxietilen-aceite de ricino o derivados lipídicos de polioxietileno, y
c) 2 a 20% de al menos un anfífilo polímero estabilizante de dispersión seleccionado de poloxámeros, PEG-dioleato de glicerol, PEG-ésteres de ácido graso o PEG-fosfolípidos,
en donde todas las partes se dan en peso con respecto a la suma de los pesos de a+b+c y en donde la composición 10 comprende partículas no laminares o forma partículas no laminares cuando es puesta en contacto con un fluido acuoso.
2. Una composición según la reivindicación 1 en donde los componentes anfifílicos comprenden al menos 50% en peso de anfífilos que tienen una solubilidad acuosa inferior a 10-9 M a 25°C, con respecto al peso total de componentes a+b+c. 15
3. Una composición según la reivindicación 1 en donde los componentes anfifílicos comprenden al menos 70% en peso de anfífilos que tienen una solubilidad acuosa inferior a 10-9 M a 25°C, con respecto al peso total de componentes a+b+c.
4. Una composición según cualquiera de las reivindicaciones 1 a 3 en donde dichas partículas no laminares comprenden fase L3 y/o fase hexagonal invertida. 20
5. Una composición según cualquiera de las reivindicaciones 1 a 4 que comprende adicionalmente al menos un agente activo.
6. Una composición según cualquiera de las reivindicaciones 1 a 5 en donde el componente a) comprende un lípido catiónico a un nivel de 1-10% en peso y la composición comprende adicionalmente al menos un agente activo de ácido nucleico. 25
7. Una composición según cualquiera de las reivindicaciones 1 a 6 en donde dichas partículas no laminares tienen un tamaño de partícula de 10 a 200 µm.
8. Una composición según cualquiera de las reivindicaciones 1 a 7 en donde dichas partículas no laminares son coloidales.
9. Una composición según la reivindicación 8 en donde dichas partículas no laminares son estables, tanto 30 en términos de comportamiento de fase como de tamaño de partícula, frente al almacenamiento a temperatura ambiente durante al menos 10 días.
10. Una composición según cualquiera de las reivindicaciones 1 a 9 que es no hemolítica hasta una concentración de 0,2% de anfífilo total.
11. Una composición según cualquiera de las reivindicaciones 1 a 10 que es no hemolítica hasta una 35 concentración de 1% de anfífilo total.
12. Una formulación farmacéutica que comprende al menos una composición según cualquiera de las reivindicaciones 1 a 11 y al menos un vehículo o excipiente biológicamente tolerable.
13. Un kit apropiado para establecer una formulación biológicamente tolerable de un agente activo, en donde dicho kit comprende al menos una composición según cualquiera de las reivindicaciones 1 a 4. 40
Patentes similares o relacionadas:
Unidad de dosificación farmacéutica sólida de desintegración oral que contiene una sustancia de control del parto, del 19 de Noviembre de 2018, de Oxytone Bioscience B.V: Unidad de dosificación farmacéutica sólida de desintegración oral que tiene un peso entre 50 y 1000 mg, dicha unidad de dosificación que consiste en: * 1-100% […]
COMPOSICIÓN VETERINARIA PARA LA FABRICACIÓN DE UN ADITIVO SEMINAL ÚTIL PARA INSEMINACIÓN ARTIFICIAL EN ANIMALES, del 7 de Junio de 2018, de UNIVERSIDAD DE LEON: Composición veterinaria para la fabricación de un estimulante seminal útil para inseminación artificial en animales. La presente invención se refiere a una composición para la […]
Sistema terapéutico transdérmico para la administración de péptidos, del 16 de Mayo de 2018, de LTS LOHMANN THERAPIE-SYSTEME AG: Sistema terapéutico transdérmico (TTS) para la administración de un péptido sobre la piel tratada de forma ablativa de un paciente que comprende una capa […]
Desmopresina bucodispersable para aumentar el periodo inicial de sueño ininterrumpido por nicturia, del 18 de Abril de 2018, de FERRING B.V.: Una composición que comprende desmopresina para su uso en tratar un paciente masculino que tiene nicturia o poliuria nocturna que reduce el número de evacuaciones […]
Composición farmacéutica de disolución rápida, del 9 de Agosto de 2017, de FERRING B.V.: Envase de blíster sellado que comprende una composición farmacéutica como formas de dosificación unitarias sólidas en depresiones del envase de blíster, comprendiendo […]
Composición farmacéutica de carbetocina, del 14 de Junio de 2017, de FERRING B.V.: Una composición acuosa que comprende carbetocina o una sal farmacéuticamente activa de la misma; en donde la composición comprende desde 0,05 mg/ml a 0,5 mg/ml de carbetocina […]
COMPOSICIÓN VETERINARIA PARA LA FABRICACIÓN DE UN ADITIVO SEMINAL ÚTIL PARA INSEMINACIÓN ARTIFICIAL EN ANIMALES, del 17 de Abril de 2017, de UNIVERSIDAD DE LEON: Composición veterinaria para la fabricación de un estimulante seminal útil para inseminación artificial en animales. La presente invención se refiere a una composición […]
Composiciones de lípidos y péptidos catiónicos, del 29 de Marzo de 2017, de CAMURUS AB: Una composición que comprende al menos un agente activo peptídico catiónico que tiene un punto isoeléctrico por encima de 7,0, al menos un anfífilo formador de estructura […]