COMPOSICIONES INTRANASALES.
Una composición para suministro nasal que comprende granisetrón o una sal farmacéuticamente aceptable del mismo y quitosano,
una sal, un derivado o una sal de un derivado del mismo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2004/005043.
Solicitante: ARCHIMEDES DEVELOPMENT LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: ALBERT EINSTEIN CENTRE, NOTTINGHAM SCIENCE & TECHNOLOGY PARK, UNIVERSITY BOULE NOTTINGHAM NG7 2TN REINO UNIDO.
Inventor/es: WATTS,PETER,JAMES,WEST PHARMACEUTICAL SERVICES, SMITH,ALAN,WEST PHARMACEUTICAL SERVICES, CASTILE,JONATHAN,WEST PHARMACEUTICAL SERVICES.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Noviembre de 2004.
Fecha Concesión Europea: 17 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K31/435 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con un nitrógeno como único heteroátomo de un ciclo.
- A61K9/00M14
Clasificación PCT:
- A61K31/435 A61K 31/00 […] › que tienen ciclos con seis eslabones con un nitrógeno como único heteroátomo de un ciclo.
- A61K47/36 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P1/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 1/00 Medicamentos para el tratamiento de trastornos del tracto alimentario o del aparato digestivo. › para las náuseas, cinetosis o vértigos; Antieméticos.
Clasificación antigua:
- A61K31/435 A61K 31/00 […] › que tienen ciclos con seis eslabones con un nitrógeno como único heteroátomo de un ciclo.
- A61K47/36 A61K 47/00 […] › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/08 A61K 9/00 […] › Soluciones.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P1/08 A61P 1/00 […] › para las náuseas, cinetosis o vértigos; Antieméticos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357607_T3.pdf
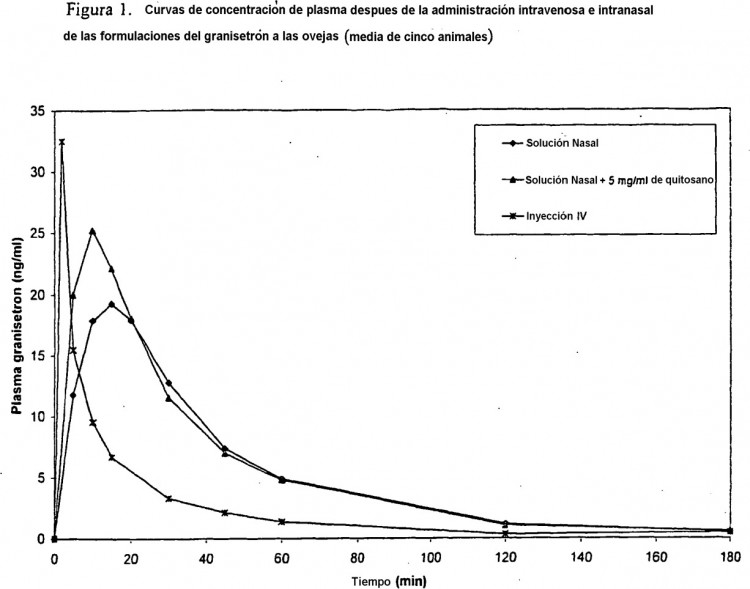
Fragmento de la descripción:
Esta invención se refiere a composiciones farmacéuticas para la administración intranasal de los compuestos granisetrón y sus sales farmacéuticamente aceptables.
El granisetrón (peso molecular 312.4) es 1-metil-N-(9-metil-9-azabiciclo[3.3.1]non-3-il)-1H-indazole-3-carboxamida y tiene la siguiente estructura. 5
El granisetrón es un antagonista de los receptores de la serotonina de tipo 5-HT3 y tiene actividad antiemética. Se cree que el granisetrón actúa mediante la unión de los receptores en la zona gatillo quimioreceptora y, probablemente, el tracto gastrointestinal superior (ver paginas G86-G90, Therapeutic Drugs, Dollery (ed), 2nd edition, Churchill Livingstone, Edinburgh, 1999). 10
El granisetrón es normalmente administrado terapéuticamente como la sal de hidrocloruro (MW 348.9), pero las dosis son usualmente expresadas en términos de la base (1 mg de base es equivalente a 1.12 mg de sal de hidrocloruro).
Para el tratamiento de náuseas y vómitos inducidos por quimioterapia o radioterapia citotóxica, la dosis oral normal de un adulto es de 1 a 2 mg hasta una hora antes que comience 15 la terapia, luego 2 mg diarios en 1 o 2 dosis divididas. Mediante inyección intravenosa, la dosis en USA es de 10 g/kg en adultos y niños. Para la prevención o tratamiento de la náusea post operatoria y vómitos en adultos, un dosis de 1 mg se da por infusión intravenosa (dosis max. 2 mg en un día) (Martindale, The Complete Drug Reference, 33rd Edition, Pharmaceutical Press 2002, paginas 1227 y 1228). 20
Tanto las náuseas o los vómitos alteran la absorción de los fármacos administrados por vía oral. Seria ventajoso proporcionar el granisetrón para la administración a través de una vía que evite los problemas asociados con la administración de fármacos por vía oral. La presente invención trata de abordar este problema.
Los presentes inventores han descubierto que la vía de administración intranasal puede 25 ser ventajosa para el granisetrón y puede ofrecer beneficios significativos comparados con la administración a través de la vía oral. En particular, se encontró que la vía de administración intranasal puede ser ventajosa en el tratamiento o prevención de náuseas y/o vómitos.
La administración intranasal del granisetrón ha sido descrita en CN 1452964 y CN 1452965. 30
La presente invención proporciona una composición para el suministro nasal que comprende el granisetrón o una sal farmacéuticamente aceptable del mismo y quitosano, una sal, un derivado o una sal de un derivado del mismoo.
El granisetrón puede ser usado como base libre o en forma de una sal farmacéuticamente aceptable. Adecuadas sales farmacéuticamente aceptables incluyen, pero 5 no se limitan a, sales de hidrocloruro, mesilato, citrato, nitrato, lactato, maleato, tartrato, fosfato, succinato, fumarato y gluconato. Preferentemente se utiliza hidrocloruro de granisetrón.
Cuando se produce una composición que contiene una sal de granisetrón, la sal apropiada puede ser usada o la base de granisetrón puede ser disuelta in situ en un acido adecuado. 10
La composición puede estar en cualquier forma adecuada para el suministro nasal. Formas adecuadas incluyen soluciones acuosas y no acuosas y polvos.
En un aspecto, la presente invención proporciona una solución acuosa que comprende el granisetrón o una sal farmacéuticamente aceptable del mismo, que es adecuado para el suministro nasal. 15
Las soluciones acuosas de la presente invención preferiblemente comprenden el granisetrón o una sal farmacéuticamente aceptable del mismo en una concentración de 0.2 a 150 mg/ml (expresado como la base libre) (por ejemplo de 1 a 5 mg/ml), más preferentemente de 0.5 a 125 mg/ml (por ejemplo de 2 a 125 mg/ml) y más preferentemente de 1 a 100 mg/ml (por ejemplo de 5 a 100 mg/ml). Por lo tanto, cuando el granisetrón es usado en la forma de la 20 sal de hidrocloruro, la concentración de hidrocloruro de granisetrón es preferentemente de 0.22 a 168 mg/ml (por ejemplo 1.1 a 168 mg/ml), más preferentemente de 0.56 a 140 mg/ml (por ejemplo de 2 a 140 mg/ml) y más preferentemente de 1.12 a 112 mg/ml (por ejemplo de 6 a 112 mg/ml).
La viscosidad de las soluciones acuosas de la presente invención es preferentemente 25 menos de 250 centipoise (cp), más preferentemente menos de 200 cp y más preferentemente menos de 150 cp.
Las soluciones acuosas de la presente invención son preferentemente isotónicas o casi isotónicas. La osmolalidad de las soluciones es preferentemente de 0.15 a 0.45 osmol/kg, más preferentemente de 0.20 a 0.40 osmol/kg y más preferentemente de 0.25 a 0.35 osmol/kg, por 30 ejemplo unos 0.29 osmol/kg.
La osmolalidad de las soluciones acuosas puede ser ajustada al valor deseado mediante la adición de cualquier agente de ajuste de la osmolalidad adecuada conocida en la materia. Los agentes que pueden ser usados para el ajuste de la osmolalidad incluyen, pero no se limitan a polioles tales como el manitol o serbitol, azúcares tales como la dextrosa o sales 35 tales como el cloruro de sodio. Los agentes preferidos para el ajuste de la osmolalidad de las
soluciones acuosas son cloruro de sodio y manitol. Estos agentes pueden ser usados solos o en combinación.
Las soluciones acuosas de la invención preferentemente tienen un pH de unos 3 a 8, más preferentemente de 3.5 a 7.5 y más preferentemente de 4.0 a 7.0. El pH de las soluciones puede ser ajustado al valor deseado usando cualquier acido orgánico o inorgánico adecuado o 5 base orgánica o inorgánica. Los ácidos orgánicos adecuados incluyen, pero no se limitan a, acido acético, acido cítrico, acido glutámico y acido metano sulfónico. Los ácidos inorgánicos adecuados incluyen, pero no se limitan a, acido clorhídrico y acido sulfúrico. Las bases orgánicas adecuadas incluyen, pero no se limitan a, meglumina, lisina y trometamina (TRIS). Las bases inorgánicas adecuadas incluyen, pero no se limitan a, hidróxido de sodio e hidróxido 10 de potasio. Alternativamente, o en adición, un sistema buffer puede ser incluido en las composiciones con el fin de ajustar y mantener el pH. Los ejemplos de sistemas buffer adecuados incluyen, pero no se limitan a, dihidrogenofosfato de sodio/hidrogenofosfato de potasio, citrato de sodio/acido cítrico y acido cítrico/fosfato de sodio.
Las soluciones acuosas de la invención adicionalmente comprenden quitosano, una sal 15 o derivado de quitosano o sal de un derivado de quitosano.
El quitosano es un biopolímero catiónico que comprende glucosamina y N-acetil glucosamina que tiene propiedades bioadhesivas y ha sido demostrado que mejora la biodisponibilidad sistémica de ciertos compuestos farmacéuticos a través de las superficies mucosas tales como la cavidad nasal (ver Illum, Drug Discovery Today, 7, 1184-1189. 2002). 20
Por el termino “quitosano” incluimos todos los derivados de la quitina, o poli-N-acetil-D-glucosamina, incluyendo todas las poli-glucosaminas y oligómeros de materiales de glucosamina de diferentes pesos moleculares, en los cuales la mayor proporción de los grupos N-acetil han sido eliminados por hidrólisis (desacetilación). Según la presente invención, el grado de desacetilación, el cual representa la proporción de grupos N-acetil que han sido 25 eliminados a través de desacetilación, debe preferentemente estar en el rango de 40-97%, más preferentemente en el rango de 60-96% y más preferentemente en el rango de 70-95%.
El quitosano, derivado de quitosano o sal usada en la presente invención debe preferentemente tener un peso molecular en el rango de 10,000 a 1,000,000 Da, más preferentemente en el rango de 15,000 a 750,000 Da y más preferentemente en el rango de 30 20,000 a 500,000 Da.
Las sales del quitosano son adecuadas para uso en la presente invención. Son adecuadas sales con varios ácidos orgánicos e inorgánicos. Tales sales adecuadas incluyen, pero no se limitan a las sales de nitrato, fosfato, glutamato, lactato, citrato, hidrocloruro y acetato. Sales preferidas son las sales de acido clorhídrico y acido glutámico. 35
Los derivados de quitosano y sus sales son también adecuados para su uso en esta invención. Los derivados de quitosano adecuados incluyen, pero no se limitan a, esteres, éteres u otros derivados formados mediante la unión de grupos acil y/o alquil con los grupos hidroxil, pero no los grupos amino de quitosano. Ejemplos... [Seguir leyendo]
Reivindicaciones:
1. Una composición para suministro nasal que comprende granisetrón o una sal farmacéuticamente aceptable del mismo y quitosano, una sal, un derivado o una sal de un derivado del mismo.
2. Una composición de acuerdo a la reivindicación 1 en la forma de una solución o un polvo. 5
3. Una composición de acuerdo a la reivindicación 2 en la forma de una solución acuosa.
4. Una composición de acuerdo a cualquiera de las reivindicaciones precedentes que comprende una sal de granisetrón seleccionada de las sales hidrocloruro, mesilato, citrato, nitrato, lactato, maleato, tartrato, fosfato, succinato, fumarato y gluconato.
5. Una composición de acuerdo a la reivindicación 4, donde la sal es la sal hidrocloruro. 10
6. Una composición de acuerdo a cualquiera de las reivindicaciones precedentes, que está en la forma de una solución y que comprende de 0.2 a 150 mg/ml de granisetrón (expresada como la base libre).
7. Una composición de acuerdo a la reivindicación 6, que comprende de 1 a 100 mg/ml de granisetrón (expresado como la base libre). 15
8. Una composición de acuerdo a cualquiera de las reivindicaciones precedentes teniendo una osmolidad desde 0.15 a 0.45 osmol/kg.
9. Una composición de acuerdo a cualquiera de las reivindicaciones precedentes teniendo un pH de 4.0 a 7.0.
10. Una composición de acuerdo a cualquiera de las reivindicaciones precedentes, 20 comprendiendo de 0.5 a 50 mg/ml de quitosan.
11. Una composición de acuerdo a la reivindicación 10, que es una solución acuosa y comprende de 1 a 112 mg/ml de hidrocloruro de granisetrón y 2 a 10 mg/ml de quitosan glutamato.
12. Una composición de acuerdo a cualquiera de las reivindicaciones 1, 2 y 4 a 10, en la 25 forma de una solución no acuosa.
13. Una composición de acuerdo a la reivindicación 12, que comprende al menos uno de etanol, propileno glicol, polietileno glicol, glicofurol, bencil benzoato y un polioxietileno derivado de aceite de ricino.
14. Una composición de acuerdo a cualquiera de las reivindicaciones 1, 2 y 4 a 10, en la 30 forma de un polvo.
15. Una composición de acuerdo a la reivindicación 14, donde el polvo contiene gránulos o microesferas
16. Una composición de acuerdo a la reivindicación 14 o 15, que comprende 30 a 70% en peso de granisetrón (expresada como la base libre). 35
17. Una composición de acuerdo a cualquiera de las reivindicaciones 1 a 16 para la administración nasal a un paciente en necesidad de la misma.
18. Una composición de acuerdo a una de las reivindicaciones 1 a 16 para uso en el tratamiento o prevención de náuseas y/o vómito.
19. El uso de grasinetrón o una sal farmacéuticamente aceptable del mismo y quitosan, una 5 sal, un derivado o sal de un derivado del mismo en la fabricación de un medicamento para administración nasal a un paciente en necesidad del mismo.
20. Uso de acuerdo a la reivindicación 17, en la fabricación de un medicamento para el tratamiento o prevención de náuseas y/o vómito.
21. Un dispositivo de suministro de medicamento nasal o un cartucho de dosis para uso en 10 un dispositivo de suministro nasal de medicamento que comprende una composición como se define en cualquiera de las reivindicaciones 1 a 18.
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Compuestos de 2-oxo-1,2-dihidropiridin-3-carboxamida y su uso como inhibidores de PDK1, del 20 de Mayo de 2020, de International Society for Drug Development S.r.l: Un compuesto de 2-oxo-1,2-dihidropiridin-3-carboxamida de Fórmula (I) **(Ver fórmula)** en donde m es 0 o 1 n es 0 o 1 A se selecciona […]
Derivados de isoindolin-1-ona como actividad del modulador alostérico positivo del receptor M1 muscarínico colinérgico para el tratamiento de la enfermedad de Alzheimer, del 20 de Mayo de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto representado por la fórmula (I): **(Ver fórmula)** , en donde R1 es un grupo fenilo, un grupo cicloalquilo C5-6, un grupo […]
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]
Compuestos de atropisómeros tricíclicos, del 15 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o una de sus sales, en la que: las dos líneas de puntos representan dos enlaces sencillos o dos […]
Nuevos inhibidores de bromodominios bicíclicos, del 11 de Marzo de 2020, de Zenith Epigenetics Ltd: Compuesto de Fórmula IIb' o Fórmula IId': **(Ver fórmula)** o un estereoisómero, tautómero, sal farmacéuticamente aceptable o hidrato del mismo, en el que: los […]
Compuestos de aminopiridina sustituidos con heteroarilo, del 26 de Febrero de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o una de sus sales, en donde: HET es un heteroarilo seleccionado entre oxazolilo, […]