Composiciones farmacéuticas de liberación sostenida que comprenden aplindore y sus derivados.
Una formulación farmacéutica de liberación controlada que comprende aplindore o una sal farmacéuticamenteaceptable de este;
yuno o más polímeros controladores de la velocidad de liberación u otros materiales que retardanla liberación seleccionados entre hidroxipropilmetilcelulosas que forman una matriz de elevada viscosidad,hidroxipropilmetilcelulosas que forman una matriz de baja viscosidad o combinaciones de las mismasdonde dicho compuesto o dicha sal se liberan a una velocidad eficaz para proporcionar una Cmáx que sea menos de0,75 veces la Cmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/036013.
Solicitante: WYETH LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE GIRALDA FARMS MADISON, NJ 07940 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BENJAMIN, ERIC JOEL, DULIN,WENDY,ANN, LIN,YANNING, ZHUANG,KAI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/407 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas heterocíclicos, p. ej. ketorolac, fisostigmina.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
- A61P25/16 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Medicamentos contra el Parkinson.
- A61P25/18 A61P 25/00 […] › Antipsicóticos, es decir, neurolépticos; Medicamentos para el tratamiento de la esquizofrenia o de las fobias.
PDF original: ES-2405404_T3.pdf
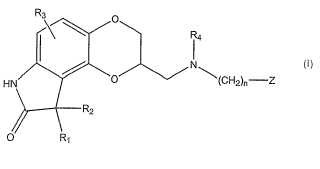
Fragmento de la descripción:
Composiciones farmacéuticas de liberación sostenida que comprenden aplindore y sus derivados
CAMPO DE LA INVENCIÓN
Esta invención está relacionada con formulaciones de liberación sostenida de compuestos dopaminérgicos, que incluyen S-2-[ (bencilamino) -metil]-2, 3, 8, 9-tetrahidro-7H-1, 4-dioxino[2, 3-e]indol-8-ona (aplindore) y sales farmacéuticamente aceptables de este.
ANTECEDENTES DE LA INVENCIÓN
Se ha publicado que los compuestos que tienen la estructura 2- (aminometil) -2, 3, 8, 9-7H-4-dioxino[2, 3-e]-indol-8-ona tienen una actividad significativa sobre el receptor de dopamina, así como la capacidad de modular la síntesis de dopamina. Remítase a la patente de los EE. UU. n.° 5.756.532, incorporada en la presente en su totalidad por referencia a todos los efectos. Estos compuestos son útiles en el tratamiento y la prevención de una variedad de trastornos dopaminérgicos entre los que se incluyen la esquizofrenia, el trastorno esquizoafectivo, los síntomas de la enfermedad de Parkinson, el síndrome de Tourette, la psicosis en la enfermedad con cuerpos de Lewis, la psicosis en la enfermedad de Alzheimer, la hiperprolactinemia, la drogodependencia y la manía aguda en los trastornos bipolares. Se ha identificadoel potente y selectivo agonista parcial de D2/D3 aplindore (S-2-[ (bencilamino) -metil]2, 3, 8, 9-tetrahidro-7H-1, 4-dioxino[2, 3-e]indol-8-ona) como un tratamiento para pacientes esquizofrénicos.
La administración de aplindore da lugar a concentraciones iniciales de fármaco altas. Tal patrón de “liberación inmediata” puede presentar dificultades, que incluyen la incapacidad para mantener niveles de exposición óptimos en el tiempo y efectos secundarios desagradables derivados de tener una dosis inicial demasiado alta. Por consiguiente, es sumamente necesario disponer de formulaciones de liberación controlada de aplindore capaces de incrementar el Tmáx y/o disminuir la Cmáx sin reducir la exposición global al fármaco. Esta invención se dirige a estos, así como a otros, objetivos importantes.
El documento US 6350773 describe combinaciones terapéuticas de aplindore y neurolépticos para el tratamiento o prevención de trastornos psicóticos. El documento US 2001/0008903 describe entre otros compuestos, compuestos de dioxinoindol y tienozbenzodioxina que pueden tener un recubrimiento entérico en ciertas formulaciones.
COMPENDIO DE LA INVENCIÓN
En algunas realizaciones, la presente invención proporciona formulacionesfarmacéuticas de liberación controlada que comprenden S-2-[ (bencilamino) -metil]-2, 3, 8, 9-tetrahidro-7H-1, 4-dioxino[2, 3-e]indol-8-ona (aplindore) o una sal farmacéuticamente aceptable de este:
En algunas realizaciones preferidas de cada una de las formulacionesfarmacéuticas de liberación controladadescritas en la presente, el compuesto es fumarato de aplindore.
En algunas realizaciones, la formulaciónfarmacéutica de liberación controlada es una formulación farmacéuticaoral.
En algunas realizaciones, la formulación comprende una o más micropartículas, que pueden ser, por ejemplo, gránulos, perlas, comprimidos, esferoides o combinaciones de dos o más de estos.
En algunas realizaciones de las formulaciones farmacéuticas de liberación controlada orales de la invención, el compuesto se libera de dicha forma farmacéutica a una velocidad eficaz para aumentar el tiempo necesario para alcanzar la concentración terapéutica máxima (esto es, Tmáx) en comparación con el Tmáx de la formulación de liberación instantánea, por ejemplo, de modo que el Tmáx de la formulaciónfarmacéutica de liberación controlada sea al menos 1, 5 veces, 2 veces, 2, 5 veces, 3 veces, 4 veces, 5 veces o 5, 5 veces el Tmáx de una formulación de liberación instantánea.
En algunas realizaciones, se libera el compuesto de dicha forma farmacéutica a una velocidad eficaz para disminuir la concentración terapéutica máxima de dicho compuesto (esto es, Cmáx) en comparación con la Cmáx de una formulación de liberación instantánea, por ejemplo, de modo que la Cmáx de la formulación farmacéutica de liberación controlada sea menor que 0, 75 veces, 0.60 veces, 0, 50 veces o 0, 40 veces la Cmáx de una formulación de liberación instantánea.
En algunas realizaciones, el compuesto se libera de la forma farmacéutica a una velocidad eficaz para incrementar la concentración farmacéuticamente eficaz del compuesto en un mamífero en un período de tiempo (esto es, el área bajo la curva de la concentración plasmática (suero o sangre) frente al tiempo, AUC por sus siglas en inglés, tal como AUC0-12) en relación a una formulación de liberación instantánea, por ejemplo, de modo que la AUC0-12 de la formulación farmacéutica de liberación controlada sea al menos 1, 05 veces, 1, 1 veces, 1, 2 veces, 1, 3 veces o 1, 4 veces la AUC0-12 de la formulación de liberación instantánea.
En algunas realizaciones, se libera el compuesto de una forma farmacéutica de 0, 1 mg a una velocidad eficaz para proporcionar un área bajo la curva de la concentración plasmática (suero o sangre) frente al tiempo (AUC) de cero a doce (12) horas (AUC0-12) de 260 pg*h/mL a 2400 pg*h/mL; mientras que para otras realizaciones de este tipo, la AUC0-12 va de 290 pg*h/mL a 1300 pg*h/mL. La AUC puede medirse según se describe en Principles of Drug Action: The Basis of Pharmacology, 3ª ed., W.B. Pratt &P. Taylor, eds., (Churchill Livingstone: Nueva York) , 1990. En algunas realizaciones, 5 mg del compuesto propocionan una AUCee (área bajo la curva en estado estable, de 0 a 12 horas) de 36000 pg*h/mL a 109000 pg*h/mL; mientras que otros proporcionan una AUCee de aproximadamente de 36 000 pg*h/mL a 75 000 pg*h/mL. En algunas realizaciones, 30 mg del compuesto proporcionan una AUC0-12 de 121 000 pg*h/mL a 890 000 pg*h/mL, mientras que otras realizaciones de este tipo proporcionan una AUC0-12 de 170 000 pg*h/mL a 760 000 pg*h/mL.
En algunas realizaciones, el compuesto se libera de una forma farmacéutica de 0, 1 mg a una velocidad eficaz para proporcionar una concentración plasmática (en suero o sangre) máxima (Cmáx) de 40 pg/mL a 190 pg/mL; y en otras realizaciones de este tipo, de 40 pg/mL a 180 pg/mL. Se mide la concentración plasmática máxima según se describe en Principles of Drug Action: The Basis of Pharmacology, 3ª ed., W.B. Pratt & P. Taylor, eds., (Churchill Livingstone: Nueva York) , 1990; Human Pharmacology: Molecular to Clinical, K. Kist, ed. (Mosby-Year Books: Filadelfia) , 1991. En algunas realizaciones, 5 mg del compuesto proporcionan una Cmáx de 4000 pg/mL a 14 000 pg/mL, mientras que en otras realizaciones de este tipo, la Cmáxoscila entre 6000 pg/mL y 12 000 pg/mL. En algunas realizaciones, 30 mg del compuesto proporcionan una Cmáx de 18 000 pg/mL a 110 000 pg/mL; en otras realizaciones de este tipo, la Cmáxoscila entre 20 000 pg/mL y 92 000 pg/mL.
En algunas realizaciones, las dosificaciones se incrementan gradualmente (es decir, valoración) en el tiempo (p.ej., días o semanas) hasta alcanzar la dosificación deseada para evitar o minimizar la severidad de los posibles efectos secundarios tales como náuseas u otras indicaciones de intolerancia por parte del paciente. Por ejemplo, algunas realizaciones de la presente invención estipulan la administración de dosificaciones crecientes de manera gradual, donde la dosis inicial varía de alrededor de 0, 05 mg a alrededor de 0, 4 mg por día. En otras realizaciones, las dosificaciones se aumentan gradualmente durante un período de tiempo hasta una dosis final, y a partir de ese momento se administra a diario esa dosificación u otra mayor, que puede variar por ejemplo, de 2 mg a 75 mg por día. En otras realizaciones, el período de valoración de la dosis para llegar a la dosis final es de al menos 3 días, al menos 5 días, al menos 12 días o al menos 15 días.
En otras realizaciones, un conjunto de formas farmacéuticas de liberación controlada, que comprende una pluralidad de formas farmacéuticas de liberación controlada individuales, donde dos o más de las formas farmacéuticas individuales comprenden diferentes cantidades del compuesto. Las formas farmacéuticas individuales pueden constar de una única unidad de dosis (p.ej., un comprimido o cápsula) , o pueden incluir múltiples unidades de dosis (p.ej., 2 o más comprimidos o cápsulas) . En algunas realizaciones, el conjunto de formulaciones farmacéuticas de liberación controlada tiene 2 o más formas farmacéuticas de liberación controlada individuales que contienen una dosis inicial y una dosis final (donde se administra, a partir de ahí, diariamente la dosis final o una dosis mayor y la dosis final es mayor que la dosis inicial) . Por ejemplo, el conjunto puede contener... [Seguir leyendo]
Reivindicaciones:
1.Una formulación farmacéutica de liberación controlada que comprende aplindore o una sal farmacéuticamente aceptable de este; yuno o más polímeros controladores de la velocidad de liberación u otros materiales que retardan la liberación seleccionados entre hidroxipropilmetilcelulosas que forman una matriz de elevada viscosidad, hidroxipropilmetilcelulosas que forman una matriz de baja viscosidad o combinaciones de las mismas donde dicho compuesto o dicha sal se liberan a una velocidad eficaz para proporcionar una Cmáx que sea menos de 0, 75 veces la Cmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
2.La formulación farmacéutica de liberación controlada de la reivindicación 1, donde dicha formulación es una formulación farmacéutica oral.
3.La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde la hidroxipropilmetilcelulosa que forma la matriz de elevada viscosidad está presente en una cantidad en peso entre el 15% y el 80%.
4.La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicha hidroxipropilmetilcelulosa de elevada viscosidad está presente en una cantidad en peso entre el 25% y el 50%.
5.La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicha hidroxipropilmetilcelulosa que forma la matriz de baja viscosidad está presente en una cantidad en peso entre el 15% y el 80%.
6.La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicha hidroxipropilmetilcelulosa que forma una matriz de baja viscosidad está presente en una cantidad en peso del 20% al 50%.
7.La formulación farmacéutica de liberación controlada oral de la reivindicación 2 que comprende adicionalmente:
una hidroxipropilmetilcelulosa que forma una matriz de elevada viscosidad en una cantidad entre el 20% y el 60% en peso; y una hidroxipropilmetilcelulosa que forma una matriz de baja viscosidad en una cantidad entre el 20% y el 60% en peso.
8. La formulación farmacéutica de liberación controlada oral de la reivindicación 2 que comprende:
una cantidad de aplindore farmacéuticamente eficaz o una sal farmacéuticamente aceptable de este; un excipiente compensador hidrosoluble en una cantidad del 0, 5% al 5% en peso; un excipiente dispersable en agua en una cantidad del 5% al 30% en peso; una hidroxipropilmetilcelulosa que forma una matriz en una cantidad del 20% al 80% en peso; y un lubricante en una cantidad del 0, 1% al 1% en peso.
9. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, que comprende:
una cantidad de aplindore farmacéuticamente eficaz o una sal farmacéuticamente aceptable de este; un excipiente compensador hidrosoluble en una cantidad del 0, 5% al 5% en peso; un excipiente dispersable en agua en una cantidad del 5% al 30% en peso; una hidroxipropilmetilcelulosa que forma una matriz en una cantidad del 25% al 50% en peso; y un lubricante en una cantidad del 0, 1% al 1% en peso.
10. La formulación farmacéutica de liberación controlada oral de acuerdo con las reivindicaciones 8 o 9 en las que la hidroxipropilmetilcelulosa que forma la matriz es una hidroxipropilmetilcelulosa de elevada viscosidad, una hidroxipropilmetilcelulosa de baja viscosidad o una combinación de las mismas.
11. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicho compuesto o dicha sal está presente en una cantidad del 0, 02% al 16% en peso de dicha formulación.
12. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicho compuesto o dicha sal está presente en una cantidad del 0, 02% al 4% en peso de dicha formulación.
13. La formulación farmacéutica de liberación controlada oral de la reivindicación 2 donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad que proporciona un Tmáx que es al menos 1, 5 veces mayor que el Tmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
14. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad que proporciona un Tmáx que es al menos 2 veces mayor que el Tmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
15. La formulación farmacéutica de liberación controlada oral de la reivindicación 2 donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad que proporciona una Cmáx que es inferior a 0, 60 veces la Cmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
16. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad que proporciona una Cmáx que es inferior a 0, 50 veces la Cmáx de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
17. La formulación farmacéutica de liberación controlada oral de la reivindicación 2 donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad eficaz para proporcionar una AUC0-12 que es al menos 1, 05 veces la AUC0-12 de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
18. La formulación farmacéutica de liberación controlada oral de la reivindicación 2, donde dicho compuesto o dicha sal se libera de dicha forma farmacéutica a una velocidad eficaz para proporcionar una AUC0-12 que es al menos 1, 10 veces la AUC0-12 de una formulación de liberación instantánea que contiene dicho compuesto o dicha sal.
19. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 0, 1 mg de dicho compuesto o dicha sal, que proporciona una AUC0-12 entre 260 pg*h/mL y 2400 pg*h/mL.
20. La formulación farmacéutica de liberación controlada de la reivindicación 19 donde dicha AUC0-12 está entre 290 pg*h/mL y 1300 pg*h/mL.
21. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 0, 1 mg de dicho compuesto o dicha sal, que proporciona una Cmáx entre 40 pg/mL y 190 pg/mL.
22. La formulación farmacéutica de liberación controlada de la reivindicación 21, donde dicha Cmáx está entre 40 pg/mL y 180 pg/mL.
23. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 5 mg de dicho compuesto o dicha sal, que proporciona una AUC0-12 entre 36.000 pg*h/mL y 109.000 pg*h/mL.
24. La formulación farmacéutica de liberación controlada de la reivindicación 23, donde dicha AUC0-12 está entre
36.000 pg*h/mL y 75.000 pg*h/mL.
25. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 5 mg de dicho compuesto o dicha sal, que proporciona una Cmáx entre 4.000 pg/mL y 14.000 pg/mL.
26. La formulación farmacéutica de liberación controlada de la reivindicación 25, donde dicha Cmáx está entre 6.000 pg/mL y 12.000 pg/mL.
27. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 30 mg de dicho compuesto o dicha sal, que proporciona una AUC0-12 entre 121.000 pg*h/mL y 890.000 pg*h/mL.
28. La formulación farmacéutica de liberación controlada de la reivindicación 27, donde dicha AUC0-12 está entre
170.000 pg*h/mL y 760.000 pg*h/mL.
29. La formulación farmacéutica de liberación controlada de la reivindicación 1 que contiene 30 mg de dicho compuesto o dicha sal, que proporciona una Cmáx entre 18.000 pg/mL y 110.000 pg/mL.
30. La formulación farmacéutica de liberación controlada de la reivindicación 29, donde dicha Cmáx está entre 20.000 pg/mL y 92.000 pg/mL.
31. La formulación farmacéutica de liberación controlada de la reivindicación 2, donde dicho aplindore o la sal de este está presente en la formulación en una cantidad que proporciona una AUC0-12 que varía entre 260 pg*h/mL y
890.000 pg*h/mL.
32. La formulación farmacéutica de liberación controlada de la reivindicación 31 donde la formulación comprende una única unidad de la forma farmacéutica o múltiples unidades de las formas farmacéuticas.
33. Un conjunto de formas farmacéuticas de liberación controlada, que comprende una pluralidad de formas farmacéuticas de liberación controlada individuales, donde dos o más de dichas formas farmacéuticas individuales comprenden diferentes cantidades de dicho compuesto o dicha sal de la reivindicación 1.
34. El conjunto de formas farmacéuticas de liberación controlada de la reivindicación 33 donde al menos una de dichas formas farmacéuticas de liberación controlada individuales comprende entre 0, 05 mg y 0, 4 mg de dicho compuesto o dicha sal de la reivindicación 1.
35. El conjunto de formas farmacéuticas de liberación controlada de la reivindicación 33 donde dos o más de dichas formas farmacéuticas de liberación controlada individuales se seleccionan entre 0, 05 mg, 0, 1 mg, 0, 2 mg, 0, 25 mg, 0, 3 mg, 0, 4 mg, 0, 5 mg, 0, 6 mg, 0, 75 mg, 1 mg, 1, 5 mg, 2 mg, 3 mg, 4 mg, 5 mg, 6 mg, 8 mg, 10 mg, 11 mg, 12 mg, 13 mg, 14 mg, 15 mg, 16 mg, 17 mg, 20 mg, 23 mg, 24 mg, 25 mg, 26 mg o 30 mg de dicho compuesto o dicha sal.
36. El conjunto de la reivindicación 33 donde las dos o más formas farmacéuticas de liberación controlada individuales contienen diferentes cantidades de dicho compuesto o dicha sal en cantidades que difieran al menos en un diez por ciento, y donde la cantidad de dicho compuesto o dicha sal en las dos o más formas farmacéuticas de liberación controlada individuales diferentes varía entre 0, 05 mg y 30 mg.
37. El conjunto de la reivindicación 36 donde las dos o más formas farmacéuticas individuales diferentes proporcionan una AUC0-12 que varía entre 260 pg*h/mL y 890.000 pg*h/mL.
38. El uso de aplindore en la elaboración de una formulación farmacéutica de liberación controlada de acuerdo con cualquiera de las reivindicaciones 1 a 32 para el tratamiento de un trastorno del sistema dopaminérgico.
39. El uso de aplindore o una sal farmacéuticamente aceptable de este en la elaboración de:
a) una formulación farmacéutica de liberación controlada inicial que comprende aplindore o una sal farmacéuticamente aceptable de este; y
b) al menos otra formulación farmacéutica de liberación controlada que comprende aplindore o una sal farmacéuticamente aceptable de este,
donde la formulación farmacéutica de liberación controlada inicial contiene una cantidad menor de aplindore respecto a las otras formulaciones farmacéuticas de liberación controlada; para el tratamiento de un trastorno del sistema dopaminérgico; comprendiendo dicho tratamiento la administración de a) seguida de continuación la administración de b) .
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Composición que comprende cinamaldehído y cinc, del 8 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Composición que comprende cinamaldehído y cinc para la utilización en la mejora de uno o más de rendimiento cognitivo, cognición, humor o memoria en un […]
Moduladores heteroaromáticos del receptor NMDA y usos de los mismos, del 24 de Junio de 2020, de Cadent Therapeutics, Inc: Un compuesto representado por la Fórmula I **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en el que: los anillos A y B son un sistema heteroaromático […]
Compuesto de tetrahidrooxepinopiridina, del 17 de Junio de 2020, de ASTELLAS PHARMA INC.: Compuesto de fórmula (I) o sal del mismo: **(Ver fórmula)** (en la fórmula, R1 es H o alquilo inferior, R2 es H o CN, uno cualquiera […]
Derivados de indolin-2-ona, del 27 de Mayo de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto de fórmula **(Ver fórmula)** en la que A es fenilo o un grupo heteroarilo de cinco o seis miembros, que contiene […]
Esteroides neuroactivos, composiciones y usos de los mismos, del 29 de Abril de 2020, de Sage Therapeutics, Inc: Un compuesto de la fórmula: **(Ver fórmula)** o sal farmacéuticamente aceptable del mismo.
Régimen de dosificación para dosis olvidadas para ésteres de paliperidona inyectables de acción prolongada, del 22 de Abril de 2020, de Janssen Pharmaceuticals, Inc: Un depósito de palmitato de paliperidona inyectable para su uso en el tratamiento de un paciente con necesidad de tratamiento psiquiátrico seleccionado […]