COMPOSICIÓN Y MÉTODO CINÉTICO DE MEDICIÓN DE LA ACTIVIDAD LIPASA.
La presente invención pertenece al campo de las composiciones químicas utilizadas en métodos de determinación de actividad enzimática.
En particular, la presente invención se encuadra en los métodos cinéticos de determinación de la actividad lipasa que utilizan sustratos sintéticos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200902117.
Solicitante: UNIVERSIDAD DE ALMERIA.
Nacionalidad solicitante: España.
Inventor/es: MOYANO LOPEZ,FRANCISCO, NOLASCO SORIA,HECTOR GERARDO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
Fragmento de la descripción:
Composición y método cinético de medición de la actividad lipasa.
Campo de la invención
La presente invención pertenece al campo de las composiciones químicas utilizadas en métodos de determinación de actividad enzimática. En particular, la presente invención se encuadra en los métodos cinéticos de determinación de la actividad lipasa que utilizan sustratos sintéticos.
Antecedentes de la invención
Los métodos de medición de actividad lipasa existentes en el campo de la técnica requieren el análisis individual de muestras, con procedimientos de múltiples pasos por lo que son difíciles de automatizar. Los métodos conocidos de medición de la actividad lipasa incluyen métodos de punto final y métodos cinéticos con sustratos sintéticos. En ambos métodos, las mezclas de reacción presentan una elevada turbidez debido a la baja solubilidad de los sustratos sintéticos en soluciones acuosas, lo que limita la utilización de estos métodos en la industria alimentaria, química o farmacéutica.
Para posibilitar la cuantificación de la actividad lipasa mediante técnicas espectrofotométricas en el rango visible, los métodos de punto final requieren un paso último de extracción de la solución cromófora. Los métodos cinéticos, en cambio, no han podido adaptarse a técnicas colorimétricas. Las alternativas que existen en el campo de la técnica comprenden el pH Stat (velocidad de consumo de hidróxido para mantener el pH) o pH Shift o pH drop (caída de pH), que tienen el inconveniente de requerir el análisis individual de cada réplica de cada muestra. En 2003 He et al., idearon un método cinético de medición de la actividad esterasa mediante absorbancia de 1-naftol en el rango de luz ultravioleta (He et al., 2003. Arch Insect Biochem Physiol. 54:68-76). Sin embargo, el 1-naftol no es un sustrato específico para lipasas, sino uno general para esterasas, y la medición en UV requiere contenedores especiales como por ejemplo cubetas de cuarzo lo que dificulta la monitorización simultanea de múltiples pruebas.
McKellar et al., diseñaron en 1986 un método de punto final que incluye un ensayo colorimétrico altamente específico para lipasas, pues el sustrato sintético utilizado, el β-naftil caprilato (BNC), presenta un enlace ester entre el ácido caprílico y el β-naftol (BN) que es insensible a la acción de esterasas que no sean lipasas. Sin embargo, este ensayo presenta la desventaja de que las muestras deben centrifugarse para poder medir la actividad por lo que no es posible obtener una medida total de la actividad lipasa en una muestra dada. En 1989, Versaw et al., idearon una mejora de dicho método que presenta más sensibilidad y no requiere la centrifugación de las muestras, por lo que permite la medida de la actividad lipasa total de una muestra. Dicha mejora consiste en la extracción y solubilización del cromóforo (formado por la reacción de Fast Blue BB (FBBB) con el β-naftol liberado en la reacción enzimática del BNC) con un solvente orgánico compuesto por etanol y etil acetato. La adición de dicho solvente produce una mezcla clara, apta para estudios de absorbancia en el visible. Sin embargo, esta medición no es posible de manera cinética debido a que la naturaleza hidrofóbica del sustrato provoca la turbidez de la muestra y hace imprescindible la extracción del cromóforo.
Las lipasas actúan en la interfase grasa-agua por lo cual algunos inventores han intentado generar una emulsión de reactivos mediante la utilización de surfactantes con el objeto de aumentar la superficie de sustrato expuesta a la enzima. Los detergentes no-iónicos han demostrado ser capaces de optimizar la actividad enzimática de lipasas procariotas y eucariotas a concentraciones cercanas a su concentración micelar crítica (CMC) gracias a su habilidad de aumentar la superficie de sustrato expuesta al enzima. Por ejemplo, la utilización de detergentes no-iónicos derivados del polioxietileno, como el Tween 20, consigue máxima actividad enzimática de lipasas procarióticas a concentraciones de entre 0,03-0,25% de la mezcla de reacción. En fuerte contraste, los detergentes aniónicos como los alquil-benceno sulfonatos y los alquil sulfatos han demostrado ser potentes inhibidores de la actividad lipasa incluso a pequeñas concentraciones (Helistö et al., 1998 Enzyme and microbial Technology 23:113-117), por lo que se utilizan en los métodos de punto final previamente a la extracción del cromóforo para detener la reacción (Bardi et al., 1993. J. Inst. Brew. 99: 385-388; He et al., 2003. Arch Insect Biochem Physiol. 54:68-76).
La acción inhibitoria sobre la actividad lipasa de los detergentes aniónicos de debe a su habilidad de producir la desnaturalización del enzima por desestabilización de sus estructuras terciaria y/o cuaternaria. En efecto, esta es la base de la utilización del dodecil sulfato sódico (SDS) para separación de proteínas en las electroforesis en gel de acrilamida (PAGE), debido al poder desnaturalizador de los alquil benceno sulfonatos lineares (LAS) y los aquil sulfatos, como el sodio dodecil sulfato (SDS) considerado el más potente de su clase de detergentes (Anionic surfactants Analytical Chemistry. Surfactant science series. Vol 43. 1992. Marcel Dekker, Inc.). LAS es inhibidor de lipasas procariotas y eucariotas a concentraciones cercanas e inferiores a su CMC (130 μM) (Helistö et al., 1998 Enzyme and microbial Technology 23:113-117). Las
Los inventores de la presente solicitud han descubierto que añadiendo un detergente aniónico a la mezcla de reacción a una concentración por encima de su CMC, en un método cinético para la medición de actividad lipasa, se obtiene una solución clara, apta para técnicas de espectrofotometría en el visible, que no afecta significativamente la actividad enzimática ni provoca una desnaturalización del enzima en el tiempo de reacción establecido y que puede, por tanto, utilizarse en el análisis cinético de la actividad lipasa. Además, los inventores de la presente solicitud han ideado un método de detección o medición de la actividad lipasa que permite la cuantificación simultanea de múltiples muestras de diferente origen en volúmenes micrométricos.
Breve descripción de las figuras
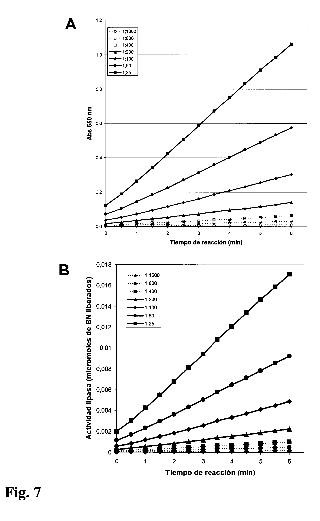
Figura 1: Cinética de actividad lipasa a diferentes concentración del detergente aniónico. La concentración final del substrato BNC y del reactivo cromogénico en la mezcla de reacción final fue de 1 mM. La actividad lipasa se mide como incremento de absorbancia a 550 nm por unidad de tiempo. La actividad lipasa se ve favorecida a concentraciones finales del detergente aniónico superiores a 0,2% (6,9 mM) e igual o inferiores a 0,4% (13,5 mM). En el eje de las ordenadas se expresa la absorbancia a 550 nm y en el eje de las abscisas el tiempo de reacción en minutos. El recuadro superior izquierdo indica concentración final de SDS en % y el recuadro superior derecho la concentración final mM de SDS en los tratamientos.
Figura 2: Cinética de actividad lipasa a diferentes concentraciones del reactivo BNC. La concentración final del reactivo cromogénico en la mezcla de reacción final fue de 1 mM y del detergente aniónico fue de 0,4% (13,5 mM). La actividad lipasa se mide como incremento de absorbancia a 550 nm por unidad de tiempo. La actividad lipasa se ve favorecida a concentraciones finales de 1 mM del substrato BNC. En el eje de las ordenadas se expresa la absorbancia a 550 nm y en el eje de las abscisas el tiempo de reacción en minutos. El recuadro superior izquierdo indica concentración final de BNC (mM) en los tratamientos.
Figura 3 Cinética de actividad lipasa a diferentes concentraciones del reactivo cromogénico. La concentración final del sustrato BNC en la mezcla de reacción final fue de 1 mM y del detergente aniónico fue de 0,4% (13,5 mM). La actividad lipasa se mide como incremento de absorbancia a 550 nm por unidad de tiempo. La actividad lipasa se ve favorecida a concentraciones finales de 1 mM del reactivo cromogénico. En el eje de las ordenadas se expresa la absorbancia a 550 nm y en el eje de las abscisas el tiempo de reacción en minutos. El recuadro superior izquierdo indica concentración final del reactivo cromogénico (mM) en los tratamientos.
Figura 4 Concentración óptima del detergente aniónico, en la mezcla de reacción final, para la actividad lipasa. La actividad lipasa se expresa como la velocidad de generación de color, por la formación...
Reivindicaciones:
1. Composición para la medición cinética (MRC) de la actividad lipasa que comprende:
donde los reactivos A, B y C se mezclan inmediatamente antes de añadir el enzima.
2. Composición según la reivindicación 1 donde el detergente aniónico del reactivo A se elige del grupo formado por el alquil benceno sulfonato linear (LAS), el ácido sulfónico dodecil benceno (DDBSA), el dodecil sulfato sódico (SDS) o mezclas de estos.
3. Composición según la reivindicación 1 o 2 donde el reactivo A comprende dodecil sulfato sódico (SDS).
4. Composición según cualquiera de las reivindicaciones 1-3 donde el reactivo A comprende además alguna sustancia del grupo formado por estabilizadores, emulsionantes, emulgentes, surfactantes, detergentes y mezclas de estos.
5. Composición según la reivindicación 4 donde la sustancia estabilizadora comprende una sal sódica o potásica de un ácido biliar a elegir de entre el ácido cólico, el ácido taurocólico, el ácido taurodeoxicólico y mezclas de estos.
6. Composición según la reivindicación 5 donde la sustancia estabilizadora es el taurocolato de sodio.
7. Composición según cualquiera de las reivindicaciones 1-6 donde el reactivo A está compuesto por:
8. Composición según cualquiera de las reivindicaciones 1-7 donde el reactivo B comprende una disolución de un derivado del naftaleno en un solvente aprotico.
9. Composición según la reivindicación 8 donde dicha disolución es 0,02-3,00 mM β-naftil caprilato en DMSO.
10. Composición según cualquiera de las reivindicaciones 1-9 donde el reactivo C comprende un compuesto azoico.
11. Composición según la reivindicación 10 donde dicho compuesto azoico es la 4-amino-2,5 diethoxybenzanilida (FBBB).
12. Composición según la reivindicación 1 que comprende:
en disolución acuosa a pH 7-12.
13. Método de medición de la actividad lipasa que comprende los pasos de:
Donde la actividad lipasa se expresa en función de la cantidad de producto obtenido por unidad de tiempo.
14. Método según la reivindicación 10 donde la concentración final del detergente aniónico durante la reacción enzimática (b) es menor a 8% SDS (277.41 mM).
15. Kit para la medición cinética de la actividad lipasa en una muestra que comprende la composición según cualquiera de las reivindicaciones 1-12 e instrucciones de uso según el método de cualquiera de las reivindicaciones 13 o 14.
Patentes similares o relacionadas:
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Método mejorado para la determinación de microorganismos, del 6 de Mayo de 2020, de STORA ENSO OYJ: Un método para determinar el contenido de microorganismos en un material que comprende celulosa en la industria de la pulpa y el papel que comprende las etapas de: […]
Procedimiento rápido de detección de enzimas y de microorganismos, del 20 de Noviembre de 2019, de Bio-Rad Europe GmbH: Procedimiento de detección in vitro de una enzima de un microorganismo a partir de una muestra biológica, estando la enzima que se va a detectar seleccionada entre el grupo […]
Método para predecir la respuesta al tratamiento farmacológico con chaperona de enfermedades, del 12 de Junio de 2019, de AMICUS THERAPEUTICS, INC: Un método para recopilar una tabla de tratamiento de referencia que indica la capacidad de respuesta de una o más mutaciones específicas de […]
Método para la prueba de disolución de composiciones sólidas que contienen enzimas digestivas, del 8 de Mayo de 2019, de Allergan Pharmaceuticals International Limited: Un proceso para medir una cantidad de enzimas digestivas liberadas de una composición sólida de pancrelipasa en un medio de disolución que comprende utilizar espectroscopía […]
Método para detectar condiciones bacteriolíticas en una muestra, del 17 de Abril de 2019, de UNIVERSITAT DE BARCELONA: Un método para detectar una condición bacteriolítica seleccionada del grupo que consiste en estrés físico, la presencia de bacteriófagos, la presencia […]
Inhibidores de glicosidasa, del 27 de Febrero de 2019, de MERCK PATENT GMBH: Un medicamento que comprende un compuesto de fórmula (I)**Fórmula** en la que X1 designa S u O; X2, W designan independientemente […]
 Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]
Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]