COMPOSICION FARMACEUTICA SOLIDA QUE COMPRENDE IRBESARTAN.
Una formulación farmacéutica sólida que comprende, como ingrediente activo,
clorhidrato de irbesartan y opcionalmente hidroclorotiazida, manitol, hidroxipropilcelulosa poco sustituida y al menos un lubricante que se selecciona a partir de macrogol, talco y aceite de ricino hidrogenado
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06000329.
Solicitante: KRKA, D.D., NOVO MESTO.
Nacionalidad solicitante: Eslovenia.
Dirección: SMARJESKA CESTA 6,8501 NOVO MESTO.
Inventor/es: ZUPANCIC,SILVO, VRBINC,MIHA, JAKSE,RENATA, BEVEC,FRANCI.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Enero de 2006.
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K31/415 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,2-Diazoles.
- A61K9/20H6B
- A61K9/20H6F2
- A61K9/20K2
Clasificación PCT:
- A61K31/415 A61K 31/00 […] › 1,2-Diazoles.
- A61K9/16 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61P9/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Composición farmacéutica sólida que comprende irbesartan.
Campo de la invención
La invención se refiere a una composición farmacéutica sólida, que comprende como ingrediente activo clorhidrato de irbesartan, solo o combinado con un diurético, es decir hidroclorotiazida, y un procedimiento para su preparación. En particular, se refiere a una composición y un procedimiento en los que el ingrediente activo mantiene su estructura y estabilidad. En un aspecto preferente, la composición no contiene tensioactivos.
Antecedentes de la invención
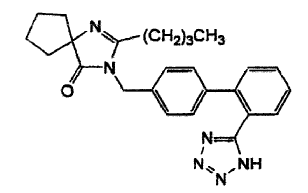
2-Butil-3-[[2'-(1 H-tetrazol-5-il)[1,1'-bifenil]-4-il]metil]-1,3-diazaspiro [4,4] -non:::J.-:-:en-4-ona (irbesartan) es un derivado no peptídico del tetrazol (fórmula empírica C25H28N6O, peso molecular 428,5 g/mol) de la fórmula que se muestra a continuación y presenta actividad antagonista del receptor de angiotensina II de tipo 1 (AT1):
Los procedimientos para la preparación de irbesartan se describen, por ejemplo en los documentos EP 0 454 511, WO 2004/007482, EP 0708 103, EP 1 089 994, SI P-200500004, SI P-200500132 y WO 03/050110.
La preparación de clorhidrato de irbesartan (en lo sucesivo irbesartan-HCl) a partir de por ejemplo irbesartan libre puede ser realizada fácilmente por un experto, y más adelante en el presente documento se describe un ejemplo de un procedimiento adecuado. También se describen procedimientos adecuados en las solicitudes de patente SI P-200400220 y SI P-200400292.
El documento EP 0 454 511 A1 describe una amplia variedad de compuestos heterocíclicos N-sustituidos que incluyen irbesartan y una composición farmacéutica sólida en forma de comprimidos que comprenden estos compuestos. Estos comprimidos también comprenden un vehículo como por ejemplo gelatina, almidón, lactosa, estearato de magnesio, talco y goma arábiga, y puede estar recubierto con sacarosa, un derivado de celulosa u otras sustancias apropiadas.
El documento EP 0 747 050 A1 describe irbesartan en forma de material plumoso que tiene una densidad aparente y una densidad aparente después de vibrar el producto relativamente bajas, lo que hace difícil preparar una formulación con una cantidad sustancial de fármaco (por ejemplo 75-300 mg) en forma de un comprimido pequeño, lo que perjudica a la uniformidad del peso, a la dureza y a otras propiedades deseables de los comprimidos. La definición de irbesartan que se aporta en esta referencia incluye sus sales farmacéuticamente aceptables sin definirlas en detalle. Las composiciones preferentes comprenden, entre otras, 20-70% en peso de irbesartan y 0,2-6% en peso de tensioactivo. El procedimiento para la preparación de los comprimidos que se describen en el documento EP 0 747 050 A1 es la granulación acuosa.
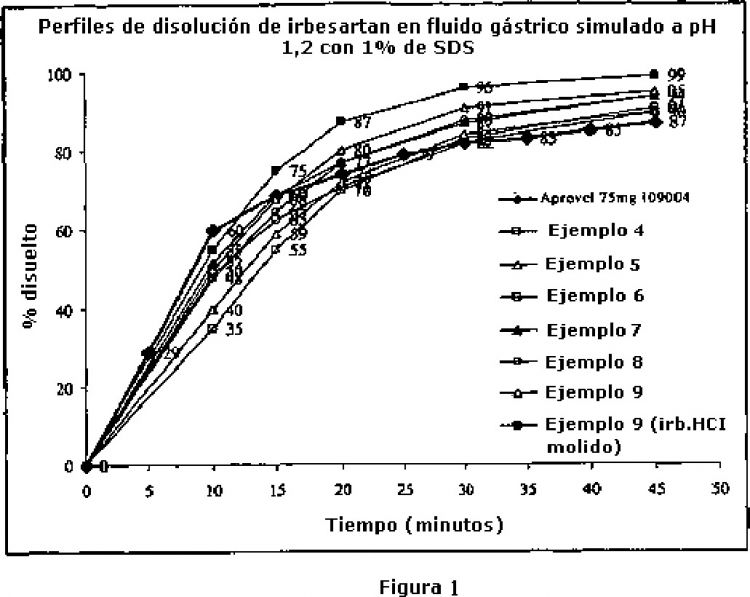
El documento WO 05/025566 se refiere a formulaciones farmacéuticas orales que contienen irbesartan con perfiles de disolución mejorados y, especialmente, con una disolución de 80% o más 15 minutos después de la administración y de 90% o más 30 minutos después de la administración. Para lograr este objetivo, las formulaciones se preparan mediante granulación en húmedo de composiciones que comprenden, entre otros, irbesartan (que se describe como un polvo cristalino blanco que es ligeramente soluble en alcohol y CH2Cl2 e insoluble en agua), alcohol como agente humectante, y otros ingredientes que incluyen un tensioactivo, como por ejemplo poloxámero 188®.
El documento US 2005/0271720 A1 describe composiciones farmacéuticas que comprenden una cantidad relativa alta de irbesartan (>70% en peso) y al menos un excipiente, como por ejemplo un aglutinante, tensioactivo, diluyente, disgregante, antiadherente o lubricante. En una realización preferente, el poloxámero 188® (un tensioactivo) está presente en una cantidad de 1,06-2,0% en peso, y también los ejemplos concretos incluyen este componente.
El documento WO 97/17064 describe una formulación liofilizada farmacéuticamente aceptable constituida por una fase cristalina y una fase amorfa y que incluye al menos un fármaco no proteínico, que además contiene manitol y alanina en una proporción en peso de 0,1:1 a 1:1. Entre una gran variedad de fármacos no proteínicos, se menciona irbesartan como ejemplo de la clase de los antagonistas de angiotensina II.
El documento CN 1415298 se refiere a cápsulas de irbesartan compuestas por irbesartan, hidroclorotiazida, almidón de maíz pregelatinizado, lactosa, celulosa microcristalina, carboximetilcelulosa sódica reticulada, SiO2, estearato de magnesio y polivinilpirrolidona.
El documento US 2005/0019398 A1 se refiere a gránulos para la producción de formas farmacéuticas de fusión ultrarrápida para una gran variedad de agentes activos. Las formas farmacéuticas preparadas, especialmente comprimidos, se desintegran en la boca en menos de veinticinco segundos.
En general, en el pasado, las propiedades físicas y químicas específicas del irbesartan, especialmente su baja solubilidad en medios acuosos, dio lugar a problemas en su formulación en forma de formulaciones adecuadas para una administración oral eficaz. Por lo tanto, existe una necesidad de formulaciones de irbesartan para la administración oral eficaz, que proporcione un tiempo de desintegración apropiado y/o un perfil de solubilidad y/o disolución apropiados del principio activo.
Además, se desea que estos efectos puedan lograrse con una formulación que tenga una capacidad de procesamiento mejorada, y/o contenga excipientes, que fácilmente disponibles con un bajo coste, y/o procedimientos técnicos económicamente preferentes para su preparación.
Sumario de la invención
Por consiguiente, la presente invención proporciona una formulación farmacéutica sólida que comprende, como principio activo, clorhidrato de irbesartan, manitol, hidroxipropilcelulosa poco sustituida y al menos un lubricante que se selecciona a partir de macrogol, talco y aceite de ricino hidrogenado.
En las formas farmacéuticas sólidas, se ha demostrado que los tensioactivos mejoran la velocidad de disolución del fármaco. Esto puede deberse a efectos de humectación, que consiguen una mayor área superficial, a efectos sobre la solubilidad y a un coeficiente de difusión eficaz, o a una combinación de estos efectos.
Estas y otras ventajas (por ejemplo mejora de la solubilidad, actividad termodinámica, difusión y desintegración de los tensioactivos) y su influencia sobre la velocidad y la cantidad de absorción de los fármacos son conocidas de forma general. De acuerdo con un aspecto preferente de la presente invención, sin embargo, se ha encontrado sorprendentemente que puede omitirse el uso de un tensioactivo si hay un disgregante presente.
Por lo tanto, en un aspecto preferente, la presente invención tiene como objetivo dar solución a los problemas descritos anteriormente proporcionando formulaciones farmacéuticas, que no contienen un tensioactivo.
De acuerdo con otro aspecto adicional preferente, las formulaciones de la invención comprenden, como ingrediente activo, clorhidrato de irbesartan que tiene un tamaño de partícula medio del ingrediente activo inferior a 250 µm, y un diámetro máximo de 2000 µm.
El ingrediente activo es irbesartan-HCl. Opcionalmente, también se incluye en la formulación un diurético, es decir hidroclorotiazida (HCTZ).
Breve descripción de los dibujos
La Figura 1 representa la comparación de los perfiles de disolución de irbesartan de los comprimidos Aprovel 75 mg (una forma farmacéutica que se comercializa actualmente) y los Ejemplos 4-9 (núcleos de comprimidos (4c)-(9c)) de la presente invención.
Descripción detallada de la invención
En la siguiente descripción, cuando se hace referencia a irbesartan se pretende incluir irbesarlan-HCl, si no se indica explícitamente lo contrario.
Las formulaciones farmacéuticas sólidas de la invención comprenden clorhidrato de irbesartan como principio activo, manitol, hidroxipropilcelulosa poco sustituida y al menos un lubricante que se selecciona a partir de macrogol, talco y aceite de ricino hidrogenado.
El clorhidrato de irbesartan puede estar presente en forma cristalina o en una forma no cristalina.
Las formas cristalinas incluyen formas anhidras o hidratadas, preferentemente sesquihidratos, como por ejemplo...
Reivindicaciones:
1. Una formulación farmacéutica sólida que comprende, como ingrediente activo, clorhidrato de irbesartan y opcionalmente hidroclorotiazida, manitol, hidroxipropilcelulosa poco sustituida y al menos un lubricante que se selecciona a partir de macrogol, talco y aceite de ricino hidrogenado.
2. La formulación de la reivindicación 1, en la que el clorhidrato de irbesartan tiene un tamaño medio de las partículas inferior a 250 µm.
3. La formulación de cualquiera de las reivindicaciones precedentes, en la que el clorhidrato de irbesartan tiene un diámetro máximo de 2000 µm.
4. La formulación de cualquiera de las reivindicaciones precedentes, en la que el clorhidrato de irbesartan está presente en una cantidad de 20-77% en peso, basándose en el peso total de la formulación.
5. La formulación de cualquiera de las reivindicaciones precedentes, en la que la hidroxipropilcelulosa poco sustituida está presente en una cantidad de 1-30% en peso, basándose en el peso total de la formulación.
6. Una formulación farmacéutica sólida de acuerdo con cualquiera de las reivindicaciones precedentes, caracterizada porque no contiene tensioactivos.
7. Un procedimiento para la fabricación de una formulación como se define en cualquiera de las reivindicaciones 1-6, que es un procedimiento de granulación en húmedo (A) que comprende las siguientes etapas:
8. El procedimiento de la reivindicación 7, en el que se añade hidroclorotiazida como ingrediente activo adicional en la etapa (ii), en cualquiera de las etapas (a1) y/o (a2), (b1) y/o (b2), y (c1) y/o (c2).
9. Un procedimiento para la fabricación de una formulación como se define en cualquiera de las reivindicaciones 1-6, que es un procedimiento de granulación directa (B) que comprende las siguientes etapas:
10. El procedimiento de la reivindicación 9, en el que se añade hidroclorotiazida como ingrediente activo adicional en la etapa (ii)'.
11. El procedimiento de cualquiera de las reivindicaciones 7-10, que además comprende la etapa de
Patentes similares o relacionadas:
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Inhibidores de btk de tipo nicotinimida sustituida y su preparación y uso en el tratamiento del cáncer, la inflamación y las enfermedades autoinmunitarias, del 15 de Julio de 2020, de Guangzhou InnoCare Pharma Tech Co., Ltd: Un compuesto seleccionado del grupo que consiste en: 6-(1-acriloilpiperidin-4-il)-2-(4-fenoxifenil)nicotinamida; **(Ver fórmula)** 6-(4-acriloilpiperazin-1-il)-2-(4-fenoxifenil)nicotinamida; […]
Conjugados de ligadores (ADCs) con inhibidores de KSP, del 24 de Junio de 2020, de Bayer Pharma Aktiengesellschaft: Conjugado de un ligador o un derivado del mismo con una o varias moléculas de principio activo, en donde la molécula de principio activo es un inhibidor de la proteína del huso […]
Moléculas químicas que inhiben el mecanismo de corte para tratar enfermedades causadas por anomalías de empalme, del 17 de Junio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Un compuesto elegido entre el grupo que comprende: • N-(3-Dimetilamino-propil)-3-(4-trifluorometoxi-fenilamino)-benzamida; • 4-(4-Metoxi-fenilamino)-3-metil-N-(3-metil-butil)-benzamida; […]
COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE LA COMBINACIÓN DE UN INHIBIDOR SELECTIVO DE LA CICLOOXIGENASA 2 Y UN CARBAMATO DERIVADO DE LA GUAIFENESINA PARA EL TRATAMIENTO DEL DOLOR, INFLAMACIÓN Y CONTRACTURA MUSCULAR, del 14 de Mayo de 2020, de AMEZCUA AMEZCUA, Federico: La presente invención se refiere a una composición farmacéutica que comprende la combinación sinérgica de un inhibidor selectivo de la ciclooxigenasa ll, como […]
Procedimiento para la fabricación de emulsiones oftálmicas de tipo aceite en agua, del 15 de Abril de 2020, de Santen SAS: Procedimiento para la fabricación de un preconcentrado de una emulsión oftálmica de tipo aceite en agua, comprendiendo dicho procedimiento una […]
Inhibidores de 3,5-diaminopirazol quinasa, del 15 de Abril de 2020, de SMA Therapeutics, Inc: Compuesto de fórmula (II-a): **(Ver fórmula)** o un estereoisómero, enantiómero, mezcla de enantiómeros, mezcla de diastereómeros o variante isotópica de los mismos, o […]