Composición de quetiapina.
Composición farmacéutica de liberación prolongada, que comprende quetiapina o su sal y lambda-carragenina,
en la que la composición se encuentra presente en forma de un comprimido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/005573.
Solicitante: KRKA, TOVARNA ZDRAVIL, D.D., NOVO MESTO.
Nacionalidad solicitante: Eslovenia.
Dirección: SMARJESKA CESTA 6 8501 NOVO MESTO ESLOVENIA.
Inventor/es: PISEK,ROBERT, VRBINC,MIHA, VRECER,FRANC, PAVLI,MATEJ, DREU,ROK, BAUMGARTNER,SASA, PLANINSEK,ODON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/554 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo al menos un nitrógeno y al menos un azufre como heteroátomos de un ciclo, p. ej. clotiapina, diltiazem.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
PDF original: ES-2402342_T3.pdf
Fragmento de la descripción:
Composición de quetiapina.
Campo de la invención La presente invención se refiere a una nueva composición farmacéutica de liberación prolongada que comprende quetiapina y carragenina en forma de un comprimido.
Antecedentes de la invención La quetiapina es un antipsicótico atípico con eficacia establecida en el tratamiento de la esquizofrenia, mostrándose eficaz en el tratamiento de la manía aguda y de la depresión asociada al trastorno bipolar. La quetiapina, como monoterapia o combinada con litio o divalproex sódico (valproato semisódico) , se tolera generalmente bien y es efectiva para reducir los síntomas maníacos en pacientes adultos y adolescentes con manía bipolar aguda, estando aprobada para su utilización en adultos para esta indicación. Como monoterapia, el medicamento es efectivo también para reducir los síntomas depresivos en pacientes con depresión bipolar.
La quetiapina y su sal hemifumarato se dieron primero a conocer en la patente EP240228. Más tarde, se publicaron muchas más solicitudes de patente relacionadas con la quetiapina como EP282236, EP907364, WO9906381, EP1218009, EP1448169, EP1482945, WO2005028457, WO2005041935, WO2007036599, EP1252151.
La carragenina es el hidrocoloide obtenido mediante extracción acuosa, o álcali acuoso, a partir de algunos miembros del tipo Rodoficeas (algas) . La carragenina consta principalmente de ésteres sulfato potásicos, sódicos, cálcicos, magnésicos y amónicos de copolímeros de galactosa y 3, 6-anhidrogalactosa. Estas hexoras se unen alternativamente a-1, 3 y b-1, 4 en el polímero. Los copolímeros habituales en el hidrocoloide se denominan kappa-, iota y lambda-carragenina. Kappa-carragenina es en su mayor parte el polímero alternante de D-galactosa-4-sulfato y 3, 6-anhidro-D-galactosa. Iota-carragenina es similar, excepto porque la 3, 6-anhidrogalactosa está sulfatada en el carbono 2. Entre kappa-carragenina e iota-carragenina existe un continuo de composiciones intermedias que difieren en el grado de sulfatación en el carbono 2. En la lambda-carragenina, las unidades monoméricas alternantes son en su mayor parte D-galactosa-2-sulfato (unidas 1, 3) y D-galactosa-2, 6-disulfato (unidas 1, 4) . El contenido de éster sulfato para la carragenina es del orden del 18 al 40%. Además, contiene sales inorgánicas que se originan de las algas y a partir del procedimiento de recuperación del extracto. La A-carragenina (lambda-carragenina) es un polímero no gelificante que contiene aproximadamente 35% de éster sulfato en peso y no 3, 6-anhidrogalactosa.
El documento WO97/45124 da a conocer una formulación de liberación prolongada de quetiapina, que comprende una matriz hidrofílica que incluye un agente gelificante. El inconveniente de dicha composición es que el nivel de gelificación de la composición, y por tanto, también su tasa de disolución es difícil de controlar, pues sólo depende de factores fisiológicos.
El documento WO03/000293 se refiere a una formulación farmacéutica oral que comprende iota-carragenina, uno o más polímeros gelificantes, y un ingrediente básico farmacéuticamente activo. Las formulaciones farmacéuticas que incluyen quetiapina no son descritas.
El documento WO03/039516 da a conocer un procedimiento para mejorar la disolución de un medicamento que se dispersa escasamente, por ejemplo, fumarato de quetiapina, que comprende la mezcla del medicamento que se dispersa escasamente con un agente flotante y granulando la mezcla. Como agentes flotantes que no son solubles en agua, se mencionan la celulosa, alginato sódico, alginato propilenglicol, polvo de tragacanto o goma xantán.
Breve descripción de las figuras
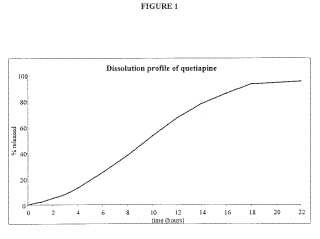
La figura 1 representa un perfil de disolución de quetiapina a partir de los comprimidos según el ejemplo 22.
Descripción detallada de la invención El problema resuelto por la presente invención consiste en proporcionar una composición farmacéutica que supere los inconvenientes anteriores (es decir, control difícil de la tasa de disolución debido al agente gelificante que se encuentre en la formulación) .
La presente invención da a conocer una composición farmacéutica en forma de un comprimido, y los procedimientos para su preparación, que comprenden un sistema matricial sólido de quetiapina o de sus sales, y un agente que no se hincha (es decir, no gelificante) , tal como la carragenina no gelificante. La composición según la presente invención puede prolongar la liberación de quetiapina a partir de la composición 12 horas por lo menos, preferentemente por lo menos 16 horas y muy preferentemente por lo menos, 20 horas.
Las formas de realización preferidas de la invención se describen en las reivindicaciones dependientes.
La composición farmacéutica de la presente invención puede obtenerse llevando a cabo procedimientos conocidos a partir del estado de la técnica, tales como la compresión directa de una mezcla pulverulenta de sustancia activa y de excipientes seleccionados, o la compresión de una mezcla en polvo pregranulada de sustancia activa y de excipientes seleccionados. La granulación puede realizarse mediante procedimientos en seco, procedimientos húmedos o procedimientos calientes de fusión. La granulación en seco puede realizarse mediante procedimientos del estado de la técnica tales como la agitación o la compresión, donde una mezcla en polvo del medicamento y excipientes seleccionados se comprime dando lugar a comprimidos, utilizando equipos tales como un dispositivo de agitación o un rodillo compactador, seguido por el fraccionamiento de los comprimidos obtenidos en gránulos y, opcionalmente, el filtrado de los gránulos. Pueden realizarse procedimientos húmedos de granulación utilizando granuladores tales como un granulador de baja o alta fricción o un granulador de lecho fluido, donde la aglomeración de partículas se obtiene añadiendo un líquido de granulación que contiene un disolvente seleccionado entre agua, disolventes orgánicos tales como alcoholes con uno a cuatro átomos de carbono, o cetonas tales como acetona o ésteres tales como acetato de etilo o sus mezclas, en los que excipientes seleccionados opcionalmente a partir de diluyentes, cementantes, antioxidantes, surfactantes u ácidos orgánicos pueden disolverse, o emulsificarse. La granulación en caliente de fusión puede llevarse a cabo mediante procedimientos del estado de la técnica tales como el alargamiento en caliente de fusión o la granulación de fusión. El alargamiento en caliente por fusión se realiza mediante alargamiento de la mezcla calentafa del polímero de alargamiento, de la sustancia activa, y, opcionalmente, de otros excipientes seleccionados entre carragenina, polímeros aniónicos, ácidos orgánicos, diluyentes o lubricantes, seguido por enfriamiento, triturado y filtrado opcional del extruído obtenido, para conseguir un granulado de la deseada distribución del tamaño de partícula. La granulación de fusión puede llevarse a cabo aglomerando una mezcla pulverulenta de sustancia activa y excipientes seleccionados a partir de carragenina, polímeros aniónicos, ácidos orgánicos y, opcionalmente, otros excipientes seleccionados entre diluyentes, antioxidantes y surfactantes con un cementante fundido con una temperatura de fusión inferior a 130°C, preferentemente inferior a 100°C, y muy preferentem ente inferior a 80°C, mediante procedimientos del e stado de la técnica tales como la granulación mediante fusión en granuladores de alta o baja fricción o de lecho fluido.
Preferentemente, la carragenina es lambda-carragenina y la quetiapina está preferentemente en forma de hemifumarato de quetiapina. Más preferentemente, el hemifumarato de quetiapina es hemifumarato de quetiapina de forma I, tal como se define en el documento WO03/080065.
El principio activo se utiliza preferentemente en forma de polvo, que presenta un tamaño promedio de partícula de 5 a 300 !m.
Las composiciones de la presente invención comprenden preferentemente un % en peso de 10 a 80, más preferentemente de 25 a 55, y muy preferentemente de 30 a 45 de quetiapina. Por ejemplo, las composiciones pueden contener 50, 150, 200, 300, 400, 600 ó 800 mg de quetiapina. Composiciones particularmente preferidas son las que contienen 200 ó 400 mg de quetiapina, preferentemente en forma de hemifumarato de quetiapina.
Las composiciones de la presente invención comprenden preferentemente un % en peso del 5 al 80%, preferentemente de 15 a 65%, y muy preferentemente de 20 a 55% de carragenina no gelificante, preferentemente lambda-carragenina.
Si no se indica de otra forma, todos los porcentajes en la presente memoria son en peso (% peso/peso) y se basan en el peso total de la composición.
Las composiciones... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica de liberación prolongada, que comprende quetiapina o su sal y lambda-carragenina, en la que la composición se encuentra presente en forma de un comprimido.
2. Composición farmacéutica según la reivindicación 1, en la que la quetiapina se encuentra en forma de
hemifumarato de quetiapina. 5
3. Composición farmacéutica según cualquiera de las anteriores reivindicaciones, que comprende además un ácido orgánico.
4. Composición farmacéutica según la reivindicación 3, en la que el ácido orgánico es seleccionado a partir del
grupo constituido por ácido cítrico, ácido fumárico, ácido tartárico, ácido benzoico, ácido málico, ácido ascórbico, ácido succínico y sus mezclas.
5. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende además un polímero aniónico. 15
6. Composición farmacéutica según la reivindicación 5, en la que el polímero aniónico es seleccionado a partir del grupo constituido por ftalato acetato de celulosa, copolímero de ácido metacrílico, succinato acetato de celulosa, ftalato acetato polivinílico, ftalato de hidroxipropilmetil celulosa y/o sus mezclas.
7. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende además polietilenglicol.
8. Composición farmacéutica según la reivindicación 7, en la que el polietilenglicol presenta un peso molecular
comprendido en el intervalo de 4.000 a 8.000. 25
9. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende además manitol.
10. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende
25 a 55% en peso, preferentemente 30 a 45% en peso, de quetiapina, preferentemente en forma de hemifumarato de quetiapina, 15 a 65% en peso, preferentemente 20 a 55% en peso de carragenina no gelificante, preferentemente lambda
carragenina, 35 y opcionalmente 1 a 2% en peso de lubricante, preferentemente estearato de magnesio. basado en el peso total de la composición.
11. Composición farmacéutica según la reivindicación 10, que comprende además: 10 a 40% en peso del diluyente, preferentemente, lactosa, en particular monohidrato de alfa-lactosa, manitol y/o dihidrato de fosfato dicálcico, y/o 45 5 a 15% en peso de ácido orgánico, preferentemente ácido cítrico y/o ácido fumárico, y/o 10 a 35% en peso de polímero aniónico, en particular succinato acetato de HPMC y/o copolímero del ácido metacrílico, y/o 50 12 a 24% en peso de polietilenglicol, en particular polietilenglicol que presenta un peso molecular promedio de 4.000, basado en el peso total de la composición.
12. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, en la que la quetiapina se encuentra en forma de hemifumarato de quetiapina de la forma I cristalina del documento WO03/080065.
13. Composición farmacéutica según cualquiera de las reivindicaciones anteriores, que comprende 50 a 800 mg de quetiapina en forma de hemifumarato de quetiapina. 60
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Preparación para el control del peso corporal a base de quitosano y celulosa, del 1 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Una composición oral sólida que contiene una combinación de quitosano de hongos o levaduras, celulosa amorfa en polvo y opcionalmente excipientes.
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]