Composición de leucocitos activados.
Un método para fabricar una composición de leucocitos activados que comprende:
a. incubar leucocitos humanos a
(i) una temperatura de 12° C - 28° C durante un tiempo que varía de aproximadamente 90 minutosa más de 2, 3, 4, 5, 6, 7, 8, o 12 a 20 horas o
(ii) una temperatura de 12° C - 37° C durante un tiempo que varía de 5-24 horas de manera que losleucocitos hacen la transición de un estado quiescente a un estado funcionalmente activo;
b. someter a los leucocitos a un shock hipo osmótico; y
c. añadir a los leucocitos de la etapa b, una solución de una sal fisiológicamente aceptable en unacantidad eficaz para restaurar la isotonicidad.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2010/000882.
Solicitante: Macrocure, Ltd.
Nacionalidad solicitante: Israel.
Dirección: 9 Bareket Street P.O. Box 7988 Ryat Matalon 49250 Petach Tikva ISRAEL.
Inventor/es: SHIRVAN, MITCHELL, SHINAR,EILAT, FRENKEL,ORIT, ZULOFF-SHANI,ADI, BUBIS,MARINA, BAIN,EILAT, GINIS,IRENE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sangre; Sangre artificial (perfluorocarbonos A61K 31/02; sangre del cordón umbilical A61K 35/51; hemoglobina A61K 38/42).
PDF original: ES-2428102_T3.pdf
Fragmento de la descripción:
Composición de leucocitos activados.
REFERENCIAS CRUZADAS PARA SOLICITUDES RELACIONADAS
La presente solicitud se relaciona con la solicitud de Nº de serie 61/209.298, presentada el 5 de Marzo de 2009, titulada Composición de leucocitos activados y la solicitud de Nº de serie 61/211.587, presentada el 1 de Abril de 2009, titulada Composición de leucocitos activados para insuficiencias vasculares.
Antecedentes de la invención El proceso de cicatrización de una herida envuelve la participación de las células blancas de la sangre, también conocidas como leucocitos. Los leucocitos incluyen linfocitos, granulocitos y monocitos. Tres tipos comunes de linfocitos son las células T, células B y células asesinas naturales. Las células B y las células T juegan un papel importante en el reconocimiento de antígenos en el cuerpo (Parkin, 2001) . Las células asesinas naturales (NK) identifican a las células infectadas por medio de alteraciones en los niveles del complejo de histocompatibilidad mayor (MHC) , y destruyen las células infectadas (Moretta, 2008) . La participación de los linfocitos en el proceso de curación, se asocia en gran medida con su producción de citoquinas y factores de crecimiento (Keen, 2008) . Se ha descrito una nueva clase de células gamma-delta-T en la piel (Jameson, 2002. Havran, 2005) . Entre los diferentes tipos de granulocitos están los neutrófilos, basófilos y eosinófilos. Los monocitos se diferencian en macrófagos, que son responsables de la destrucción de restos de tejido o de las sustancias extrañas invasivas. Los macrófagos también producen moléculas que controlan la inflamación y la reparación (Riches, 1996) .
El proceso de cicatrización de una herida se produce en tres fases superpuestas. (Li, 2007; Broughton, 2006; Tsirogianni, 2006; Singer, 1999; Martin, 1997) . La primera fase es la fase inflamatoria. Se caracteriza por el reclutamiento de neutrófilos, seguidos por monocitos a la zona de la herida, donde matan y fagocitan las bacterias (Agaiby, 1999) .
La segunda fase de cicatrización de una herida que se conoce como la fase proliferativa, implica la formación de nuevo tejido de granulación. Los fibroblastos proliferan y migran hacia el espacio de la herida y sintetizan colágeno y otros componentes de la matriz extracelular (Greiling, 1997) . Al mismo tiempo, se produce la angiogénesis, que proporciona nutrientes y oxígeno al nuevo tejido de granulación metabólicamente activo (Tonnesen, 2000) . Los queratinocitos de la epidermis intacta comienzan a migrar a través de la matriz provisional y comienzan a proliferar, abriendo el camino para el nuevo tejido epitelial (Kim, 1992) .
La remodelación es la tercera y última fase de la cicatrización de una herida. Se caracteriza por la diferenciación de fibroblastos en miofibroblastos, que contraen y acercan los bordes de la herida entre si (Tomasek, 2002) . La remodelación de las fibras de colágeno por degradación y re-síntesis permite que la herida gane fuerza debido a la re-orientación de las fibras de colágeno (un proceso estrechamente controlado por factores de crecimiento) (Werner, 2003) .
El reto del tratamiento de las heridas se complica a menudo en los pacientes con múltiples patologías tales como la diabetes, enfermedad de la arteria coronaria e hipertensión. Estas enfermedades tienen el efecto común de exacerbar las complicaciones vasculares debido a diversas condiciones fisiológicas. Las complicaciones de las heridas pueden resultar en un aumento de la morbilidad y la mortalidad (Doshi, 2008) .
Tratamientos convencionales para las heridas incluyen el desbridamiento quirúrgico, tratamientos con antibióticos, y diversos apósitos (Moran, 2008; Fonder, 2008) . Las heridas resistentes al tratamiento convencional también se conocen como heridas refractarias. Estas heridas conducen a una disminución de la calidad de vida y pueden dar lugar a aumento de la morbilidad y la mortalidad. Por lo tanto, continúa existiendo la necesidad de composiciones y métodos eficaces para la cicatrización de las heridas.
Compendio de la invención
La presente invención se refiere a un método para preparar una composición de leucocitos activados que comprende:
a) incubar los leucocitos humanos (i) a una temperatura de 12° C - 28° C durante un tiempo que varía de aproximadamente 90 minutos a más de aproximadamente 2, 3, 4, 5, 6, 7, 8, o de 12 a 20 horas o (ii) una temperatura de 12º C - 37º C durante un período de tiempo en el intervalo de 5-24 horas de modo que se produzca la transición de los leucocitos en estado quiescente a un estado funcionalmente activo;
b) someter los leucocitos a un choque hipo osmótico; y
c) añadir a los leucocitos de la etapa b) una solución de sal fisiológicamente aceptable en una cantidad efectiva para restaurar la isotonicidad.
Un aspecto de la presente invención se dirige a un método para hacer una composición de leucocitos activados (ALC) derivada de la sangre (es decir, obtenible u obtenida a partir de una muestra de sangre entera) . El método incluye las etapas de someter los leucocitos, que se pueden obtener a partir de una muestra de sangre humana entera, a una primera incubación durante un período de tiempo y a una temperatura que permite que los leucocitos se activen, que en realizaciones preferidas, es de aproximadamente 8 a aproximadamente 20 horas, y a temperatura ambiente. Después de la incubación, se ponen en contacto los leucocitos con una solución acuosa fisiológicamente aceptable, tal como, agua destilada estéril, para iniciar el choque hipo osmótico, seguido de poner en contacto los leucocitos conmocionados con una solución de sal fisiológicamente aceptable para restablecer la isotonicidad. Esta composición de leucocitos activados (ALC) se puede utilizarse terapéuticamente. Sin embargo, en alguna realización, por separado y sustancialmente concurrente con la primera incubación de los leucocitos, una muestra de plasma, que se puede obtener de la misma o diferente muestra de sangre entera (es decir, del mismo o de un ser humano diferente) , se pone en contacto con un agente coagulante a aproximadamente 37° C concurrente con la incubación de los leucocitos, que en realizaciones preferidas, es de aproximadamente 8 a aproximadamente 20 horas, seguido por la separación de suero de la muestra de plasma coagulada. Los leucocitos se re-suspenden en suero recogido de la muestra de plasma coagulada, formando así la ALC. Después de la primera incubación, los leucocitos pueden ser sometidos además a una segunda incubación durante aproximadamente de 60 a aproximadamente 120 minutos a aproximadamente 37° C.
Otro aspecto de la presente invención está dirigido a una ALC derivada de la sangre. La composición de leucocitos activados de la presente invención incluye, en términos de la población de leucocitos presentes en ella, de aproximadamente 40% a aproximadamente 90% de granulocitos, de aproximadamente 5% a aproximadamente 20% de monocitos y de aproximadamente 5% a aproximadamente 30% de linfocitos, basado en el número total de leucocitos en la ALC. Como se muestra en los ejemplos de trabajo, las ALCs de la invención también pueden caracterizarse y distinguirse de las composiciones conocidas en términos del rendimiento mínimo de leucocitos (en relación con la muestra de sangre entera) , la viabilidad de los leucocitos, y los niveles mínimos de activación de granulocitos, por ejemplo, como se indica por CD11b. La ALC puede contener, además, niveles residuales de plaquetas (en cantidades de alrededor de 46, 8 +/- 39, 2 (103/μl) y células rojas de la sangre (en la cantidad de aproximadamente 0, 1 +/- 0, 06 (106/1l) de la ALC. La población de linfocitos puede incluir de aproximadamente 7% a aproximadamente 25% de células B (CD19+) , de aproximadamente 20% a aproximadamente 30% de células NK (CD3- / CD56+) , de aproximadamente 40% a aproximadamente 60% de células T (CD3+) , de aproximadamente 0, 1%, a aproximadamente 30% de células NKT CD3+ / CD56+, de aproximadamente 8% a aproximadamente 20% de células T auxiliares (CD4+ / CD3+) , y de aproximadamente 20% a aproximadamente 30% de células CD8+ / CD3+. Las células pueden suspenderse en un vehículo tal como suero (que puede ser autólogo o alogénico con respecto al receptor) o algún otro líquido fisiológicamente aceptable iso-normal, adecuado para el almacenamiento y la administración de células, tales como la solución utilizada para restablecer la isotonicidad.
La presente invención puede usarse para la promoción de la cicatrización de heridas por medio de la administración o la aplicación de la ALC a una herida.
La invención descrita logra varios resultados inesperados en comparación con al menos una... [Seguir leyendo]
Reivindicaciones:
1. Un método para fabricar una composición de leucocitos activados que comprende:
a. incubar leucocitos humanos a
(i) una temperatura de 12° C - 28° C durante un tiempo que varía de aproximadamente 90 minutos a más de 2, 3, 4, 5, 6, 7, 8, o 12 a 20 horas o
(ii) una temperatura de 12° C - 37° C durante un tiempo que varía de 5-24 horas de manera que los leucocitos hacen la transición de un estado quiescente a un estado funcionalmente activo;
b. someter a los leucocitos a un shock hipo osmótico; y
c. añadir a los leucocitos de la etapa b, una solución de una sal fisiológicamente aceptable en una cantidad eficaz para restaurar la isotonicidad.
2. El método de la reivindicación 1 que además comprende:
poner en contacto una muestra separada de plasma humano con un agente coagulante para obtener suero, en donde los leucocitos y el plasma pueden obtenerse del mismo donante o de donantes diferentes; y mezclar los leucocitos de la etapa c con el suero de la etapa d.
3. El método de cualquiera de las reivindicaciones 1 o 2, en donde los leucocitos se obtienen de un donante que tiene el tipo sanguíneo O negativo y el plasma se obtiene de un donante que tiene el tipo sanguíneo AB positivo.
4. El método de cualquiera de las reivindicaciones 1-3, en donde el shock hipoosmótico comprende poner en contacto los leucocitos con agua, y en donde la solución de sal fisiológicamente aceptable es una solución de cloruro sódico al 0, 9%.
5. El método de cualquiera de las reivindicaciones 1-4, que comprende además incubar los leucocitos en el suero a 37º C.
6. Una composición de leucocitos activados preparada por el método de la reivindicación 1, en donde la composición comprende: a) 40% - 90% de granulocitos;
b) 5% - 20% de monocitos; y c) 5% - 30% de linfocitos.
7. La composición de la reivindicación 6, en donde los granulocitos comprenden: a) 52% - 78% de neutrófilos; b) 1% - 9% de eosinófilos; y c) 1% - 2% de basófilos.
8. La composición de la reivindicación 6 o 7, en donde los linfocitos comprenden: a) 7% - 25% de células B (CD 19+) ; b) 20% - 30% de células NK (CD3- / CD56+) ; c) 40% - 60% de células T (CD3+) ; d) 0% - 30% de células NKT (CD3+ / CD56+) ; e) 8% - 20% de células T auxiliares (CD4+ / CD3+) ; y f) 20% - 30% de células CD8+ / CD3+.
9. La composición de cualquiera de las reivindicaciones 6-8 para su uso como un medicamento.
10. La composición de cualquiera de las reivindicaciones 6-8 para su uso como un agente de curación de heridas.
11. La composición de cualquiera de las reivindicaciones 6-8 para su uso para tratar heridas.
12. La composición para uso según la reivindicación 11, en donde la herida es una úlcera de decúbito, úlcera de presión, úlcera de las extremidades inferiores en un paciente diabético, una herida profunda del esternón, una herida post operatoria, una herida post operatoria refractaria del área del tronco, una herida a la gran vena safena después de la revascularización coronaria y recolección de la gran vena safena, una herida causada por un trauma, una fisura anal, o una úlcera venosa.
13. Un apósito que comprende una composición de una cualquiera de las reivindicaciones 6-8.
14. Una matriz o ensamblaje fisiológicamente inerte y/o reabsorbible que comprende una composición de una cualquiera de las reivindicaciones 6-8.
A Glóbulos rojos empaquetados B Plasma Bolsa 1: agua para dilución (shock hipo osmótico) , 200 ml; Bolsa 2: solución tamponada de cloruro sódico, 20 ml; Bolsa 3: cloruro de calcio tamponado, 60 ml; Bolsa 4: aire, 60 ml; Bolsa 5: aire 30 ml
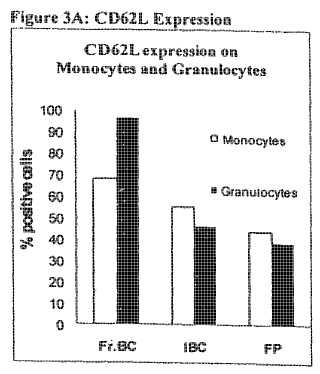
Figura 3A: Expresión de CD62L
Patentes similares o relacionadas:
Sorbente polimérico para la eliminación de impurezas de sangre completa y productos sanguíneos, del 17 de Junio de 2020, de Cytosorbents Corporation: Un método para tratar la sangre y los productos sanguíneos almacenados que maximiza la vida útil y/o minimiza una complicación relacionada con la transfusión […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Composiciones, usos y preparación de lisados de plaquetas, del 27 de Mayo de 2020, de EMORY UNIVERSITY: Una composición que comprende componentes de lisado de plaquetas con una concentración de fibrinógeno de menos de 20 μg/ml.
Procedimiento para obtener células dendríticas inmunoestimulantes, del 4 de Marzo de 2020, de Transimmune AG: Un procedimiento para inducir la diferenciación de monocitos contenidos en una cantidad extracorpórea de una muestra de sangre de sujeto mamífero en células […]
Inmunoterapia mediante la utilización de células capaces de co-expresar un antígeno diana y CD1d y pulsadas con un ligando de CD1d, del 8 de Enero de 2020, de RIKEN: Un inmunoinductor para un antígeno diana, que comprende una célula que co-expresa antígeno diana y CD1d, en donde el antígeno diana y la célula […]
Propiedades inmunomoduladoras de las células progenitoras adultas multipotentes y usos de las mismas, del 25 de Diciembre de 2019, de ABT Holding Company: Células para la utilización en la prevención o tratamiento complementario de un neoplasma benigno de células de médula ósea, un trastorno mieloproliferativo, un […]
Péptidos terapéuticos, del 25 de Diciembre de 2019, de DANA-FARBER CANCER INSTITUTE, INC.: Composición que comprende un anticuerpo o fragmento de anticuerpo que se une inmunoespecíficamente a la secuencia A relacionada con polipéptido de clase I de […]
Tratamiento del cáncer utilizando un receptor de antígeno quimérico anti-CD19 humanizado, del 10 de Diciembre de 2019, de NOVARTIS AG: Dominio de unión anti-CD19 humanizado, en el que dicho dominio de unión anti-CD 19 humanizado comprende una secuencia de aminoácidos de un scFv seleccionada de […]