Composición conjugada de proteína-polisacárido neumococico multivante.
Una composición inmunogénica multivalente, que comprende: 13 conjugados proteicos polisacáridos distintos junto con un vehículo fisiológicamente aceptable,
en la que cada uno de los conjugados comprende un polisacárido capsular de un serotipo diferente de Streptococcus pneumoniae conjugado con una proteína transportadora y los polisacáridos capsulares se preparan a partir de serotipos 1, 3, 4, 5, 6A, 68, 7F, 9V, 14, 18C, 19A, 5 19F y 23F, en el que la proteína transportadora es CRM197.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/012354.
Solicitante: WYETH LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE GIRALDA FARMS MADISON, NJ 07940 ESTADOS UNIDOS DE AMERICA.
Inventor/es: PARADISO, PETER R., HAUSDORFF,William P, SIBER,George Rainer.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/02 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos bacterianos.
- A61K39/09 A61K 39/00 […] › Streptococcus.
- A61K39/295 A61K 39/00 […] › Antígenos virales polivalentes (virus de la viruela o de la varicela A61K 39/285 ); Mezclas de antígenos virales y bacterianos.
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
PDF original: ES-2382048_T3.pdf
Fragmento de la descripción:
Composición conjugada de proteína-polisacárido neumocócico multivalente Campo de la invención La presente invención se refiere, en general, al campo de la medicina y, específicamente a la microbiología, inmunología, vacunas y a la prevención de la infección por un patógeno bacteriano mediante inmunización.
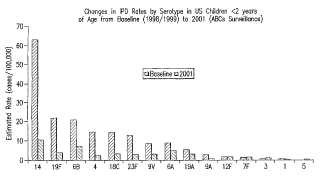
Antecedentes de la invención Streptococcus pneumoniae es una causa principal de meningitis, neumonía y enfermedad invasive grave en lactantes y niños pequeños en todo el mundo. Las vacunas de plosacáridos nuemocócicos multivalentes llevan aprobadas muchos años y se ha demostrado que son valiosas en la prevención de la enfermedad por neumococos en adultos ancianos y pacientes de alto riesgo. Sin embargo, los lactantes y niños pequeños responden mal a la mayoría de los polisacáridos neumocócicos. La vacuna conjugada neumocócica heptavalente (7vPnC, Prevnar®) fue la primera de este tipo que se demostró que era altamente inmunogénica y eficaz contra la enfermedad invasiva y la otitis media en lactantes y niños pequeños. Ahora, esta vacuna está aprobada en muchos países de todo el mundo. Prevnar contiene los polisacáridos capsulares de los serotipos 4, 6B, 9V, 14, 18C, 19F and 23F, cada uno conjugado con una proteína transportadora denominada CRM197. Prevnar cubre aproximadamente el 80-90%, 6080%, and 40-80% de la enfermedad neumocócica invasiva (IPD) en EE.UU., Europa y otras regiones del mundo, respectivamente [1, 2]. Los datos de investigación reunidos en los años posteriores a la introducción de Prevnar han demostrado claramente una reducción de la enfermedad neumocócica invasiva en lactantes de EE.UU. como estaba previsto (FIG. 1) [3, 4].
La investigación de la IPD realizada en lactantes de EE.UU. antes de la introducción de Prevnar demostró que una parte significativa de la enfermedad producida por los serogrupos 6 y 19 se debía a los serotipos 6A (aproximadamente un tercio) y 19A (aproximadamente un cuarto) [5, 6]. La investigación de la enfermedad neumocócica invasiva realizada en EE.UU. tras la aprobación de Prevnar sugiere que una gran carga de la enfermedad se sigue atribuyendo a los serotipos 6A y 19A (FIG. 1) [3]. Además, estos dos serotipos representan más casos de enfermedad invasiva que los serotipos 1, 3, 5, and 7F combinados (8, 2 vs. 3, 3 casos/100.000 niños de 2 años de edad y menores) . Además, los serotipos 6A and 19A se asocian con índices elevados de resistencia a antibióticos (FIG. 2) [7, 8, 9]. Aunque es posible que la protección cruzada por serogrupo tenga como resultado una disminución de la enfermedad por los serotipos 6A and 19A porque más niños están inmunizados, existen pruebas que sugieren qe habrá un límite de la disminución y permanecerá una carga significativa de la enfermedad debido a estos serotipos (véase más adelante) .
Dada La relativa carga e importancia de la enfermedad neumocócica invasiva debida a los serotipos 1, 3, 5, 6A, 7F, y 19A, la adición de estos serotipos a la formulación de Prevnar aumentaría la cobertura de la enfermedad invasiva a > 90 % en EE.UU. y Europa y tan alta como del 70-80 % en Asia y latinoamérica. Esta vacuna ampliaría significativamente lacobertura más allá de la de Prevnar y proporcionaría cobertura para 6A y 19A que no dependen de las limitaciones de la protección cruzada por serogrupo.
Mbelle y col., (1999, J Infect Dis.; 180 (4) :1171-6) divulgan una vacuna conjugada neumocócica nonavalente en la que los serotipos 1, 4, 5, 6B, 9V, 14, 18C, 19F y 23F están conjugados con CRM197.
Hausdorff W. y col., (2000, Clinical Infectious Diseases, 30:100-121) analizaron conjuntos de datos para comparar los serogrupos causantes de la enfermedad neumocócida invasiva (IPD) con los representados en las formulaciones de vacunas conjugadas.
El documento US-A-2001/0048929 divulga una molécula inmunogénica multivalente que comprende una molécula transportadora que contiene al menos un epítopo de células T funcionales y fragmentos oligosacáridos de Streptococcus pneumoniae derivados de al menos dos polisacáridos capsulares de los serotipos de Streptococcus pneumoniae 1, 4, 5, 6B, 9V, 14, 18C, 19F y 23F.
El documento EP-A-0497525 divulga una composición vacunal que comprende polisacárido capsular purificado parcialmente hidrolizado de Streptococcus pneumoniae unido a una proteína transportadora inmunogénica.
El documento WO-A-2004/011027 divulga una molécula para vacuna conjugada quimérica multivalente usada para prevenir o atenuar el estrptococos del grupo B, siendo los polisacáridos capsulares bacterianos del tipo la, tipo Ib, tipo II, tipo III, tipo V y tipo VIII de estreptococos del grupo B.
Fattom y col. (1999, Vaccine pg. 126-133, Vol.17) divulga una reducción de respuestas de anticuerpo a varios serotipos en ratones cuando se comparó la inmunogenicidad de las vacunas conjugadas multivalentes con la inmunogenicidad de cada vacuna monovalente evaluada por separado. Este fenómeno también fue observado Dagan y col., (1998, Infection and Immunity, p.2093-2098) .
Nurkka y col. (2004, Ped. Inf. Dis. J., 23:1008-1014) divulgan un estudio de la inmunogenicidad y seguridad de una vacuna conjugada undecavalente de proteína D neumocócica en la que no se observó efecto de primado para el serotipo 3 en lactantes que habían recibido tres dosis de la vacuna, seguido de una dosis de refuerzo de la misma vacuna o de una vacuna con polisacárido neumocócico.
Gatchalian y col. (2001, 17th Annual Meeting of the Eur. Soc. Paed. Inf. Dis (ESPID) , póster número 4, Sesión 1 Póster P1A, Estambul, Turquía) divulgan los resultados de OPA de lactantes que habían recibido dosis de la vacuna undecavalente no mostraron respuestas de anticuerpo para el serotipo 3 a niveles comparables con otros serotipos analizados.
Wuorimaa y col. (2001, The Paediatric Infectious Disease Journal, Volume 20 (3) , pp 272-277) divulgan un estudio para evaluar la tolerablidad y la inmunogenicidad en niños menores de dos años de edad sanos de una vacuna conjugada neumocócica undecavalente que usa los toxoides del tétanos y la difteria como vehículos.
Anderson P et al, (2003, Vaccine; 21 (13-14) :1554-9) divulgan un estudio comparativo de vacunas conjugadas tetravalentes con cada polisacárido tipos 6A, 14, 19F y 23F acoplados por separado al toxoide del tétanos o a la CRM197 de difteria o una mezcla de la mitad de las dosis del polisacárido tipos 6A, 14, 19F, y 23F acoplados por separado al toxoide del tétanos o a la CRM197 de difteria.
Sumario de la invención De acuerdo con esto, la presente invención proporciona, en general, una composición inmunogénica que comprende 13 conjugados polisacárido-proteína distintos, en los que cada uno de los conjugados contiene un polisacárido capsular de un serotipo distinto de Streptoccocus pneumoniae conjugado a una proteína transportadora, junto con un vehículo fisiológicamente aceptable, en la que la proteína transportadora es CRM197. Opcionalmente en la formulación se induce un adyuvante, como un adyuvante basado en aluminio. Más específicamente, la presente invención proporciona una composición conjugada neumocócica tridecavalente (13vPnC) , que comprende los siete serotipos en la vacuna 7vPnC (4, 6B, 9V, 14, 18C, 19F y 23F) más seis serotipos adicionales (1, 3, 5, 6A, 7F y 19A) .
La presente invención también proporciona una composición inmunogénica multivalente, en la que los polisacáridos capsulares son de los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F de Streptococcus pneumoniae y la proteína transportadora es CRM197.
La presente invención además proporciona una composición inmunogénica multivalente, en la que los polisacáridos capsulares son de los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F de Streptococcus pneumoniae y la proteína transportadora es CRM197 y el adyuvante es un adyuvante basado en aluminio, tal como fosfato de aluminio, sulfato de aluminio e hidróxido de aluminio. En una realización concreta de la invención, el adyuvante es fosfato de aluminio.
La presente divulgación proporciona también una composición inmunogénica multivalente, que comprende conjugados proteicos polisacáridos junto con un vehículo fisiológicamente activo, en la que cada uno de los conjugados comprende un polisacárido capsular de un serotipo diferente de Streptococcus pneumoniae conjugado con una proteína transportadora y los polisacáridos capsulares se preparan con el serotipo 3 y al menos un serotipo adicional.
En una realización... [Seguir leyendo]
Reivindicaciones:
1. Una composición inmunogénica multivalente, que comprende: 13 conjugados proteicos polisacáridos distintos junto con un vehículo fisiológicamente aceptable, en la que cada uno de los conjugados comprende un polisacárido capsular de un serotipo diferente de Streptococcus pneumoniae conjugado con una proteína transportadora y los polisacáridos capsulares se preparan a partir de serotipos 1, 3, 4, 5, 6A, 68, 7F, 9V, 14, 18C, 19A, 19F y 23F, en el que la proteína transportadora es CRM197.
2. La composición inmunogénica de la reivindicación 1, que además comprende un adyuvante.
3. La composición inmunogénica de la reivindicación 2, en la que el adyuvante es un adyuvante basado en aluminio.
4. La composición inmunogénica de la reivindicación 3, en la que el adyuvante se selecciona del grupo que consiste 10 en fosfato de aluminio, sulfato de aluminio e hidróxido de aluminio.
5. La composición inmunogénica de la reivindicación 4, en la que el adyuvante es fosfato de aluminio.
6. La composicición inmunogénica de multivalente de una cualquiera de las reivindicaciones 1 a 5 para su uso como vacuna.
7. Una formulación líquida estéril de polisacáridos capsulares neumocócicos de los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 15 9V, 14, 18C, 19A, 19F, y 23F conjugados individualmente a CRM197 para su uso como vacuna.
8. La formulación líquida estéril de la reivindicación 7, en la que cada dosis de 0, 5 ml está formulada para contener: 2 μg de cada sacárido, a excepción de 6B a 4 μg; aproximadamente 29 μg de la proteína transportadora CRM197; 0, 125 mg de adyuvante de aluminio elemental (0, 5 mg de fosfato de aluminio) ; y los tampones cloruro sódico y succinato sódico como excipientes.
Patentes similares o relacionadas:
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Un nuevo antígeno de vacuna no de VIH de la microbiota vaginal capaz de inducir una respuesta de anticuerpos protectores neutralizadores de la mucosa contra la infección por VIH, del 13 de Mayo de 2020, de B Cell Design: Un antígeno de permeasa de Mycoplasma genitalium o un polinucleótido que codifica dicho antígeno en forma expresable, para su uso en la prevención y/o el tratamiento […]
Composición inmunogénica que comprende antígenos de micoplasma, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Una composición inmunogénica que comprende: a) una vacuna bacteriana inactivada completa de M. hyorhinis y una vacuna bacteriana inactivada completa de M. […]
Composiciones de flagelina y usos, del 6 de Mayo de 2020, de Genome Protection, Inc: Una composición relacionada con la flagelina, comprendiendo la composición una secuencia de aminoácidos que tiene al menos un 95 % de identidad de […]
Una vacuna para usar contra la infección asintomática por Lawsonia en un cerdo, del 6 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una vacuna que comprende antígeno de Lawsonia intracellularis no vivo y un vehículo farmacéuticamente aceptable para usar en un método para reducir en un cerdo el impacto negativo […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones de vacunas contra el síndrome reproductivo y respiratorio porcino y las enfermedades asociadas al circovirus porcino, del 29 de Abril de 2020, de Reber Genetics Co., Ltd: Una proteína de fusión que comprende: (a) un dominio de unión a células presentadoras de antígeno (APC) ubicado en el N-terminal de la proteína de fusión, en la […]