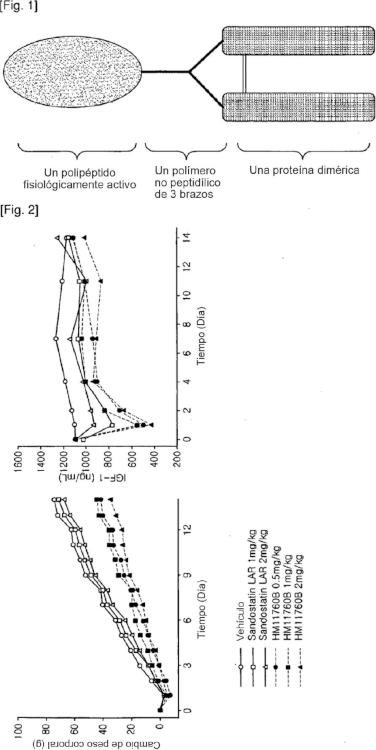
Un complejo polipeptídico que comprende un polímero no peptidílico que tiene tres extremos funcionales.
Un complejo proteico, que comprende un polipéptido fisiológicamente activo,
un dominio Fc de inmunoglobulina y un polímero no peptidílico que tiene tres extremos funcionales, en donde los dos extremos funcionales del polímero no peptidílico están covalentemente unidos a los dos grupos amino N-terminales del dominio Fc de inmunoglobulina y el tercero de los mismos está covalentemente unido al polipéptido fisiológicamente activo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2009/004114.
Solicitante: Hanmi Science Co., Ltd. .
Nacionalidad solicitante: República de Corea.
Dirección: 550 Dongtangiheung-ro, Dongtan-myeon, Hwaseong-si Gyeonggi-do 445-813 REPUBLICA DE COREA.
Inventor/es: LEE, GWAN, SUN, KWON, SE CHANG, SONG,DAE HAE, SHIN,JAE HEE, LEE,MI JI, HONG,SUNG HEE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K19/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
PDF original: ES-2523043_T3.pdf
Fragmento de la descripción:
Un complejo polipeptídico que comprende un polímero no peptidílico que tiene tres extremos funcionales Campo técnico
La presente invención se refiere a un complejo proteico que permite la actividad de acción prolongada de un polipéptido fisiológicamente activo con una proteína dimérica. Más particularmente, la presente invención se refiere a un complejo proteico en el que un polipéptido fisiológicamente activo y una proteina dimérica están unidos a un polimero no peptidílico que tiene tres extremos funcionales (3 brazos) a través de un enlace covalente respectivo, y un método para preparar el mismo.
Antecedentes técnicos
Debido a la baja estabilidad, los polipéptidos generalmente son adecuados para desnaturalizarse y ser degradados por proteinasas y pierden su actividad. Por otra parte, los péptidos son relativamente pequeños de tamaño de modo que se excretan fácilmente a través del riñón.
Para mantener las concentraciones de niveles en sangre deseadas y títulos de las mismas, por tanto, los medicamentos proteicos que comprenden polipéptidos o péptidos como principios activos necesitan ser administrados con frecuencia. Sin embargo, debido a que los medicamentos proteicos están, en la mayor parte, en una forma adecuada para inyecciones, el mantenimiento de los polipéptidos o péptidos fisiológicamente activos a niveles en sangre apropiados requiere inyecciones frecuentes, lo que produce dolor significativo al paciente. Para superar estos problemas, se han hecho intentos de proporcionar efectos medicinales máximos aumentando la estabilidad de medicamentos proteicos en la sangre y manteniendo niveles de medicamento en sangre altos durante un periodo de tiempo largo. Estos agentes medicinales proteicos de larga duración se requieren no solo para aumentar la estabilidad de los medicamentos proteicos y mantener títulos suficientes de los medicamentos mismos, sino también para no producir respuestas inmunitarias en los pacientes.
Convencionalmente, los polímeros muy solubles tal como polietilenglicol (PEG) se injertan químicamente en la superficie de proteínas con el fin de estabilizar las proteínas, prevenir el contacto de proteinasas con las proteínas, y suprimir la pérdida renal de los péptidos de pequeño tamaño. Injertado a sitios específicos o una variedad de sitios diferentes, PEG es útil para la estabilización y prevención de la hidrólisis de proteínas sin crear efectos secundarios notables. Además, el PEG injertado aumenta el peso molecular de las proteínas, conteniendo de esta manera la pérdida renal de las proteínas y manteniendo la actividad fisiológica de las proteínas.
Por ejemplo, el documento WO 26/76471 describe el uso de péptido natriurético de tipo B (BNP) en el tratamiento de insuficiencia cardiaca congestiva. BNP se une al receptor de péptido natriurético A (NPR-A) para desencadenar la síntesis de GMPc, reduciendo de esta manera la presión sanguínea arterial. Cuando está PEGilado, se describe que BNP alarga la actividad fisiológica del mismo del mismo durante un periodo de tiempo largo. La patente en EE UU No. 6.924.264 también divulga un aumento en el periodo activo de exendina-4 por injerto de PEG en un residuo de lisina.
Para aumentar la actividad fisiológica del mismo, un polipéptido medicinal se une a ambos de los terminales de PEG en forma de un bis-conjugado (patente en EE UU No. 5.738.846). Por otra parte, dos proteínas medicinales diferentes se unen a terminales respectivos de PEG para formar un complejo proteico que tiene dos actividades fisiológicas diferentes (documento WO 92/16221). Sin embargo, no se encontró significancia en estos fármacos proteicos en términos de mantenimiento de la actividad.
Además, se describió que una proteína de fusión en la que G-CSF y albúmina humana se unieron a un PEG aumentó en estabilidad (Kinstler et al., Pharmaceutical Research 12(12): 1883-1888, 1995). Sin embargo, se encontró que el fármaco modificado con una estructura G-CSF-PEG-albúmina aumentaba el tiempo de residencia en solo aproximadamente cuatro veces, comparado con fármacos naturales solos, y que solo estaba ligeramente aumentado en semivida en suero. Por tanto, el fármaco modificado no se aplica prácticamente como un agente que dura.
Cuando se acoplan con PEG, los péptidos se vuelven más estables de modo que se alarga la persistencia de los mismos in vivo. Sin embargo, cuando le da alto peso molecular, PEG hace el título del péptido fisiológico activo significativamente bajo y disminuye la reactividad con péptidos, lo que produce un bajo rendimiento.
Una alternativa para aumentar la estabilidad de proteínas fisiológicamente activas in vivo recurre a la recombinación génica. Un gen que codifica una proteína muy estable en la sangre se une a un gen que codifica una proteína fisiológicamente activa de interés, seguido por transformación en células animales que después se cultivan para producir una proteína de fusión.
Por ejemplo, se ha descrito una proteína de fusión en la que la albúmina o un fragmento de la misma, que se sabe que es la más eficaz en estabilizar proteínas hasta ahora, se fusiona a una proteína fisiológica activa de interés (documentos WO 93/15199 y 93/152, Publicación EP No. 413.622). Además, una proteína de fusión de interferón alfa y albúmina, producida en levadura por Human Genome Sciences (nombre comercial: Albuferon) aumentó su semlvlda en suero de 5 horas a 93 horas, pero padece la crítica desventaja de estar disminuida en bioactividad a menos del 5% de la del interferón nativo (Osborn et al., J. Phar. Exp. Ther. 33(2): 54-548, 22).
Respecto a los péptidos, sus modificaciones se mencionan en el documento WO 2/46227 que divulga que GLP-1, exendlna-4 y análogos de las mismas se fusionan a seroalbúmlna humana o fragmentos de ¡nmunoglobulina (Fe) usando técnicas de recombinación genética y en la patente en EE UU No. 6.756.48 que divulga proteínas de fusión de la hormona paratiroidea (PTH) o análogos de la misma y fragmentos de inmunoglobullnas (Fe). Estos enfoques pueden superar el bajo rendimiento de la pegllaclón y la no especificidad, pero son desventajosos en que la semlvlda en suero no aumenta significativamente y en algunos casos, se producen bajos títulos. Se usan varios enlazadores peptídicos para aumentar máximamente la semlvlda en suero, pero muestran la alta posibilidad de producir respuestas inmunitarias. Cuando se da, un péptido que tiene un enlace disulfuro, tal como BNP, es muy probable que Induzca mal plegamlento y por tanto es difícil de aplicar.
El documento WO 94/11399 A1 enseña el entrecruzamiento específico de sitio de las subunldades (3 de la hemoglobina en la posición lys-82 de cada subunldad en su forma tetramérica más estable con un entrecruzador trlfunclonal tal como tris (3,5-dlbromosallcllato) de trlmesoilo (TTDS). Ahrends, Nucleic Aclds Research, vol. 34, no. 1, 3169-318, 26 identifica el fotoentrecruzamlento formado entre la cisterna única de la variante MutH A223C, marcada con el entrecruzador trlfunclonal en la hélice C-termlnal y su proteína activadora MutL para Investigar las Interacciones proteína-proteína. El documento WO 27/62177 A1 describe el entrecruzamlento de dos subunldades entre sí y un conjugado de anticuerpo para el fin de proporcionar sensibilidad y especificidad de tinción excepcional en ensayos inmunohlstoquímlcos y de hibridación in situ. Los documentos WO 93/215 A1 A1, WO 24/54615 A1 y Studdert et al., PNAS, vol. 12, no. 43, 15623-15628, 26 enseñan todos tres proteínas entrecruzadas por un agente entrecruzador trlfunclonal. El documento WO 28/82274 A1 divulga conjugados de proteína que comprenden un dominio Fe.
También se sabe otras varias proteínas de fusión que se preparan por unión del dominio Fe de la ¡nmunoglobulina a interferón (publicación de patente coreana No. 23-9464), receptor de ¡nterleuquina-4, receptor de interleuquina-7 o receptor de eritropoyetina (patente coreana No. 249572) mediante recombinación genética. La publicación de patente PCT No. WO 1/3737 divulga una proteína de fusión en la que una cltoqulna o un factor de crecimiento se unen a través de un enlazador oligopeptídico a un fragmento Fe de ¡nmunoglobulina. La patente en EE UU No. 5.116.964 describe LHR (glucoproteína de superficie celular de linfocitos) o proteína CD4 que se fusiona al extremo amino o carboxi de un dominio Fe de ¡nmunoglobulina usando una técnica de recombinación genética. Además, la patente en EE UU No. 5.349.53 divulga una proteína de fusión en la que IL-2 se une a un dominio Fe de ¡nmunoglobulina. Se divulgan muchas otras proteínas de fusión de Fe construidas usando técnicas de recombinación genética, ejemplos de las cuales incluyen una proteína de... [Seguir leyendo]
Reivindicaciones:
1. Un complejo proteico, que comprende un polipéptido fisiológicamente activo, un dominio Fe de inmunoglobulina y un polímero no peptidMico que tiene tres extremos funcionales, en donde los dos extremos funcionales del polímero no peptidílico están covalentemente unidos a los dos grupos amino N-terminales del dominio Fe de inmunoglobulina y el tercero de los mismos está covalentemente unido al polipéptido fisiológicamente activo.
2. El complejo proteico como se define en la reivindicación 1, en donde el dominio Fe de inmunoglobulina es aglucosilado.
3. El complejo proteico como se define en la reivindicación 1, en donde el dominio Fe de inmunoglobulina está compuesto de uno a cuatro dominios diferentes seleccionados de entre Ch1, Ch2, Ch3 y Ch4.
4. El complejo proteico como se define en la reivindicación 3, en donde el dominio Fe de inmunoglobulina comprende además una región bisagra.
5. El complejo proteico como se define en la reivindicación 1, en donde el dominio Fe de inmunoglobulina se selecciona de un grupo que consiste en dominios Fe de IgG, IgA, IgD, IgE, IgM y combinaciones e híbridos de los mismos.
6. El complejo proteico como se define en la reivindicación 5, en donde el dominio Fe de inmunoglobulina se selecciona de un grupo que consiste en dominios Fe de lgG1, lgG2, lgG3, lgG4, y combinaciones e híbridos de los mismos.
7. El complejo proteico como se define en la reivindicación 5, en donde el dominio Fe de inmunoglobulina está en forma de dímeros o multímeros (combinaciones de Fe de inmunoglobulina) que cada uno comprende inmunoglobulinas glucosiladas compuestas de dominios del mismo origen.
8. El complejo proteico como se define en la reivindicación 5, en donde el dominio Fe de inmunoglobulina es un dominio Fe de lgG4.
9. El complejo proteico como se define en la reivindicación 8, en donde el dominio Fe de inmunoglobulina es un dominio Fe de lgG4 aglucosilado humano.
1. El complejo proteico como se define en la reivindicación 1, en donde el polímero no peptidílico se selecciona de un grupo que consiste en polietilenglicol, polipropilenglicol, un copolímero de etilenglicol y propilenglicol, poliol polioxietoxilado, alcohol polivinílico, polisacárido, dextrano, polivinil etil éter, polímeros biodegradables tales como PLA (ácido poliláctico) y PLGA (ácido poliláctico-glicólico), polímeros biodegradables, lipopolímeros, quitinas, ácido hialurónico y combinaciones de los mismos.
11. El complejo proteico como se define en la reivindicación 1, en donde el polímero no peptidílico es un polietilenglicol.
12. El complejo proteico como se define en la reivindicación 1, en donde el polímero no peptidílico tiene un grupo funcional terminal seleccionado de entre grupos aldehido, grupos propionaldehído, grupos butilaldehído, grupos maleimida y derivados de succinimida.
13. El complejo proteico como se define en la reivindicación 12, en donde el polímero no peptidílico tiene tres grupos funcionales aldehido en los extremos respectivos del mismo.
14. El complejo proteico como se define en la reivindicación 1, en donde los tres extremos funcionales del polímero no peptidílico se unen a grupos funcionales, N-terminales del dominio Fe de inmunoglobulina y el polipéptido fisiológicamente activo, dichos grupos funcionales, N-terminales se seleccionan de un grupo que consiste en residuos de lisina, histidina, cisterna y combinaciones de los mismos.
15. El complejo proteico como se define en la reivindicación 1, en donde el polipéptido fisiológicamente activo se selecciona de un grupo que consiste en hormonas, citoquinas, interleuquinas, proteínas que se unen a interleuquinas, enzimas, anticuerpos, factores de crecimiento, factores de transcripción, factores sanguíneos, vacunas, proteínas estructurales, proteínas ligandos, receptores, antígenos de superficie celular, antagonistas de receptores y derivados o análogos de los mismos.
16. El complejo proteico como se define en la reivindicación 15, en donde el polipéptido fisiológicamente activo se selecciona de un grupo que consiste en hormonas de crecimiento humanas, hormonas liberadoras de la hormona de crecimiento, péptidos liberadores de la hormona de crecimiento, interferones y receptores de interferones, factores estimulantes de colonias, péptidos similares a glucagón, péptidos de extendina-4, ANP,
BNP, CNP, DNP, receptores acoplados a proteínas G, interleuquinas y receptores de interleuquinas, enzimas, proteínas que unen a interleuquina, proteínas que se unen a citoquinas, factores activadores de macrófagos, péptidos de macrófagos, factores de células B, factores de células T, proteína A, inhibidores de alergia, glucoproteínas de necrosis celular, ¡nmunotoxinas, llnfotoxinas, factor de necrosis tumoral, supresores tumorales, factor de crecimiento transformante, alfa-1 antitripsina, albúmina, a-lactoalbúmina, apolipoproteína E, eritropoyetina, eritropoyetina muy glucosilada, angiopoyetinas, hemoglobina, trombina, péptidos activadores de los receptores de trombina, trombomodulina, factor sanguíneo Vil, VIla, VIII, IX y XIII, activadores de plasminógeno, péptidos que se unen a fibrina, uroqulnasa, estreptoquinasa, hirudina, proteína C, proteína C reactiva, inhibidor de renina, inhibidor de colagenasa, superóxido dismutasa, leptina, factor de crecimiento derivado de plaquetas, factor de crecimiento epitelial, factor de crecimiento epidérmico, angiostatina, angiotensina, factor de crecimiento óseo, proteína estimuladora del hueso, calcitonina, insulina, somatostatina, octreótido (agonista de somatostatina), atriopeptina, factor inductor de cartílago, elcatonina, factor activador de tejido conjuntivo, inhibidor de la ruta del factor tisular, hormona foliculoestimulante, hormona luteinizante, hormona liberadora de la hormona luteinizante, factores de crecimiento nerviosos, hormona paratiroidea, relaxina, secretina, somatomedina, factor de crecimiento de tipo insulínico, hormona corticosuprarrenal, glucagón, colecistoquinina, polipéptido pancreático, péptido liberador de gastrina, factor liberador de corticotropina, hormona estimulante del tiroides, autotaxina, lactoferrina, miostatina, receptores, antagonistas de receptores, antígenos de superficie celular, antígenos de vacunas derivados de virus, anticuerpos monoclonales, anticuerpos policlonales, fragmentos de anticuerpos.
17. El complejo proteico como se define en la reivindicación 16, en donde el polipéptido fisiológicamente activo se selecciona de un grupo que consiste en hormonas de crecimiento humanas, interferón alfa, interferón beta, factor estimulante de colonias de granulocitos, eritropoyetina, exendina-4, péptido imidazol acetil exendina-4 (agonista de exendina-4), calcitonina, octreótido (agonista de somatostatina), BNP y fragmento Fab.
18. Un método para preparar un complejo proteico compuesto de un polipéptido fisiológicamente activo, un dominio Fe de inmunoglobulina y un polímero no peptidílico que tiene tres extremos funcionales, con los enlaces tanto del polipéptido fisiológicamente activo como del dominio Fe de inmunoglobulina al polímero no peptidílico a través de respectivos enlaces covalentes, que comprende:
(1) unir covalentemente dos extremos funcionales del polímero no peptidílico a grupos amino N-terminales opuestos del dominio Fe de inmunoglobulina para formar un conjugado;
(2) aislar de la mezcla de reacción del paso (1) el conjugado en que el dominio Fe de inmunoglobulina está covalentemente unido en los extremos N-terminales del mismo con el polímero no peptidílico; y
(3) unir covalentemente el polipéptido fisiológicamente activo a un extremo funcional libre del polímero no peptidílico del conjugado aislado.
19. El método como se define en la reivindicación 18, en donde el polímero no peptidílico tiene tres grupos funcionales aldehido en los respectivos extremos del mismo.
2. El método como se define en la reivindicación 18, en donde el dominio Fe de inmunoglobulina se hace reaccionar en una proporción molar de 1:2 a 1:5 con el polímero no peptidílico en el paso (1).
21. El método como se define en la reivindicación 18, en donde el conjugado se hace reaccionar en una proporción molar de 1:,5 a 1:,5 con el polipéptido fisiológicamente activo en el paso (3).
22. El método como se define en la reivindicación 18, en donde las reacciones tanto en el paso (1) como en el (3) se realizan en presencia de un agente reductor.
23. El método como se define en la reivindicación 22, en donde el agente reductor se selecciona de un grupo que consiste en cianoborohidruro de sodio (NaCNBHs), borohidruro de sodio, borato de dimetilamina y borato de piridina.
24. Una composición farmacéutica, que comprende el complejo proteico de la reivindicación 1 y opcionalmente un vehículo farmacéuticamente aceptable.
25. Un complejo proteico preparado usando el método de la reivindicación 18.
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]