COMPLEJO ANTIGENICO QUE COMPRENDE UN INMOESTIMULADOR, CD4, Y UN DOMINIO RECEPTOR DE QUIMIOQUINA PARA TRATAMIENTO DE VIH Y DESORDENES INMUNES.
Un péptido antígeno CD4-CDR2, caracterizado porque el péptido antígeno está entre aproximadamente 30 y aproximadamente 46 aminoácidos de longitud;
en donde el péptido antígeno CD4-CDR2 contiene dos residuos de cisteína separados por una secuencia interpuesta de 28 a 40 residuos de aminoácidos; y en donde la secuencia interpuesta es una porción contigua de la secuencia representada por los residuos 27 a 66 de SEC. DE IDENT. NO:1, o es un homólogo inmunológicamente funcional de residuos 27 a 66 de SEC. DE IDENT. NO:1, donde dicho homólogo es un péptido que tiene la misma secuencia de aminoácidos con sustituciones conservativas de hasta el 10% de los aminoácidos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/14030.
Solicitante: UNITED BIOMEDICAL, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 25 DAVIDS DRIVE,HAUPPAUGE, NEW YORK 11788.
Inventor/es: WANG, CHANG, YI.
Fecha de Publicación: .
Fecha Concesión Europea: 4 de Noviembre de 2009.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
Fragmento de la descripción:
Complejo antigénico que comprende un péptido inmunoestimulador, CD4, y un dominio receptor de quimioquina para tratamiento de VIH y desórdenes inmunes.
Campo de la invención
Esta invención se dirige al uso de una composición peptídica como un inmunógeno, que comprende cada péptido contenido en la misma, un sitio antigénico objetivo que se reconoce por anticuerpos en contra de un complejo de célula huésped receptor/co-receptor para VIH. El complejo comprende CD4 asociado con un dominio receptor de quimiocina. El sitio antigénico objetivo está en una forma cíclica unido covalentemente, linealmente y en tándem a (1) una proteína portadora a través de un acoplamiento químico, o preferiblemente a (2) un epítope de células T asistente y otras secuencias peptídicas inmunoestimuladoras por acoplamiento químico o más preferiblemente por síntesis directa. Más particularmente, la presente invención se refiere al uso de tal composición peptídica como un inmunógeno para producir la producción en mamíferos sanos, que incluye humanos, de anticuerpos de alto título que tienen actividades neutralizadas amplias en contra de aislados primarios de todos los clados de VIH tipo 1 (VIH-1) y aislados primarios de VIH tipo 2 (VIH-2). La presente invención se dirige también a un método para utilizar la composición peptídica como un inmunógeno para la prevención y tratamiento de la infección de virus de inmunodeficiencia así como para el tratamiento de respuestas inmunes indeseables tales como rechazo al transplante, y trastornos autoinmunes tales como artritis reumatoide, lupus eritematoso sistémico, y psoriasis.
Antecedentes de la invención
A pesar de la investigación intensiva para una vacuna en los 14 años desde el descubrimiento y caracterización de VIH, permanecen obstáculos principales para el desarrollo de la vacuna e inmunoterapia de VIH. Estos obstáculos incluyen variabilidad del VIH-1, una falta de entendimiento de la estructura del virus, y una falta de entendimiento de las respuestas inmunes necesarias para la prevención de la infección de VIH. Ver D. Burton and J. Moore, Nature Medicine, 1998, 4:495-48. El presidente del comité para la investigación de la vacuna del SIDA del gobierno de los Estados Unidos, declaró el 1 de febrero de 1998 que una vacuna segura para prevenir el SIDA podría estar aún más lejos de una década de probarse, debido a que mucho permanece desconocido acerca de cómo trabaja el sistema inmune del cuerpo (http://cnn.com/HEALTH/9802/01/aids.vaccine.search).
Hubo un optimismo temprano para vacunas eficaces subunitarias de envoltura VIH-1 recombinantes (por ejemplo, productos de vacuna gp120 y gp160) dado que el suero de vacuna de diversas pruebas clínicas eran capaces de neutralizar aislados de laboratorio de VIH-1 in vitro (Belshe et al., J. Am. Med. Assoc., 1994, 272:475; Keefer et al., AIDS Res. Hum Retroviruses, 1994, 10:1713). Este optimismo se sacudió cuando se encontró que el suero de vacuna era muy inefectivo para neutralizar aislados de VIH-1 de pacientes primarios (Hanson, AIDS Res. Hum Retroviruses, 1994, 10:645; Mascola et al., J Infect Dis., 1996, 173:340). Estos decepcionantes descubrimientos condujeron a NIH a decidir en junio de 1994 a posponer pruebas eficaces costosas a gran escalas de diversas proteínas de envoltura recombinantes basadas en vacunas subunitarias VIH.
La investigación de la vacuna VIH se enfoca ahora en aislados primarios lo cual se cree se parecen más a las cepas VIH responsables de la infección humana que las cepas de laboratorio usadas comúnmente (Sawyer et al., J Virol, 1994, 68:1342; Wrin et al., J Virol, 1995, 69:39). Los aislados primarios de VIH-1 se obtienen por cultivo limitado de PBMCs de paciente de plasma con PBMCs sin infectar. Los virus primarios pueden distinguirse fácilmente por fenotipo como se dispuso posteriormente de los virus adaptados de línea de la célula T (TCLA) tales como IIIb/LAI, SF2 y MN, los cuales han pasado durante el tiempo en líneas de células T-linfoide humana y se han vuelto bien adaptadas para crecer en estas líneas de células T:
Estas características fenotípicas de aislados primarios se deben a las características estructurales pobremente entendidas de VIH, particularmente la cualidad inaccesible de la envoltura viral con respecto a anticuerpos anti-env (D. Burton and J. Moore, Nature Medicine, 1998, 4:495-498). La variabilidad viral, una característica genotípica, también permanece como una obstáculo para el desarrollo de vacunas VIH de eficiencia mundial (Mascola et al., 1996). Estos factores juntos cuentan para el fracaso inesperado de las vacunas viralmente dirigidas a SIDA que se desarrollaron en contra de cepas homotípicas TCLA ya crecidas. Una propuesta alternativa para el desarrollo de vacuna para el VIH podría ser por la intervención de los receptores de VIH de la célula huésped, bloqueando con esto la infección al prevenir el VIH de enlazarse a, o unirse con células susceptibles. La propuesta dirigida a células ofrece métodos para superar la hipervariabilidad de la envoltura VIH y la diversidad fenotípica.
Una propuesta dirigida a células para la protección de la infección de VIH se sugirió por los estudios de inmunización activa y pasiva en el modelo de macaco rhesus SIV el cual mostró que los anticuerpos anti-células contribuyeron en gran medida a la protección de la infección (Stott, Nature, 1991, 353:393). Además, los anticuerpos monoclonales dirigidos en contra de CD4, moléculas de clase II MHC para el receptor de célula T y el receptor primario para el enlace de VIH, desde hace tiempo se han conocido que bloquean la infección en las pruebas de neutralización de VIH-1 en una forma que es dependiente del epítope CD4, no la cepa de virus (Sattentau et al., Science, 1986; 234:1120). En esta propuesta para inmunoprofilaxis se ha encontrado que los anticuerpos monoclonales anti-CD4 son efectivos para bloquear la infección de células por aislados primarios (Daar et al., Proc. Natl. Acad. Sci. USA, 1990; 87: 6574; and Hasunuma et al., J Immunol., 1992; 148:1841).
Otras propuestas dirigidas a células potencialmente efectivas incluyen seleccionar receptores quimiocina CXCR4, CCR5, CCR2b, y CCR3 que se han identificado recientemente como co-receptores para VIH (Feng et al., Science, 1996; 272:872; y, Doranz et al., Cell, 1996; 85:1149). Estos co-receptores funcionan juntos con CD4 para iniciar interaccionar post-enlace de la envoltura viral de glicoproteína con la membrana celular del huésped y en etapas pos-entrada de la replicación del retrovirus (Chackerian et al., J Virol, 1997; 71:3932).
El requerimiento para el enlace y fusión eficiente de VIH para CD4 y un co-receptor sugiere que una o ambas de estas moléculas pueden ser buenos objetivos para estrategias...
Reivindicaciones:
1. Un péptido antígeno CD4-CDR2, caracterizado porque el péptido antígeno está entre aproximadamente 30 y aproximadamente 46 aminoácidos de longitud; en donde el péptido antígeno CD4-CDR2 contiene dos residuos de cisteína separados por una secuencia interpuesta de 28 a 40 residuos de aminoácidos; y en donde la secuencia interpuesta es una porción contigua de la secuencia representada por los residuos 27 a 66 de SEC. DE IDENT. NO:1, o es un homólogo inmunológicamente funcional de residuos 27 a 66 de SEC. DE IDENT. NO:1, donde dicho homólogo es un péptido que tiene la misma secuencia de aminoácidos con sustituciones conservativas de hasta el 10% de los aminoácidos.
2. El péptido antígeno CD4-CDR2 de la reivindicación 1, caracterizado porque el péptido antígeno se selecciona del grupo que consiste de SEC. DE IDENT. NO:4, SEC. DE IDENT. NO:5, SEC. DE IDENT. NO:10, y SEC. DE IDENT. NO:11.
3. El péptido sintético de aproximadamente 50 a aproximadamente 80 aminoácidos de longitud, que comprende
(a) un epítope (Th) de célula T asistente,
(b) un péptido antígeno CD4-CDR2 de conformidad con la reivindicación 1; y
(c) un dominio inmunoestimulador de invasina.
4. El péptido sintético de aproximadamente 50 a aproximadamente 80 aminoácidos de longitud, que comprende
(a) un epítope (Th) de célula T asistente,
(b) un péptido antígeno CD4-CDR2 de conformidad con la reivindicación 2; y
(c) un dominio inmunoestimulador de invasina.
5. Un péptido o conjugado peptídico caracterizado porque comprende a un epítope (Th) de célula T asistente unido covalentemente a un péptido antígeno CD4-CDR2 de conformidad con la reivindicación 1.
6. Un péptido o conjugado peptídico caracterizado porque comprende epitope (Th) de célula T asistente unido covalentemente a un péptido antígeno CD4-CDR2 de conformidad con la reivindicación 2.
7. Un péptido o conjugado peptídico representado por la fórmula

caracterizado porque
cada A es independientemente un aminoácido o una secuencia inmunoestimuladora general;
cada B se selecciona del grupo que consiste de aminoácidos, -NHCH(X)CH2SCH2CO-, -NHCH(X)CH2SCH2CO(
cada Th es independientemente una secuencia de aminoácidos que comprenden un epítope de célula T asistente, o un análogo inmunomejorador o segmentos del mismo;
el péptido antígeno CD4-CDR2 representa la secuencia de un péptido antígeno de conformidad con la reivindicación 1;
X es un aminoácido a-COOH o a-CONH2;
n es de 0 a aproximadamente 10;
m es de 1 a aproximadamente 4; y
o es de 0 a aproximadamente 10.
8. El péptido o conjugado peptídico representado por la fórmula
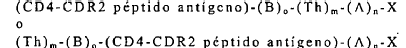
donde
cada A es independientemente un aminoácido o una secuencia inmunoestimuladora general;
cada B se selecciona del grupo que consiste de aminoácidos, -NHCH(X)CH2SCH2CO-, -NHCH(X)CH2SCH2CO(
cada Th es independientemente una secuencia de aminoácidos que comprende un epítope de célula T asistente, o un análogo inmunomejorador o segmento del mismo;
el péptido antígeno CD4-CDR2 representa la secuencia de un péptido antígeno de conformidad con la reivindicación 1;
X es un aminoácido a-COOH o a-CONH2;
n es de 0 a aproximadamente 10;
m es de 1 a aproximadamente 4; y
o es de 0 a aproximadamente 10.
9. Un péptido o conjugado peptídico representado por la fórmula
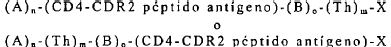
caracterizado porque
cada A es independientemente un aminoácido o una secuencia inmunoestimuladora general;
cada B se selecciona del grupo que consiste de aminoácidos, -NHCH(X)CH2SCH2CO-, -NHCH(X)CH2SCH2CO(
cada Th es independientemente una secuencia de aminoácidos que comprenden un epítope de célula T asistente, o un análogo inmunomejorador o segmento del mismo;
el péptido antígeno CD4-CDR2 representa la secuencia de un péptido antígeno de conformidad con la reivindicación 2;
X es un aminoácido a-COOH o a-CONH2;
n es de 0 a aproximadamente 10;
m es de 1 a aproximadamente 4; y
o es de 0 a aproximadamente 10.
10. El péptido o conjugado peptídico representado por la fórmula
Donde
cada A es independientemente un aminoácido o una secuencia inmunoestimuladora general;
cada B se selecciona del grupo que consiste de aminoácidos, -NHCH(X)CH2SCH2CO-, -NHCH(X)CH2SCH2CO(
cada Th es independientemente una secuencia de aminoácidos que comprenden un epítope de célula T asistente, o un análogo inmunomejorador o segmento del mismo;
el péptido antígeno CD4-CDR2 representa la secuencia de un péptido antígeno de conformidad con la reivindicación 2;
X es un aminoácido a-COOH o a-CONH2;
n es de 0 a aproximadamente 10;
m es de 1 a aproximadamente 4; y
o es de 0 a aproximadamente 10.
11. El péptido o conjugado peptídico de conformidad con cualquiera de las reivindicaciones 3-10, caracterizado porque el Th tiene una secuencia de aminoácidos seleccionada del grupo que consiste de SEC. DE IDENT. NOS: 6, 8, 12, 13, 36, y 38-59.
12. El péptido o conjugado peptídico de conformidad con la reivindicación 11, caracterizado porque el Th tiene una secuencia de aminoácidos seleccionada del grupo que consiste de SEC. DE IDENT. NO:6 y SEC. DE IDENT. NO:8.
13. El péptido o conjugado peptídico de conformidad con cualquiera de las reivindicaciones 3-10, caracterizado porque n es 3, y (A)3 es (dominio invasina)-Gly-Gly.
14. El péptido o conjugado peptídico de conformidad con la reivindicación 11, caracterizado porque al menos una porción A es un dominio invasina.
15. El péptido o conjugado peptídico de conformidad con la reivindicación 12, caracterizado porque al menos una porción A es un dominio invasina.
16. El péptido o conjugado peptídico de conformidad con cualquiera de las reivindicaciones 3-10, caracterizado porque el péptido antígeno CD4-CDR2 se selecciona del grupo que consiste de SEC. DE IDENT. NOS: 4, 5, 10, y 11.
17. El péptido o conjugado peptídico de conformidad con la reivindicación 11, caracterizado porque el péptido antígeno CD4-CDR2 se selecciona del grupo que consiste de SEC. DE IDENT. NOS: 4, 5, 10, y 11.
18. El péptido o conjugado peptídico de conformidad con la reivindicación 12, caracterizado porque el péptido antígeno CD4-CDR2 se selecciona del grupo que consiste de SEC. DE IDENT. NOS: 4, 5, 10, y 11.
19. Un péptido seleccionado del grupo que consiste de SEC. DE IDENT. NOS:32, 33, 34, 35, y 60.
20. Una composición farmacéutica que comprende una cantidad inmunológicamente efectiva de un péptido o conjugado peptídico de conformidad con cualquiera de las reivindicaciones 3-10 ó 19, caracterizada además porque comprende adicionalmente un portador farmacéuticamente aceptable.
21. La composición farmacéutica de conformidad con reivindicación 20, caracterizada porque la cantidad inmunológicamente efectiva del péptido o conjugado peptídico está entre aproximadamente 0.5 µg y aproximadamente 1 mg por kilogramo de peso corporal por dosis.
22. Uso de una composición farmacéutica de conformidad con la reivindicación 20 para la manufactura de un medicamento para inducir anticuerpos para un complejo de superficie de CD4 en un mamífero.
23. Uso de una composición farmacéutica de conformidad con la reivindicación 21 para la manufactura de un medicamento para inducir anticuerpos para un complejo de superficie de CD4 en un mamífero.
24. Uso de una composición farmacéutica de conformidad con la reivindicación 20 para la manufactura de un medicamento para inhibir el enlace de VIH a células CD4+ en un mamífero.
25. Uso de una composición farmacéutica de conformidad con la reivindicación 21 para la manufactura de un medicamento para inhibir el enlace de VIH a células CD4+ en un mamífero.
Patentes similares o relacionadas:
Procedimientos de tratamiento del cáncer usando antagonistas de unión al eje de PD-1 e inhibidores de TIGIT, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo antagonista anti-PD-L1 o fragmento de unión a antígeno del mismo y un anticuerpo antagonista anti-TIGIT o fragmento de unión a antígeno del mismo para su uso […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Uso de CAR basados en ICOS para mejorar la actividad antitumoral y la persistencia del CAR, del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una secuencia de ácido nucleico aislada que codifica un receptor de antígeno quimérico (CAR), en donde el CAR comprende un dominio de unión a antígeno, un dominio transmembrana […]
Péptido derivado de GPC3, composición farmacéutica para el tratamiento o la prevención de cáncer usando el mismo, inductor de inmunidad y método para producir células presentadoras de antígeno, del 17 de Junio de 2020, de CYTLIMIC INC: Composición farmacéutica para su uso en el tratamiento o la prevención de cáncer, que comprende un péptido que consiste en una secuencia de aminoácidos […]
Péptidos inhibidores derivados del transcrito de tipo TREM-1 (TLT-1) y sus usos, del 10 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido de 6 a 16 aminoácidos que comprende al menos 6 aminoácidos consecutivos de la secuencia de aminoácidos sec. con núm. de ident.: 4 para su uso en el tratamiento […]
Fijación eficaz como objetivo de la leucemia humana primaria utilizando células T modificadas con receptor de antígeno quimérico anti-CD123, del 3 de Junio de 2020, de NOVARTIS AG: Una molécula de ácido nucleico aislada que codifica un receptor de antígeno quimérico (CAR), en donde dicho CAR comprende un dominio de unión anti-CD123 humanizado, […]
Dominios coestimuladores para su uso en células genéticamente modificadas, del 3 de Junio de 2020, de Precision Biosciences, Inc: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica un dominio coestimulador que comprende una secuencia de aminoácidos establecida […]
Método para proporcionar linfocitos T específicos de tumor, del 27 de Mayo de 2020, de HS Diagnomics GmbH: Un método para fabricar un receptor artificial de linfocitos T específicos de tumor, que comprende las etapas de: - proporcionar una preparación de linfocitos […]