COMBINACIONES TERAPEUTICAS DE ANTICUERPOS ANTI-IGFR1.
Una combinación que comprende:
(a)uno o más anticuerpos anti-factor de crecimiento de tipo insulínico 1 o sus fragmentos de unión al antígeno aislados que comprenden un miembro seleccionado del grupo que consiste en:
una secuencia de aminoácidos de una cadena ligera de inmunoglobulina que comprende CDR-L1 definida por el SEQ ID NO: 5, CDR-L2 definida por el SEQ ID NO: 6 y CDR-L3 definida por el SEQ ID NO: 7; y una secuencia de aminoácidos de una cadena pesada de inmunoglobulina que comprende CDR-H1 definida por el SEQ ID NO: 8 o 12, CDR-H2 definida por el SEQ ID NO: 9 y CDR-H3 definida por el SEQ ID NO: 10; asociados con
(b)uno o más agentes quimioterapéuticos seleccionados del grupo que consiste en: lonafarnib;
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/038842.
Solicitante: SCHERING CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2000 GALLOPING HILL ROAD,KENILWORTH, NJ 07033-0530.
Inventor/es: WANG, YAN, BISHOP, WALTER R., PACHTER,JONATHAN,A.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K39/395C1
- A61K45/06 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
Clasificación PCT:
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
Clasificación antigua:
- A61K31/00 A61K […] › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
Fragmento de la descripción:
Combinaciones terapéuticas de anticuerpos anti-IGFR1.
Campo de la invención
La presente invención se refiere a combinaciones terapéuticas que comprenden uno o más anticuerpos anti-IGFR1 y uno o más agentes quimioterapéuticos.
Antecedentes de la invención
Los factores de crecimiento de tipo insulínico, también conocidos como somatomedinas, incluyen el factor de crecimiento de tipo insulínico I (IGF-I) y el factor de crecimiento de tipo insulínico II (IGF-II) (Klapper, et al., (1983) Endocrinol. 112:2215 y Rinderknecht, et al., (1978) Febs. Lett. 89:283). Estos factores de crecimiento ejercen una actividad mitogénica sobre diferentes tipos de células, incluyendo las células tumorales (Macaulay, (1992) Br. J. Cancer 65:311), mediante la unión a un receptor común denominado receptor del factor de crecimiento de tipo insulínico 1 (IGFR1) (Sepp-Lorenzino, (1998) Breast Cancer Research y Treatment 47:235). La interacción de los IGF con IGFR1 activa el receptor desencadenando la autofosforilación del receptor sobre los restos tirosina (Butler, et al., (1998) Comparative Biochemistry and Physiology 121:19). Una vez activado, IGFR1, a su vez, fosforila las dianas intracelulares para activar las rutas de señalización celular. Esta activación del receptor es crítica para la estimulación del crecimiento y la supervivencia de las células tumorales. Por lo tanto, la inhibición de la actividad de IGFR1 representa un método valioso potencial para tratar o prevenir el crecimiento de los cánceres humanos y otras enfermedades proliferativas.
Varias líneas de evidencia indican que IGF-I, IGF-II y su receptor IGFR1 son mediadores importantes del fenotipo maligno. Se ha descubierto que los niveles en plasma de IGF-I son el pronosticador más fuerte de riesgo de cáncer de próstata (Chan, et al., (1998) Science 279:563) y estudios epidemiológicos similares vinculan fuertemente los niveles de IGF-I en plasma con el riesgo de cáncer de mama, colon y pulmón.
La expresión en exceso del Receptor del Factor de Crecimiento de tipo insulínico I también ha sido demostrada en varias líneas celulares de cáncer y tejidos tumorales. El IGFR1 es expresado en exceso en 40% de todas las líneas de células cancerosas de mama (Pandini, et al., (1999) Cancer Res. 5:1935) y en 15% de las líneas celulares de cáncer de pulmón. En tejido tumoral de cáncer de mama, IGFR1 es expresado en exceso 6-14 veces y el IGFR1 muestra una actividad quinasa 2-4 veces superior en comparación con el tejido normal (Webster, et al., (1996) Cancer Res. 56:2781 y Pekonen, et al., (1998) Cancer Res. 48:1343). Por otra parte, se ha informado de que el tejido de cáncer colorrectal muestra niveles de IGFR1 fuertemente elevados (Weber et al., Cancer 95(10):2086-95 (2002)). El análisis de cultivos de células cancerosas cervicales primarias y de líneas de cáncer cervical reveló una expresión en exceso de IGFR1 de 3 y 5 veces, respectivamente, en comparación con las células ectocervicales normales (Steller, et al., (1996) Cancer Res. 56:1762). La expresión de IGFR1 en células de sarcoma sinovial también se corresponde con un fenotipo agresivo (esto es, metástasis y elevada velocidad de proliferación; Xie, et al., (1999) Cancer Res. 59:3588).
La acromegalia, una enfermedad de desarrollo lento, está causada por hipersecreción de hormona del crecimiento e IGF-I (Ben-Schlomo, et al., (2001) Endocrin. Metab. Clin. North. Am. 30:565-583). El antagonismo de la función de IGFR1 es útil en el tratamiento la enfermedad.
Existen varios anticuerpos, que son conocidos en la técnica, que inhiben la actividad de IGFR1. No obstante, estos tienen un valor terapéutico relativamente bajo: Por ejemplo, a-IR3 (Kull, et al., (1983) J. Biol. Chem. 258:6561), 1H7 (Li et al., (1993) Biochem. Biophys. Res. Comm. 196.92-98 y Xiong et al., (1992) Proc. Natl. Acad. Sci., U.S.A. 89:5356-5360; Santa Cruz biotechnology, Inc.; Santa Cruz, CA) y MAB391 (R&D Systems; Minneapolis, MN) son anticuerpos monoclonales de ratón que Interaccionan con IGFR1 e inhiben su actividad. Puesto que estos son anticuerpos de ratón, su utilidad terapéutica en seres humanos es limitada. Cuando a un sujeto humano inmunocompetente se le administra una dosis de un anticuerpo murino, el sujeto produce anticuerpos contra las secuencias de la inmunoglobulina de ratón. Estos anticuerpos humanos anti-ratón (HAMA) neutralizan los anticuerpos terapéuticos y pueden inducir toxicidad aguda (esto es, una respuestas HAMA).
Un método por medio del cual se pueden evitar las respuestas HAMA consiste en el uso de anticuerpos completamente humanos que carecen de cualquier secuencia de aminoácidos foránea (p. ej., de ratón). Aunque el uso de anticuerpos totalmente humanos es un método eficaz para reducir o evitar el rechazo inmunitario por el anfitrión humano del anticuerpo terapéutico, se puede producir el rechazo del anticuerpo totalmente humano. El rechazo humano de anticuerpos humanos puede ser referido como una respuesta humana de anticuerpos antihumanos (respuesta HAHA). La respuesta HAHA puede estar mediada por factores tales como la presencia de secuencias de aminoácidos raras, de escasa aparición en los anticuerpos totalmente humanos. Por esta razón, los anticuerpos terapéuticos también se pueden optimizar mediante la inclusión de secuencias marco de anticuerpos humanos no inmunogénicos o sólo débilmente inmunogénicos. Preferiblemente, las secuencias existen frecuentemente en otros anticuerpos humanos.
El documento WO 02/053596 hace referencia a un anticuerpo anti-IGFR identificado como CP-571871. Sin embargo, más tarde se encontró que este anticuerpo causaba hiperglicemia como efecto secundario (Sachdev et al., Curr. Op. Mol. Ther., vol. 9(3), 2007, 299-304).
Holt et al. (Trends in Biotechnology, vol. 21:11, 2003, 484-490) describen fragmentos de unión al antígeno de anticuerpos en general.
Por ejemplo, se puede administrar un anticuerpo anti-IGFR1 a un sujeto asociado con un segundo anticuerpo anti-IGFR1 o un antagonista de IGFR1 de molécula pequeña. La presente invención proporciona, entre otros, tales tratamientos y composiciones para su uso en los tratamientos.
Aunque los anticuerpos anti-IGFR1 son un método eficaz para tratar afecciones médicas mediadas por el receptor (p. ej., cáncer o acromegalia), la eficacia de tales tratamientos se potenciaría mediante el uso de uno o más agentes quimioterapéuticos adicionales.
Compendio de la invención
La presente invención proporciona combinaciones que comprenden:

Reivindicaciones:
1. Una combinación que comprende:
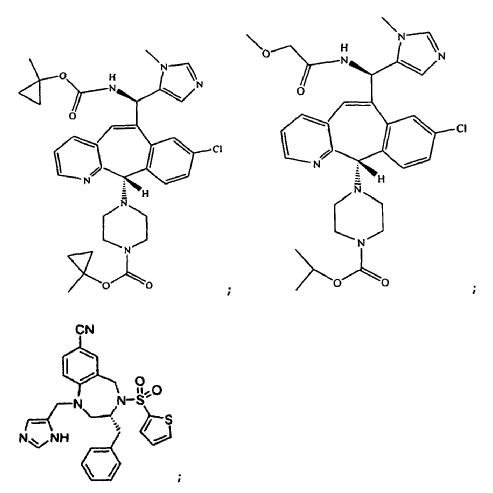



2. La combinación de la reivindicación 1 donde (a) comprende un anticuerpo aislado que comprende la secuencia de aminoácidos de una cadena ligera de inmunoglobulina que comprende CDR-L1 definida por el SEQ ID NO: 5, CDR-L2 definida por el SEQ ID NO: 6 y CDR-L3 definida por el SEQ ID NO: 7; y una secuencia de aminoácidos de una cadena pesada de inmunoglobulina que comprende CDR-H1 definida por el SEQ ID NO: 8 o 12, CDR-H2 definida por el SEQ ID NO: 9 y CDR-H3 definida por el SEQ ID NO: 10.
3. La combinación de la reivindicación 2 donde (a) comprende un anticuerpo aislado que comprende una cadena ligera de inmunoglobulina que comprende los aminoácidos 20-128 del SEQ ID NO: 2 y una cadena pesada de inmunoglobulina que comprende los aminoácidos 20-137 del SEQ ID NO: 4.
4. La combinación de la reivindicación 1 donde el agente quimioterapéutico es lonafarnib.
5. La combinación de la reivindicación 1 donde el agente quimioterapéutico es cetuximab.
6. La combinación de la reivindicación 1 donde el agente quimioterapéutico es bevacizumab.
7. La combinación de la reivindicación 1 donde el agente quimioterapéutico es sorafenib.
8. La combinación de la reivindicación 1 donde el agente quimioterapéutico es gefitinib.
9. La combinación de la reivindicación 1 donde el agente quimioterapéutico es fulvestrant.
10. La combinación de la reivindicación 1 donde el agente quimioterapéutico es octreotida.
11. La combinación de la reivindicación 1 donde el agente quimioterapéutico es temozolomida.
12. La combinación de la reivindicación 1 donde el agente quimioterapéutico es 4-hidroxitamoxifeno.
13. Una composición farmacéutica que comprende la combinación de la reivindicación 1 junto con uno o más portadores farmacéuticamente aceptables.
14. La combinación de la reivindicación 1, donde el anticuerpo o fragmento es un anticuerpo monoclonal.
15. El uso de una cantidad terapéuticamente eficaz de una combinación de la reivindicación 1 para la preparación de una composición farmacéutica para tratar o prevenir una afección médica en un sujeto mamífero que necesita semejante tratamiento o prevención, cuya afección médica está mediada por una expresión o actividad elevada del Receptor del Factor de crecimiento de tipo insulínico-I, donde la afección médica se selecciona del grupo que consiste en acromegalia, cáncer de vejiga, cáncer de Wilm, cáncer de ovario, cáncer pancreático, hiperplasia prostática benigna, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal, cáncer cervical, sarcoma sinovial, diarrea asociada con carcinoma metastásico, tumores productores de péptido intestinal vasoactivo, gigantismo, psoriasis, aterosclerosis, restenosis de la musculatura lisa de los vasos sanguíneos, proliferación microvascular inapropiada, artritis reumatoide, enfermedad de Graves, esclerosis múltiple, lupus eritematoso generalizado, Tiroiditis de Hashimoto, Miastenia Grave, tiroiditis autoinmunitaria y Enfermedad de Bechet.
16. El uso de una cantidad terapéuticamente eficaz de una combinación de la reivindicación 2 para la preparación de una composición farmacéutica para tratar o prevenir una afección médica en un sujeto mamífero que necesita semejante tratamiento o prevención, cuya afección está mediada por una expresión o actividad elevada del receptor del factor de crecimiento de tipo insulínico I, donde la afección médica se selecciona del grupo que consiste en acromegalia, cáncer de vejiga, cáncer de Wilm, cáncer de ovario, cáncer pancreático, hiperplasia prostática benigna, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal, cáncer cervical, sarcoma sinovial, diarrea asociada con carcinoma metastásico, tumores productores de péptido intestinal vasoactivo, gigantismo, psoriasis, aterosclerosis, restenosis de la musculatura lisa de los vasos sanguíneos, proliferación microvascular inapropiada, artritis reumatoide, enfermedad de Graves, esclerosis múltiple, lupus eritematoso generalizado, Tiroiditis de Hashimoto, Miastenia Grave, tiroiditis autoinmunitaria y Enfermedad de Bechet.
17. El uso de la reivindicación 15 donde el agente quimioterapéutico es uno o más miembro seleccionados del grupo que consiste en:
18. El uso de reivindicación 15, donde la afección médica se selecciona del grupo que consiste en acromegalia, cáncer de vejiga, cáncer de Wilm, cáncer de ovario, cáncer pancreático, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal y cáncer cervical.
19. El uso de reivindicación 15 donde uno o más componentes de la combinación son adecuados para ser administrados al sujeto por una ruta parenteral.
20. El uso de reivindicación 15, donde la combinación comprende:
21. El uso de reivindicación 20 donde la afección médica se selecciona entre acromegalia, cáncer de vejiga, cáncer de Wilm, cáncer de ovario, cáncer pancreático, hiperplasia prostática benigna, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal, cáncer cervical, sarcoma sinovial, diarrea asociada con carcinoma metastásico, tumores productores de péptido intestinal vasoactivo, gigantismo, psoriasis, aterosclerosis, restenosis de la musculatura lisa de los vasos sanguíneos, proliferación microvascular inapropiada, artritis reumatoide, enfermedad de Graves, esclerosis múltiple, lupus eritematoso generalizado, Tiroiditis de Hashimoto, Miastenia Grave, tiroiditis autoinmunitaria y Enfermedad de Bechet.
22. El uso de reivindicación 21, donde la afección médica es cáncer de mama.
23. El uso de reivindicación 21, donde la afección médica es cáncer de Wilm.
24. El uso de reivindicación 21, donde la afección médica es cáncer colorrectal.
25. El uso de reivindicación 21, donde la afección médica es cáncer de próstata.
26. El uso de reivindicación 21, donde la afección médica es cáncer pancreático.
27. El uso de reivindicación 21, donde la afección médica es cáncer de ovario.
28. Un kit que comprende:
29. El kit de la reivindicación 28, donde dichos anticuerpos o fragmentos y dichos agentes quimioterapéuticos están en recipientes separados.
30. La combinación de la reivindicación 14, donde el agente quimioterapéutico es lonafarnib.
31. La combinación de la reivindicación 14, donde el agente quimioterapéutico es cetuximab.
32. La combinación de la reivindicación 14, donde el agente quimioterapéutico es temsirolimus.
33. La combinación de la reivindicación 14, donde el agente quimioterapéutico es sorafenib.
34. La combinación de la reivindicación 14, donde el agente quimioterapéutico es gefitinib.
35. La combinación de la reivindicación 14, donde el agente quimioterapéutico es bevacizumab.
36. La combinación de la reivindicación 14, donde el agente quimioterapéutico es octreotida.
37. La combinación de la reivindicación 14, donde el agente quimioterapéutico es temozolomida.
38. La combinación de la reivindicación 14, donde el agente quimioterapéutico es 4-hidroxitamoxifeno.
39. El uso de la reivindicación 15 donde (a) comprende uno o más anticuerpos o sus fragmentos de unión al antígeno aislados que comprenden una secuencia de aminoácidos de una cadena ligera de inmunoglobulina que comprende CDR-L1 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 5, CDR-L2 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 6 y CDR-L3 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 7; y una secuencia de aminoácidos de una cadena pesada de inmunoglobulina que comprende CDR-H1 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 12, CDR-H2 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 9 y CDR-H3 que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 10.
40. La combinación de la reivindicación 3, donde el anticuerpo o fragmento de unión al antígeno es un anticuerpo monoclonal y el agente quimioterapéutico es uno o más miembros seleccionados del grupo que consiste en
41. El uso de la reivindicación 15, donde el agente quimioterapéutico es lonafarnib.
42. El uso de reivindicación 15, donde el agente quimioterapéutico es cetuximab.
43. El uso de reivindicación 15, donde el agente quimioterapéutico es temsirolimus.
44. El uso de reivindicación 15, donde el agente quimioterapéutico es gefitinib.
45. El uso de reivindicación 15, donde el agente quimioterapéutico es bevacizumab.
46. El uso de reivindicación 15, donde el agente quimioterapéutico es octreotida.
47. El uso de reivindicación 15, donde el agente quimioterapéutico es temozolomida.
48. El uso de reivindicación 15, donde el agente quimioterapéutico es sorafenib.
49. El uso de reivindicación 15, donde el agente quimioterapéutico es 4-hidroxitamoxifeno.
50. Una combinación que comprende (a) uno o más anticuerpos anti-factor de crecimiento de tipo insulínico-1 o sus fragmentos de unión al antígeno que comprenden una cadena ligera de inmunoglobulina que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 2; y una cadena pesada de inmunoglobulina que comprende la secuencia de aminoácidos mostrada en el SEQ ID NO: 4; asociados con (b) uno o más agentes quimioterapéuticos seleccionados del grupo que consiste en lonafarnib;

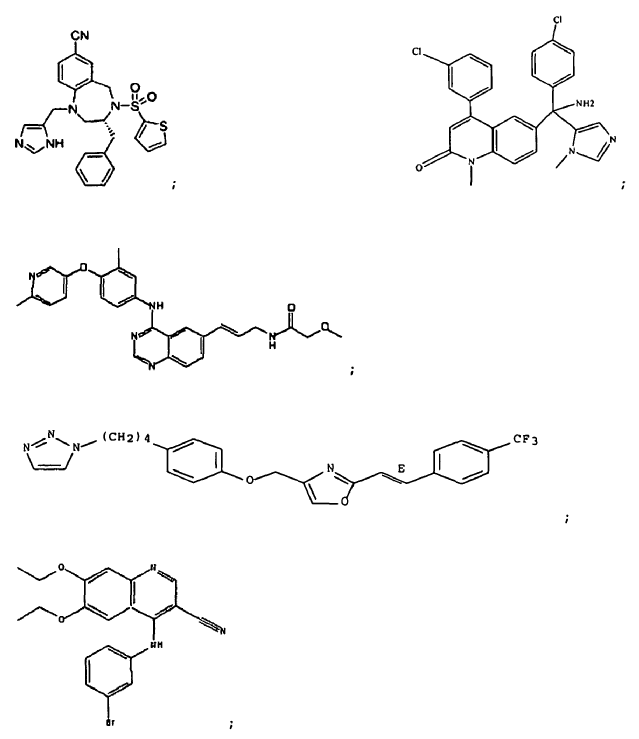
gefitinib;

anticuerpo ABX-EGF; cetuximab;

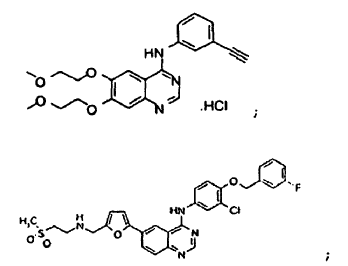
lapatinib; bevacizumab; VX-745; PD184352; temsirolimus; LY294002; LY292223; LY292696; LY293684; LY293646; wortmanina; sorafenib; ZM336372; L-779,450;

quercetina; octreotida; bortezomib;
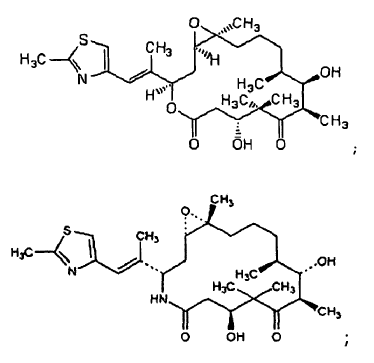

temozolomida;

4-hidroxitamoxifeno;
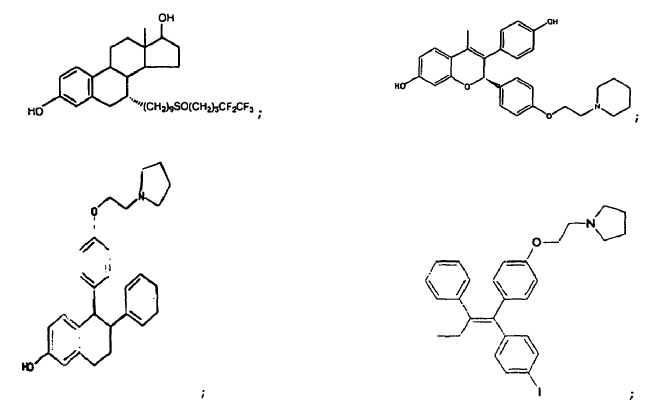
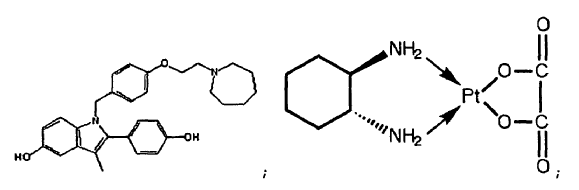
ácido retinoico; y
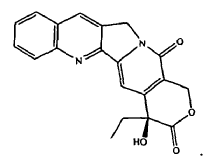
51. La combinación de la reivindicación 14, donde el agente quimioterapéutico es rapamicina.
52. La combinación de la reivindicación 14, donde el agente quimioterapéutico es erlotinib.
53. La combinación de la reivindicación 1, donde el agente quimioterapéutico es rapamicina.
54. La combinación de la reivindicación 1, donde el agente quimioterapéutico es temsirolimus.
55. El uso de reivindicación 15, donde el agente quimioterapéutico es rapamicina.
56. El uso de reivindicación 15, donde el agente quimioterapéutico es erlotinib.
57. El uso de reivindicación 21, donde la afección médica se selecciona del grupo que consiste en cáncer de vejiga, cáncer de Wilm, cáncer de ovario, cáncer pancreático, hiperplasia prostática benigna, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal y cáncer cervical.
58. El uso de reivindicación 57, donde el anticuerpo es adecuado para ser administrado al sujeto por una ruta parenteral.
59. La combinación de la reivindicación 1, donde el agente quimioterapéutico es erlotinib.
60. La combinación de la reivindicación 14, donde el agente quimioterapéutico es fulvestrant.
61. La combinación de la reivindicación 15, donde el agente quimioterapéutico es fulvestrant.
62. La combinación de la reivindicación 40, donde el agente quimioterapéutico es cetuximab.
63. La combinación de la reivindicación 40, donde el agente quimioterapéutico es bevacizumab.
64. La combinación de la reivindicación 40, donde el agente quimioterapéutico es erlotinib.
65. La combinación de la reivindicación 40, donde el agente quimioterapéutico es rapamicina.
66. La combinación de la reivindicación 40, donde el agente quimioterapéutico es temsirolimus.
67. La combinación de la reivindicación 40, donde el agente quimioterapéutico es sorafenib.
68. La combinación de la reivindicación 40, donde el agente quimioterapéutico es gefitinib.
69. La combinación de la reivindicación 40, donde el agente quimioterapéutico es fulvestrant.
70. La combinación de la reivindicación 40, donde el agente quimioterapéutico es octreotida.
71. La combinación de la reivindicación 40, donde el agente quimioterapéutico es temozolomida.
72. La combinación de la reivindicación 40, donde el agente quimioterapéutico es 4-hidroxitamoxifeno.
73. La combinación de la reivindicación 40, donde el agente quimioterapéutico es lonafarnib.
74. El uso de reivindicación 18, donde la afección médica es cáncer de mama.
75. El uso de reivindicación 18, donde la afección médica es cáncer de Wilm.
76. El uso de reivindicación 18, donde la afección médica es cáncer colorrectal.
77. El uso de reivindicación 18, donde la afección médica es cáncer de próstata.
78. El uso de reivindicación 18, donde la afección médica es cáncer pancreático.
79. El uso de reivindicación 18, donde la afección médica es cáncer de ovario.
80. El uso de reivindicación 20 para tratar una afección médica seleccionada del grupo que consiste en cáncer de vejiga, cáncer de Wilm cáncer de ovario, cáncer pancreático, hiperplasia prostática benigna, cáncer de mama, cáncer de próstata, cáncer de huesos, cáncer de pulmón, cáncer colorrectal, cáncer cervical en un sujeto que necesita semejante tratamiento, donde la composición comprende:
81. La combinación de la reivindicación 3, donde dicho anticuerpo está en una composición farmacéutica que comprende agua, tampón, y un azúcar y se formula por separado de dicho agente quimioterapéutico.
82. La combinación de la reivindicación 40, donde dicho anticuerpo está en una composición farmacéutica que comprende agua, tampón y un azúcar y se formula por separado de dicho agente quimioterapéutico.
83. El uso de reivindicación 17, donde el sujeto es un ser humano.
84. El uso de reivindicación 20, donde el sujeto es un ser humano.
85. El uso de reivindicación 80, donde el sujeto es un ser humano.
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Uso de cannabinoides en el tratamiento de convulsiones atónicas en el síndrome de Lennox-Gastaut, del 29 de Julio de 2020, de GW Research Limited: Cannabidiol (CBD) para su uso en el tratamiento de las convulsiones en el síndrome de Lennox-Gastaut en el que el CBD está en forma de un extracto de cannabis […]
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Combinación de anticuerpo anti-CD20 e inhibidor selectivo de PI3 quinasa, del 15 de Julio de 2020, de TG Therapeutics Inc: Un metodo in vitro para inhibir la proliferacion de una poblacion celular que comprende poner en contacto la poblacion con una combinacion que comprende […]