CÉLULAS MADRE ADULTAS INMORTALIZADAS EN FORMA CONDICIONAL A LARGO PLAZO Y MÉTODOS PARA HACER Y UTILIZAR TALES CÉLULAS.
Una célula madre adulta inmortalizada en forma condicional a largo plazo que comprende:
a. una proteína recombinante codificada por un protooncogén o un fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico recombinante que codifica la misma, en donde la expresión o la función de la proteína, fragmento u homólogo de la misma es inducible; y b. una proteína recombinante que inhibe la apoptosis de la célula madre, o una molécula de ácido nucleico recombinante que codifica una proteína que inhibe la apoptosis de la célula madre
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/040379.
Solicitante: NATIONAL JEWISH HEALTH
THE REGENTS OF THE UNIVERSITY OF COLORADO.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: NATIONAL JEWISH HEALTH10149510APEP080142 1400 JACKSON STREET M206 DENVE ESTADOS UNIDOS DE AMERICA.
Inventor/es: REFAELI, YOSEF, CAMBIER,John, JOHNSON,Sara, TURNER,Brian Curtis.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Octubre de 2006.
Clasificación PCT:
- C12N5/074 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre adultas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357627_T3.pdf
Fragmento de la descripción:
Campo de la invención
La presente invención se relaciona en general con células madre adultas inmortalizadas en forma condicional a largo plazo, con métodos para la producción de tales células, y con métodos para utilizar tales células, incluidos métodos terapéuticos y métodos para el descubrimiento de fármacos.
Antecedentes de la invención
La habilidad para manipular la producción de médula ósea de diferentes células sanguíneas se ha convertido en una herramienta importante en el manejo de diferentes enfermedades. Algunas de las mejores terapias nuevas para neoplasias malignas hematológicas se basan en el desarrollo de compuestos que empujan a las células leucémicas a diferenciarse en linajes a los cuales están comprometidos antes del evento de transformación. Uno de tales ejemplos es el caso de la leucemia promielocítica aguda. Después del tratamiento de los pacientes con Trióxido de Arsénico, las células malignas son empujadas a lo largo de la ruta mielomonocítica en que conduce a la remisión de esos tumores. Otro ejemplo se encuentra en la promoción de un injerto exitoso de células madre trasplantadas de médula ósea (células madre hematopoyéticas que se reconstituyen a largo plazo, o lt-HSC) en individuos irradiados. La apariencia de células sanguíneas diferenciadas puede acelerarse por medio de la administración sistémica de citoquinas que se sabe que inducen específicamente el desarrollo de glóbulos rojos (eritropoyetina, o Epo), o el desarrollo de células mieloides (factor estimulador de colonias de macrófagos y granulocitos, o GM-CSF). Finalmente, la recolección de lt-HSC de donantes ha sido grandemente simplificada por medio del proceso de “movilización” en donde estas células son inducidas a moverse desde los sitios de la médula ósea donde normalmente residen hasta la sangre periférica por administración sistémica de una citoquina llamada G-CSF. Las células madre pueden recogerse entonces a partir de la sangre periférica obviando el dolor y una recolección complicada de biopsias de la médula ósea. Todos estos procesos confían en la habilidad para programar y controlar el comportamiento biológico de lt-HSC.
Por lo tanto, el trasplante de médula ósea (células madre) es una herramienta terapéutica invaluable para la reconstitución hematológica e inmune de individuos que han sido sometidos a radiación y/o a quimioterapia (por ejemplo pacientes con cáncer, o que han sido expuestos a altos niveles de radiación), y es también una modalidad crítica para el tratamiento de la deficiencia inmunológica y de neoplasias malignas. Además, el trasplante de médula ósea sería una terapia muy útil para compartir los efectos negativos del envejecimiento del sistema inmunológico, así como de otras células y tejidos. Se estima que los trasplantes de células madre podrían beneficiar a más de
35.000 niños y adultos por año.
El principio operativo detrás de un trasplante de médula ósea es el reemplazo de lt-HSC que originan todos los tipos de células sanguíneas. Recientes estudios indican que el trasplante de médula ósea puede tener valor en el tratamiento de enfermedades cardíacas. Aunque el fundamento de esta afección es desconocido, este, y otros hallazgos, plantean la posibilidad de que las células madre (lt-HSC) puedan ser reprogramadas para dar lugar a otros tejidos. Si esto es cierto, las lt-HSC pueden ser muy útiles y proporcionar una alternativa para la terapia controversial con células madre embrionarias.
Los principales obstáculos que enfrenta la aplicación clínica del trasplante de médula ósea en primer lugar tienen que ver con la identificación de un donante de médula apropiadamente histocompatible. Esto usualmente se logra utilizando los registros que han llenado más de 6 millones de donantes potenciales. El donante seleccionado debe experimentar una prueba agotadora de movilización inducida de células madre en la sangre, seguida por 4 - 5 días de leucoféresis para aislar las lt-HSC raras. El trasplante de estas células debe ser seguido por un cuidadoso monitoreo y tratamiento del receptor para minimizar las reacciones injerto versus huésped provocadas por linfocitos pasajeros.
La elucidación a nivel molecular del deterioro en el desarrollo del linaje hematopoyético ha sido históricamente complicada por la baja frecuencia de poblaciones celulares relevantes, lo que impide el análisis bioquímico de respuestas de señalización y corriente abajo. En realidad, éste ha sido un factor limitante principal en todos los estudios de hematopoyesis. Además, la limitada disponibilidad de células madre hematopoyéticas de largo plazo (las LT-HSC) ha sido también un obstáculo importante en el tratamiento de muchos tipos de cánceres así como de varias clases de inmunodeficiencias en humanos. De acuerdo al mejor conocimiento de los presentes inventores, actualmente no se encuentra disponible ninguna línea celular que surja espontáneamente que se parezca a las lt-HSC y que pueda diferenciarse en linajes normales in vitro, o que pueda reconstituir ratones irradiados en forma letal
o humanos irradiados por debajo del nivel letal, ni conocen que se halla descrito ningún método para generar deliberadamente tales líneas celulares. Además, no existen actualmente tecnologías viables para expandir continuamente las lt-HSC, de tal manera que estas células deben ser obtenidas a partir de un donante cada vez que se las necesite.
Existe también una extrema necesidad por modalidades adicionales para tratar neoplasias malignas hematológicas e inmunodeficiencias, y nuevas citoquinas para incrementar la producción de lt-HSC trasplantadas. Además, no existe actualmente una plataforma adecuada para identificación de objetivos y descubrimiento de fármacos. Los elementos faltantes son las líneas celulares que representan diferentes etapas de desarrollo en linajes hematopoyéticos. En forma óptima, tales células deben retener la habilidad para experimentar una diferenciación adicional en un linaje específico. Tales líneas de células son esenciales para la identificación de productos génicos, y por lo tanto de nuevos objetivos convertibles en fármacos, involucrados en la regulación del desarrollo celular, proliferación y supervivencia. Además, tales líneas celulares son esenciales para la selección de moléculas pequeñas y bibliotecas de ARNsh para estudios de pérdida de la función, así como bibliotecas de ADNc para obtener beneficios de los estudios de la función, en la búsqueda de nuevos fármacos.
Las barreras para el descubrimiento actual de nuevos fármacos en esta área incluyen: (a) aislamiento de un número suficiente de células de una etapa particular de desarrollo; (b) propagación de las células in vitro durante un período de tiempo suficiente; y (c) la habilidad para utilizar oncogenes condicionales para la búsqueda de fármacos que pudieran afectar leucémicas, y no las HSC normales o las progenitoras.
Por lo tanto, existe una gran necesidad en el arte por un método para generar líneas de células lt-HSC que puedan expandirse en forma extensa, ser congeladas, y utilizarlas nuevamente cada vez que se requiera, sin necesidad de recortarlas del donante.
Resumen de la invención
Una modalidad de la presente invención se relaciona con un método para producir células madre adultas inmortalizadas en forma condicional. El método incluye las etapas de: (a) obtener una población expandida de células madre adultas; (b) transfectar las células madre con una molécula de ácido nucleico que contengan un protooncogén o un fragmento biológicamente activo u homólogo del mismo que promueva la supervivencia y proliferación de las células, en donde él protooncogén sea inducible; (c) transfectar las células madre con una molécula de ácido nucleico que contengan una proteína que inhiba la apoptosis de las células; y (d) expandir las células transfectadas en presencia de una combinación de factores de crecimiento de células madre bajo condiciones por medidas cuales el protooncogén sea activo, para producir células madre adultas inmortalizadas en forma condicional. En un aspecto de esta modalidad, la molécula de ácido nucleico de (b) y/o (c) está contenida en un vector de integración. En un aspecto, la molécula de ácido nucleico de (b) y/o (c) es transfectada dentro de las células utilizando un virus o un vector viral seleccionado de: vectores retrovirales, vectores lentivirales, parvovirus, virus vacuna, coronavirus, calicivirus, virus del papiloma, flavivirus, ortomixovirus, ortomixovirus,... [Seguir leyendo]
Reivindicaciones:
1. Una célula madre adulta inmortalizada en forma condicional a largo plazo que comprende:
a. una proteína recombinante codificada por un protooncogén o un fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico recombinante que codifica la misma, en donde la expresión o la función de la proteína, fragmento u homólogo de la misma es inducible; y
b. una proteína recombinante que inhibe la apoptosis de la célula madre, o una molécula de ácido nucleico recombinante que codifica una proteína que inhibe la apoptosis de la célula madre.
2. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 1, en donde la molécula de ácido nucleico de (a) y/o (b) está contenida en un vector.
3. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 2, en donde el vector contiene un elemento sensible a la tetraciclina.
4. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 2, en donde la molécula de ácido nucleico de (a) y/o (b) está contenida en un vector que comprende secuencias de ácido nucleico que codifican secuencias de reconocimiento de sustrato para una recombinasa que flanquea la molécula de ácido nucleico de (a) o (b).
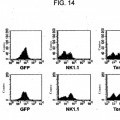
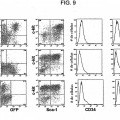
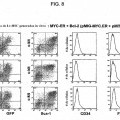
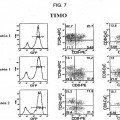
5. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 1, en donde la proteína recombinante codificada por un protooncogén o un fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico recombinante que codifica la misma se selecciona del grupo que consiste de MYC-ER e ICN-1-ER.
6. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 1, en donde la proteína recombinante que inhibe la apoptosis de la célula madre es Bcl-2.
7. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 1, que comprende:
a. la proteína recombinante codificada por el protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, en donde la función de la proteína, fragmento u homólogo de la misma es inducible; y
b. la proteína recombinante que inhibe la apoptosis de la célula madre.
8. La célula madre adulta inmortalizada en forma condicional a largo plazo de la reivindicación 1, en donde la proteína recombinante codificada por un protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia de la célula es una proteína de fusión Tat, o la proteína recombinante que inhibe la apoptosis de la célula madre es una proteína de fusión Tat.
9. Un método para producir células madre adultas inmortalizadas en forma condicional, que comprende:
a. suministrar en una población de células madre una primera proteína codificada por un protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico que codifica la misma, en donde la expresión o función de la proteína, fragmento u homólogo de la misma es inducible;
b. inhibir apoptosis en las células madre por medio del suministro en las células madre de una segunda proteína que inhibe apoptosis de la célula madre, o una molécula de ácido nucleico que codifica la proteína que inhibe apoptosis de la célula madre; y
c. expandir las células madre en presencia de una combinación de factores de crecimiento de células madre bajo condiciones por medio de las cuales la expresión o función de la primera proteína, fragmento u homólogo de la misma es activa, para producir células madre adultas inmortalizadas en forma condicional.
10. El método de la reivindicación 9, en donde suministrando en una población de células madre una primera proteína codificada un protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula comprende el cultivo de las células madre en presencia de una primera proteína de fusión Tat, en donde Tat se fusiona con la proteína codificada por el protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula; y
en donde la inhibición de apoptosis en las células madre por medio del suministro en las células madre de una segunda proteína que inhibe apoptosis de la célula madre que comprende el cultivo de las células madre con una segunda proteína de fusión Tat, en donde Tat se fusiona con la proteína que inhibe en la célula madre.
11. El método de la reivindicación 9, en donde la proteína recombinante codificada por un protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico recombinante que codifica la misma es MYC-ER, y en donde la proteína recombinante que inhibe apoptosis de la célula madre es Bcl-2.
12. El método de la reivindicación 9, en donde la proteína que inhibe apoptosis de la célula madre inhibe una proteína proapoptótica en las células madre.
13. Un método para identificación de compuestos que regula el compromiso del linaje y/o la diferenciación y desarrollo de la célula, que comprende:
a. poner en contacto células madre adultas inmortalizadas en forma condicional a largo plazo con un compuesto que va a ser analizado; y
b. detectar al menos una característica genotípica o fenotípica en las células madre adultas inmortalizadas en forma condicional a largo plazo, comparado con las células madre adultas inmortalizadas en forma condicional a largo plazo en ausencia del compuesto, en donde la detección de una diferencia en la característica en presencia del compuesto indica que el compuesto afecta la característica en la célula madre;
en donde las células madre adultas inmortalizadas en forma condicional a largo plazo comprenden:
i. una proteína recombinante codificada por un protooncogén o fragmento biológicamente activo u homólogo de la proteína que promueve la supervivencia y proliferación de la célula, o una molécula de ácido nucleico recombinante que codifica la misma, en donde la expresión o función de la proteína, fragmento u homólogo de la misma es inducible; y
ii. una proteína recombinante que inhibe apoptosis de la célula madre, o una molécula de ácido nucleico recombinante que codifica una proteína que inhibe apoptosis de la célula madre.
Patentes similares o relacionadas:
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]
Estimulación de la vía wnt en la reprogramación de células somáticas, del 20 de Mayo de 2020, de WHITEHEAD INSTITUTE FOR BIOMEDICAL RESEARCH: Un método de reprogramación de una célula somática de mamífero, que comprende: (a) poner en contacto la célula somática de mamífero con un activador de la vía Wnt seleccionado […]
Método de producción de citoblastos pluripotentes que tienen un gen receptor de linfocitos T específico de antígenos, del 11 de Marzo de 2020, de Kawamoto, Hiroshi: Un método in vitro de inducir linfocitos T para una inmunoterapia basada en células, que comprende las etapas de: proporcionar citoblastos pluripotentes […]
Método para la producción de célula madre pluripotente inducida a partir de célula madre mesenquimatosa y célula madre pluripotente inducida producida mediante el método, del 12 de Febrero de 2020, de BBHC Co. Ltd: Método para la producción de una célula madre pluripotente inducida, comprendiendo el método: añadir un extracto de Ecklonia cava a un medio […]
Método de proliferación celular y agente farmacéutico para reparación y regeneración de tejido, del 12 de Febrero de 2020, de Sapporo Medical University: Método para hacer crecer células madre mesenquimatosas humanas en una muestra recogida de un sujeto vivo cultivando las células en un medio, comprendiendo […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en osteoblastos, del 22 de Enero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en osteoblastos, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava […]
Medios de cultivo, cultivos celulares y métodos de cultivo de células madre pluripotentes en un estado indiferenciado, del 1 de Enero de 2020, de TECHNION RESEARCH & DEVELOPMENT FOUNDATION LTD: Método de expansión de células madre pluripotentes y mantenimiento de las células madre pluripotentes en un estado indiferenciado, comprendiendo […]
Métodos y composiciones para producir células similares a hepatocitos, del 6 de Noviembre de 2019, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un método para producir una población de células similares a hepatocitos a partir de una población de células madre procedentes de adipocitos (ASC), comprendiendo […]