Células estromales vivas para la prevención y tratamiento de respuestas inmunológicas al trasplante.
Células estromales hepáticas para la utilización en el tratamiento de un receptor de trasplante para reducir en dicho receptor una respuesta inmunológica de células efectoras contra un aloantígeno respecto a las células efectoras,
de manera que en el receptor del trasplante las células efectoras presentan una respuesta inmunológica reducida contra el aloantígeno.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/031782.
Solicitante: Cognate Therapeutics, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4800 Montgomery Lane, Suite 801 Bethesda, MD 20814 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MCINTOSH, KEVIN, R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N5/077 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células mesenquimales, p. ej. Células óseas, células cartilaginosas, Células del estroma de la médula ósea, células adiposas o células musculares.
PDF original: ES-2390503_T3.pdf
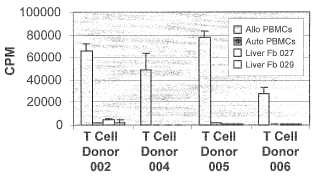
Fragmento de la descripción:
Células estromales vivas para la prevención y tratamiento de respuestas inmunológicas al trasplante
ANTECEDENTES DE LA INVENCIÓN
El hígado es un órgano dinámico que desempeña un papel importante en una diversidad de procesos fisiológicos. Entre las complejas funciones del hígado se incluyen el metabolismo, el almacenamiento, la excreción, la secreción de proteínas plasmáticas, tales como la albúmina, y la destoxificación de sustancias perjudiciales por parte de enzimas del sistema del citocromo P-450. Además, el hígado habitualmente quiescente también es capaz de notables actividades mitóticas bajo determinadas circunstancias. La población celular más importante del hígado son las células parenquimales (PC) , tambien conocidas como hepatocitos. El hígado también contiene otros tipos celulares, tales como células endoteliales, adipocitos, células fibroblásticas y células de Kupffer. La capacidad de las células hepáticas de experimentar una rápida regeneración al resultar dañado o parcialmente elimnado el hígado, convierte al hígado en una fuente potencial de células madre.
En la actualidad se cree que el hígado presenta un sistema de células madre y linajes con varias similitudes con los sistemas intestinal, de la piel y hematopoyético (Sigal et al., Amer. J. Physiol. 263:139-148, 1993) . Como tales, existen poblaciones celulares progenitoras en el hígado de los animales de todas las edades. Estas células, tras su aislamiento a partir del hígado, puede servir como potenciales candidatos para la terapia celular.
El sistema inmunológico del mamífero desempeña un papel crucial en la protección de los individuos frente a agentes infecciosos y en la prevención del crecimiento tumoral. Sin embargo, el mismo sistema inmunológico puede producir efectos no deseables, tales como el rechazo de trasplantes de células, tejidos y órganos procedentes de donantes no emparentados. El sistema inmunológico no distingue los intrusos beneficiosos, tales como un tejido transplantado, de los que resultan perjudiciales, y de esta manera el sistema inmunológico rechaza los tejidos u órganos transplantados. El rechazo de los órganos transplantados generalmente se encuentra mediado por células T alorreactivas presentes en el huésped que reconocen aloantígenos o xenoantígenos del donante.
La tolerancia inmunológica es una falta de sensibilidad a un antígeno específico inducida activamente como resultado de la inactivación funcional inducida por un antígeno o la muerte de linfocitos que son específicos para dicho antígeno. Los antígenos que inducen dicha tolerancia se denominan "tolerógenos", con el fin de distinguirlos de inmunógenos que son antígenos que generan respuestas inmunológicas. Un mecanismo de tolerancia de las células B y de falta de producción de anticuerpos implica la interacción de antígenos con células B específicas (la primera etapa en la activación de las células B) en ausencia de estimulación por parte de células T ayudantes u otras células presentadoras de antígenos (la segunda etapa en la activación de las células B) . Se han propuesto otros mecanismos de tolerancia de las células B. Por ejemplo, las células B pueden convertirse en anérgicas debido a un bloqueo en la señalización mediada por inmunoglobulinas superficiales ("competición de antígenos") , en ausencia de células T. Además, en ausencia de coestimulación por parte de una célula presentadora de antígenos, el entrecruzamiento fuerte de inmunoglobulinas de la superficie de las células B con un antígeno puede inducir la muerte apoptótica de las células B maduras normales, aunque podría no inducir la apoptosis de células B que producen anticuerpos autoinmunológicos (Tsubata et al., Curr. Biol. 4:8-17, 1994) .
La tolerancia de las células T se consigue: 1) en el timo, en donde se eliminan los timocitos reactivos para autopéptidos mediante deleción clonal (tolerancia central) , y 2) en la periferia, por exposición a autoantígenos bajo condiciones tolerogénicas (tolerancia periférica) . La deleción clonal también puede resultar de la expresión de moléculas de muerte celular sobre células presentadoras de antígenos. Son ejemplos clásicos de moléculas de muerte celular el ligando Fas (FasL) y el ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (ligando TRAIL) , que se une a sus receptores, Fas y DR4, respectivamente, sobre las células T activadas, induciendo la apoptosis de las células T. La interacción de CD27, un miembro de la superfamilia de TNFR, y el ligando CD27 (CD70) también induce la apoptosis de las células T.
El trasplante de células, tejidos y órganos entre individuos genéticamente dispares se asocia invariablemente al riesgo de rechazo del injerto. La práctica totalidad de las células expresan productos del complejo de histocompatibilidad mayor, las moléculas del MHC de clase I. Además, muchos tipos celulares pueden ser inducidos a expresar moléculas del MHC de clase II al exponerse a citoquinas inflamatorias. Entre las moléculas inmunogénicas adicionales se incluyen las derivadas de los antígenos de histocompatibilidad menores, tales como antígenos del cromosoma Y reconocidos por receptores femeninos. El rechazo de aloinjertos se encuentra mediado principalmente por células T de las subclases tanto CD4 como CD8 (Rosenberg et al., Annu. Rev. Immunol. 10:333, 1992) . Las células T CD4 alorreactivas producen citoquinas que exacerban la respuesta citolítica de CD8 frente al aloantígeno. Dentro de dichas subclases, se desarrollan subpoblaciones celulares competidoras tras la estimulación con antígenos que se caracterizan por las citoquinas que producen. Las células Th1, que producen IL-2 e IFN-γ, participan principalmente en el rechazo del aloinjerto (Mossmann et al., Annu. Rev. Immunol. 7:145, 1989) . Las células Th2, que producen IL-4 e IL-10, pueden regular negativamente las respuestas a Th1 mediante IL-10 (Fiorentino et al., J. Exp. Med. 170:2081, 1989) . En efecto, se han dedicado muchos esfuerzos a desviar respuestas a Th1 no deseables hacia la ruta de Th2. Las respuestas de células T alorreactivas no deseables en los pacientes (rechazo del aloinjerto, enfermedad injerto contra huésped) típicamente se tratan con fármacos inmunosupresores, tales como prednisona, azatioprina y ciclosporina A. Desafortunadamente, estos fármacos generalmente deben administrarse durante toda la vida del paciente y presentan multitud de efectos secundarios peligrosos, incluyendo la inmunosupresión generalizada.
Un objetivo importante del trasplante de órganos es la injertación permanente del órgano del donante sin inducir una respuesta inmunológica de rechazo del injerto por parte del receptor, conservando simultáneamente la inmunocompetencia del receptor frente a otros antígenos foráneos. Típicamente, con el fin de evitar las respuestas de rechazo del huésped, se utilizan agentes inmunosupresores no específicos, tales como ciclosporina, metotrexato, esteroides y FK506. Estos agentes deben administrarse diariamente y si se detiene la administración, habitualmente resulta el rechazo del injerto. Sin embargo, un problema importante de la utilización de agentes inmunosupresores no específicos es que funcionan suprimiendo la totalidad de los aspectos de la respuesta inmunológica, incrementando en gran medida de esta manera la susceptibilidad de un receptor a la infección y a otras enfermedades, incluyendo el cáncer.
Además, a pesar de la utilización de agentes inmunosupresores, el rechazo del injerto sigue siendo una fuente importante de morbilidad y mortalidad en el trasplante de órganos en el ser humano. La mayoría de trasplantes humanos fallan en menos de 10 años sin aceptación permanente del injerto. Sólo 50% de los trasplantes de corazón sobreviven 5 años y 20% de los trasplantes de riñón sobreviven 10 años (Opelz et al., Lancet 1:1223, 1981) .
Actualmente se cree que un trasplante con éxito depende de la prevención y/o reducción de una respuesta inmunológica no deseada de un huésped frente a un trasplante mediada por células efectoras inmunológicas para evitar el rechazo del tejido del donante por parte del huésped.También resulta ventajoso para un trasplante con éxito un método para eliminar o reducir una respuesta inmunológica no deseada por parte de un tejido donante contra un tejido receptor, conocido como enfermedad injerto contra el huésped. De esta manera, existe una necesidad desde hace mucho tiempo de métodos para suprimir, o de otro modo evitar, una respuesta inmunológica no deseada asociada al trasplante de células,... [Seguir leyendo]
Reivindicaciones:
1. Células estromales hepáticas para la utilización en el tratamiento de un receptor de trasplante para reducir en dicho receptor una respuesta inmunológica de células efectoras contra un aloantígeno respecto a las células efectoras, de manera que en el receptor del trasplante las células efectoras presentan una respuesta inmunológica reducida contra el aloantígeno.
2. Células según la reivindicación 1, en las que dichas células efectoras son células T.
3. Células según la reivindicación 2, en las que dichas células T proceden de un donante y el aloantígeno procede de dicho receptor, o en las que dichas células T proceden de dicho receptor y el aloantígeno procede de un donante.
4. Células según la reivindicación 2, en las que dichas células T se encuentran presentes en un trasplante.
5. Células según la reivindicación 1, en las que el trasplante es de médula ósea, o en las que el trasplante es de células madre hematopoyéticas, o en las que el trasplante es de células madre neurales.
6. Células según la reivindicación 1, en las que, previamente a dicha administración en un receptor de
trasplante de células estromales hepáticas, dichas células estromales hepáticas han sido expandidas en cultivo.
7. Células según la reivindicación 1, en las que dichas células efectoras son células T procedentes de un donante previamente activado mediante la puesta en contacto de las células T con una célula o un tejido procedente del receptor previamente al transplante con el fin de activar las células T, y en las que además dicha respuesta inmunológica es la reactivación de dichas células T.
8. Células según la reivindicación 1, en las que las células estromales hepáticas se administran en el receptor del trasplante para tratar el rechazo del trasplante por parte del receptor.
9. Células según la reivindicación 1, en las que las células estromales hepáticas son células estromales hepáticas humanas.
10. Células según la reivindicación 1, que comprenden además la administración en el receptor de un agente inmunosupresor.
11. Células según la reivindicación 1, en las que el trasplante es un órgano sólido.
12. Células según la reivindicación 11, en las que el órgano sólido se selecciona de entre el grupo que consiste de corazón, páncreas, riñón, pulmón e hígado.
13. Células según la reivindicación 1, en las que dichas células estromales hepáticas se administran en el receptor previamente a dicho trasplante, o en las que dichas células madre estromales hepáticas se administran en el receptor concurrentemente con dicho trasplante, o posteriormente a la implantación del trasplante.
14. Células según la reivindicación 13, en las que dichas células estromales hepáticas se administran como parte del trasplante.
15. Células según la reivindicación 1, en las que dichas células estromales hepáticas se administran por vía intravenosa en el receptor.
16. Células según la reivindicación 1, en las que dichas células efectoras son células de un receptor de dicho trasplante del donante.
17. Células según la reivindicación 1, en las que dichas células estromales hepáticas han sido genéticamente modificadas.
18. Células estromales hepáticas para la utilización en el tratamiento de un receptor de un trasplante con el fin de reducir en dicho receptor una respuesta inmunológica de células efectoras contra un aloantígeno respecto a las células efectoras, comprendiendo el tratamiento:
trasplantar en un receptor de trasplante un trasplante tratado con células estromales hepáticas en una cantidad efectiva para reducir una respuesta inmunológica de células efectoras contra un aloantígeno respecto a las células efectoras, de manera que en el receptor del trasplante las células efectoras producen una respuesta inmunológica reducida contra el aloantígeno.
19. Células estromales hepáticas para la utilización en la reducción de una respuesta inmunológica de células efectoras contra células alogénicas, comprendiendo la utilización el tratamiento de las células efectoras con células estromales hepáticas.
20. Células según la reivindicación 18 ó 19, en las que dichas células efectoras son células T.
21. Células según cualquiera de las reivindicaciones 1, 18 y 19, en las que las células estromales hepáticas se obtienen de un hígado humano.
Patentes similares o relacionadas:
Reparación de tejido cartilaginoso, del 27 de Mayo de 2020, de CartiRegen B.V: Un método para la separación electroforética de células a partir de un tejido, comprendiendo el método: a) seccionar un tejido para preparar fragmentos de dicho tejido, […]
Composiciones de medio de cultivo para la maduración de cardiomiocitos derivados de células madre pluripotentes de mamíferos, del 6 de Mayo de 2020, de Ncardia B.V: Una composición de medio de cultivo acuoso, en la que dicha composición de medio de cultivo no contiene suero y comprende: - un agonista del receptor de la hormona […]
Ceramidasa y diferenciación celular, del 22 de Abril de 2020, de MOUNT SINAI SCHOOL OF MEDICINE: Un método in vitro para mejorar el fenotipo de una población de condrocitos, dicho método comprende: seleccionar una población de condrocitos de mamífero que […]
Composiciones y métodos de células grasas marrones, del 1 de Abril de 2020, de Biorestorative Therapies, Inc: Un método para generar una célula grasa marrón, el método comprende: aislar una célula madre de un tejido graso marrón obtenido; y cultivar la célula […]
Método para producir células precursoras renales, del 11 de Marzo de 2020, de KYOTO UNIVERSITY: Un método para producir células progenitoras renales a partir de células del mesodermo intermedio, que comprende la siguiente etapa de: cultivar […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en neuronas, del 26 de Febrero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en neuronas, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava a un […]
Métodos y medios para ingeniería de tejidos blandos, del 19 de Febrero de 2020, de Everfill Oy: Un extracto de tejido adiposo, que comprende VEGF, FGF-2 e IGF-1, y que ha sido preparado a partir de tejido adiposo obtenido por liposucción, tejido adiposo […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en condrocitos, del 22 de Enero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en condrocitos, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava a un medio […]