CELULA MADRE PROSTATICA CANCEROSA.
Un método para el aislamiento de células madre prostáticas cancerosas,
que comprende el enriquecimiento selectivo de células madre prostáticas cancerosas que expresan el antígeno CD133, que comprende:
i) proporcionar una preparación celular que comprende células madre prostáticas cancerosas derivadas de tejido prostático;
ii) proporcionar condiciones de cultivo celular que permitan el mantenimiento de dichas células madre prostáticas cancerosas en cultivo y la unión de dichas células madre prostáticas cancerosas a una matriz basada en colágeno;
iii) seleccionar dichas células unidas donde dichas células expresan el antígeno CD133
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/001142.
Solicitante: PROCURE THERAPEUTICS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: INNOVATION CENTRE YORK SCIENCE PARK,YORK YO10 5DG.
Inventor/es: MAITLAND,NORMAN,CANCER RESAERCH UNIT, COLLINS,ANNE,CANCER RESEARCH UNIT.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- C12N5/06B30P
- G01N33/50D2B
Clasificación PCT:
- C12N5/07 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos animales.
Clasificación antigua:
- C12N5/06
Fragmento de la descripción:
Célula madre prostática cancerosa.
La invención se refiere a un método para el aislamiento de células madre prostáticas, típicamente células madre de cáncer de próstata; células madre y células madre cancerosas aisladas por el método y su uso.
La glándula prostática es el órgano accesorio principal del tracto reproductor masculino, y es el sitio más habitual de trastornos neoplásicos en los hombres. Las dos patologías principales de la glándula son: (i) hiperplasia prostática benigna, que es una afección no maligna que es habitual con la edad y (ii) carcinoma, que es la segunda causa más habitual de muerte en los hombres europeos, después de cáncer pulmonar y es predominante de forma creciente en la sociedad occidental envejecida. Los síntomas incluyen sangre en el semen o la orina, dolor frecuente o rigidez en la parte inferior de la espalda, las caderas o la parte superior del muslo. Los tumores de próstata pueden ser primarios (es decir, localizados en el órgano de origen) o secundarios (es decir, tumores que se forman que en otros órganos debido a la capacidad de las células cancerosas de moverse e invadir otros tejidos mediante el sistema circulatorio).
El cáncer de próstata puede ser relativamente inofensivo o extremadamente agresivo. Algunos tumores de próstata son de crecimiento lento y causan pocos síntomas clínicos. Los tumores de próstata agresivos se propagan rápidamente hasta los ganglios linfáticos y otros órganos, especialmente los huesos. Se sabe que el crecimiento del cáncer de próstata puede inhibirse bloqueando el suministro de hormonas masculinas tales como testosterona. Sin embargo, los cánceres de próstata finalmente se desarrollan y llegan a ser independientes de las hormonas sexuales masculinas (es decir, llegan a ser células cancerosas prostáticas independientes de andrógenos). Estas células están ligadas a cáncer de próstata maligno, agresivo. Todos los mamíferos de sexo masculino tienen una glándula prostática pero los únicos que se sabe que desarrollan cáncer de próstata de forma natural son los seres humanos y los perros.
Los cánceres prostáticos metastáticos se mueven predominantemente hasta el hueso y se tratan reduciendo la producción de andrógenos bloqueando la producción de andrógenos por las glándulas suprarrenales y los testículos. Este tratamiento es eficaz solamente durante un corto periodo de tiempo ya que las lesiones metastásicas llegan a ser independientes de andrógenos y crecen de forma descontrolada.
La presencia de células cancerosas prostéticas independientes de andrógenos significa que este régimen de tratamiento ya no es eficaz y se requiere intervención adicional para controlar el progreso de la enfermedad. Se observa una respuesta similar contra tratamientos quimioterapéuticos y radioterapéuticos. Como resultado, el cáncer de próstata metastático sigue siendo una enfermedad incurable por estrategias de tratamiento actuales. Por lo tanto, hay una necesidad continua de identificar nuevas dianas terapéuticas para proporcionar nuevos tratamientos para el cáncer de próstata.
Un problema subyacente al tratamiento eficaz de afecciones cancerosas es la identificación de una población de células en un tumor que tiene la capacidad de sostener el crecimiento de un tumor. Las evidencias sugieren que los tumores son clonales y por lo tanto derivan de una única célula. Sin embargo, hay pocos estudios que identifican y caracterizan esos tipos celulares que son responsables de mantener el crecimiento de células tumorales. Algunos han investigado estas llamadas "células madre cancerosas".
El documento WO03/050502 describe un método para enriquecer de forma selectiva células madre de tumor de mama a través del uso de un modelo de xenoinjerto en que el se cultivan células de cáncer de mama humanas en ratones inmunocomprometidos. El documento WO03/102215 describe el aislamiento de células madre y células madre cancerosas en virtud de la expresión específica de un gen informador que está regulado por ß catenina que llega a expresarse de forma activa en una célula madre. El documento US2003119080 describe un método para el aislamiento de células madre tumorales a partir de tumores sólidos. En el documento WO0140309 se describe un anticuerpo contra un antígeno de células madre de próstata supuesto, mencionado como antígeno de células madre de próstata (PSCA) que también se describe en los documentos US5.856.136, WO99/14328 y WO98/51805.
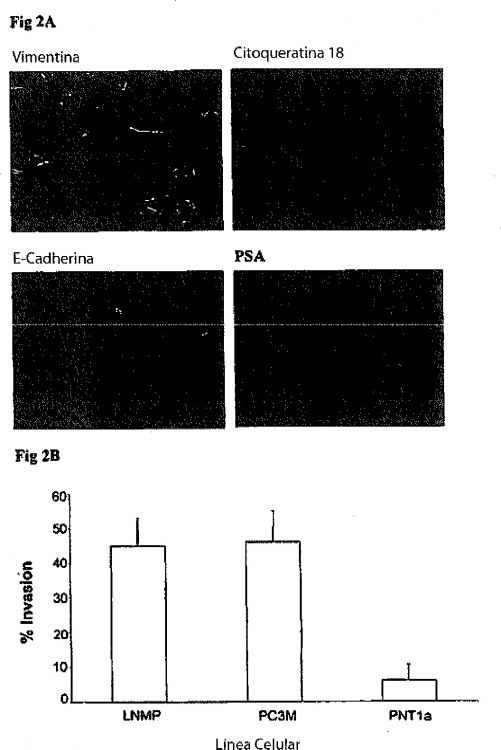
Se ha identificado CD133, que se expresa por células madre hematopoyéticas primitivas y epitelios en desarrollo como un marcador adicional de células madre para epitelios de la próstata. Las células CD133 están restringidas a la población a2ß1hi (el receptor para el colágeno tipo I) y se localizan en la capa basal, a menudo en la base de una región en germinación o punto de ramificación (Fig. 1A). Las células a2ß1hi /CD133+ muestran dos atributos importantes de células madre epiteliales: tienen un elevado potencial proliferativo in vitro (Fig. 1B) y pueden reconstituir acinos tipo prostáticos en ratones desnudos macho inmunocomprometidos (Fig. 1C).
Se han aislado directamente células madre de tumor de próstata a partir de nódulos linfáticos y glándulas prostáticas de una serie de muestras de pacientes usando los siguientes marcadores: antígeno epitelial humano (HEA), CD44 (que se expresa por células basales en la próstata; Liu et al., 1997), a2ß1hi y CD133. Morfológicamente, las células varían de fibroblastoides (que expresan elevados niveles de vimentina que es típica de células transformadas) o epiteliales, y son capaces de producir progenitores asociados con diferenciación epitelial prostática (Fig. 2A). Ensayos de invasión, usando filtros recubiertos con Matrigel han determinado que estas células tienen una capacidad similar de invadir a través de Matrigel que PC3M (una sublínea altamente metastásica de células PC3 (Fig. 2B).
Se describe un método para enriquecer selectivamente las células madre de próstata o células madre de cáncer de próstata que utiliza la adhesión diferencial a colágeno tipo I y el crecimiento de células madre en cultivo para seleccionar una población de células con potencial de células madre prostáticas.
De acuerdo con un aspecto de la invención, se proporciona un método para el aislamiento de células madre prostáticas, que comprende el enriquecimiento selectivo de células madre prostáticas que expresan el antígeno CD133. Preferiblemente, dichas células madre también expresan elevados niveles de integrina a2ß1.
En un método preferido de la invención, dicho enriquecimiento selectivo comprende las siguientes etapas:
En un método preferido de la invención, dicho método incluye las etapas adicionales de:
En un método alternativo de la invención, dicha matriz es una matriz peptídico no basada en colágeno. Un ejemplo de dicha matriz peptídico no basada en colágeno es PuraMatrixtm.
En un método preferido adicional de la invención, dichas células seleccionadas expresan antígeno epitelial, preferiblemente antígeno epitelial humano.
En un método preferido adicional más de la invención, dichas células seleccionadas expresan el antígeno CD44.
En método preferido adicional más de la invención, dichas células seleccionadas no expresan telomerasa.
En un método preferido de la invención, dicho tejido...
Reivindicaciones:
1. Un método para el aislamiento de células madre prostáticas cancerosas, que comprende el enriquecimiento selectivo de células madre prostáticas cancerosas que expresan el antígeno CD133, que comprende:
2. Un método de acuerdo con la reivindicación 1, en el que dichas células madre también expresan elevados niveles de integrina a2ß1.
3. Un método de acuerdo con la reivindicación 1 ó 2, donde dicho método incluye las etapas adicionales de:
4. Un método de acuerdo con cualquiera de las reivindicaciones 1-3, en el que dichas células seleccionadas expresan el antígeno epitelial.
5. Un método de acuerdo con la reivindicación 4, en el que dicho antígeno es el antígeno epitelial humano.
6. Un método de acuerdo con cualquiera de las reivindicaciones 1-5, en el que dichas células seleccionadas expresan el antígeno CD44.
7. Un método de acuerdo con cualquiera de las reivindicaciones 1-6, en el que dichas células madre prostáticas cancerosas se obtienen de tejidos derivado de próstata metastásica.
8. Un método de acuerdo con la reivindicación 7, en el que dichas células se obtienen de tumores de próstata metastáticos primarios.
9. Un método de acuerdo con cualquiera de las reivindicaciones 1-8, en el que dicha matriz basada en colágeno comprende colágeno 1.
10. Una célula madre prostática cancerosa que expresa el antígeno CD133 que se puede obtener por el método de acuerdo con cualquiera de las reivindicaciones 1-9.
11. Una célula madre prostática cancerosa de acuerdo con la reivindicación 10, donde dicha célula madre está clonada.
12. Un cultivo celular de células madre prostáticas cancerosas sustancialmente puras donde dichas células expresan el antígeno CD133.
13. Un cultivo de acuerdo con la reivindicación 12, en el que dichas células expresan elevados niveles de integrina a2ß1.
14. Un cultivo de acuerdo con la reivindicación 12 ó 13, en el que dichas células expresan el antígeno epitelial.
15. Un cultivo de acuerdo con la reivindicación 14, en el que dicho antígeno epitelial es el antígeno epitelial humano.
16. Un cultivo de acuerdo con cualquiera de las reivindicaciones 12-15, en el que las células expresan el antígeno CD44.
17. Un cultivo de acuerdo con la reivindicación 12, en el que dichas células expresan el antígeno CD133, elevados niveles de integrina a2ß1, el antígeno epitelial humano y el antígeno CD44.
18. Una preparación de células madre prostáticas cancerosas que expresa el antígeno CD133 que se puede obtener por el método de acuerdo con cualquiera de las reivindicaciones 1-9 para su uso como en una composición de vacuna.
19. Una composición de vacuna que comprende un cultivo de células madre prostáticas cancerosas de acuerdo con cualquiera de las reivindicaciones 12-17.
20. Una composición de acuerdo con la reivindicación 19, donde dicha composición incluye un adyuvante y/o un vehículo.
21. Un anticuerpo que se puede obtener por la inmunización de un animal con un cultivo de células madre prostáticas cancerosas de acuerdo con las reivindicaciones 12-17.
22. Un anticuerpo de acuerdo con la reivindicación 21, donde dicho anticuerpo es un anticuerpo monoclonal o fragmento de unión del mismo.
23. Un anticuerpo de acuerdo con la reivindicación 21 ó 22 para su uso como un agente farmacéutico.
24. Una composición farmacéutica que comprende un anticuerpo de acuerdo con la reivindicación 21 ó 22.
25. Un linfocito T que se puede obtener por inmunización de un animal con un cultivo de células madre prostáticas cancerosas de acuerdo con las reivindicaciones 12-17.
26. Un linfocito T de acuerdo con la reivindicación 25, donde dicho linfocito es un linfocito T auxiliar.
27. Un método para la identificación de genes que muestren expresión potenciada en células madre prostáticas cancerosas, que comprende las etapas de:
28. Un método de acuerdo con la reivindicación 27, donde dicho método incluye las etapas adicionales de:
29. Un método de acuerdo con la reivindicación 27 y 28, donde dicho método incluye una comparación de la señal de la serie producida entre células madre prostáticas normales y cancerosas.
30. Un método de acuerdo con la reivindicación 27 y 28, donde dicho método incluye una comparación de la señal de la serie producida entre una primera muestra de células madre prostática cancerosas y una segunda muestra de células madre prostáticas cancerosas diferente.
31. Un método para la preparación de una biblioteca que comprende productos de expresión génica específicos de próstata cancerosa, que comprende las etapas de:
32. Un método de acuerdo con la reivindicación 31, en el que dicho vector es un vector basado en fagos.
33. Un método in vitro para la formación de acinos tipo prostáticos, que comprende:
34. Un acino tipo prostático canceroso que puede obtenerse por el método de acuerdo con la reivindicación 33.
35. Un acino tipo prostático de acuerdo con la reivindicación 34, donde dicho acino comprende células prostáticas modificadas genéticamente.
36. Un método para identificar agentes capaces de inhibir la proliferación de células madre prostáticas cancerosas, que comprende:
37. Un método para identificar agentes capaces de inhibir la motilidad de células madre prostáticas cancerosas, que comprende:
38. Un método para identificar marcadores de diferenciación de células prostáticas, que comprende las etapas de:
39. Un método para identificar marcadores de transformación de células prostáticas, que comprende:
40. Un método de acuerdo con la reivindicación 39, en el que dicho gen es un oncogén.
41. Un método que usa un modelo animal no humano para el análisis de la formación de acinos prostáticos, que comprende las etapas de:
42. Un método de acuerdo con la reivindicación 41, en el que dicho animal se selecciona entre el grupo compuesto por: ratón, rata, cobaya, perro, primate no humano.
43. Un método de acuerdo con la reivindicación 42, en el que dicho animal es un ratón inmunocomprometido.
44. Un método de acuerdo con la reivindicación 43, en el que dicho mamífero es un ratón SCID o un ratón desnudo atímico.
45. Un método de acuerdo con cualquiera de las reivindicaciones 41-44, en el que dichas células se transplantan de forma subcutánea.
46. Un método de acuerdo con cualquiera de las reivindicaciones 41-44, en el que dichas células se transplantan de forma ortotópica en o alrededor del tejido prostático.
47. Un método in vitro para la formación de acinos prostáticos cancerosos vascularizados, que comprende las etapas de:
48. Un método in vitro para la formación de acinos tipo prostáticos cancerosos vascularizados, que comprende:
49. Un método de acuerdo con la reivindicación 47 ó 48, en el que dichas células madre prostáticas y células endoteliales son de origen humano.
Patentes similares o relacionadas:
USO MEDICINAL DE UN INHIBIDOR DE HISTONA DESACETILASA Y MÉTODO PARA EVALUAR SU EFECTO ANTITUMORAL, del 5 de Enero de 2012, de ASTELLAS PHARMA INC.: Un agente para el tratamiento del cáncer de próstata que comprende un compuesto representado por la fórmula (I) o una sal del mismo como ingrediente […]
COMPUESTOS QUE ANULAN EL PUNTO DE CONTROL G2 DEL CICLO CELULAR INDUCIDO POR DAÑOS EN EL ADN Y/O QUE INCREMENTAN LA ACTIVIDAD ANTICANCEROSA DE LOS TRATAMIENTOS QUE DAÑAN EL ADN, del 1 de Diciembre de 2011, de CANBAS CO., LTD.: Compuesto que presenta la estructura siguiente: en la que: R1 es bromo (Br), cloro (Cl), flúor (F) o yodo (I); R2 es bromo (Br), cloro (Cl), flúor (F), yodo (I), metilo […]
INHIBIDORES E LA HSP90 EXTRACELULAR, del 19 de Mayo de 2011, de TUFTS UNIVERSITY: Inhibidor de la Hsp90 extracelular humana seleccionado entre anticuerpos y fragmentos de anticuerpo que pueden unirse a la Hsp90 extracelular […]
 COMPOSICIONES PARA TERAPIA DE ENFERMEDADES ASOCIADAS CON LA EXPRESIÓN ABERRANTE DE KREMEN Y/O WNT, del 8 de Abril de 2011, de DEUTSCHES KREBSFORSCHUNGSZENTRUM STIFTUNG DES OFFENTLICHEN RECHTS: Molécula nucleotídica que codifica un polipéptido Kremen 1 y/o Kremen 2 o un polipéptido Kremen 1 y/o Kremen 2 para uso como medicamento
COMPOSICIONES PARA TERAPIA DE ENFERMEDADES ASOCIADAS CON LA EXPRESIÓN ABERRANTE DE KREMEN Y/O WNT, del 8 de Abril de 2011, de DEUTSCHES KREBSFORSCHUNGSZENTRUM STIFTUNG DES OFFENTLICHEN RECHTS: Molécula nucleotídica que codifica un polipéptido Kremen 1 y/o Kremen 2 o un polipéptido Kremen 1 y/o Kremen 2 para uso como medicamento
 DERIVADOS O-METILADOS DE RAPAMICINA PARA ALIVIAR E INHIBIR TRASTORNOS, del 3 de Enero de 2011, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Uso de un derivado de rapamicina que tiene la estructura química en la que X es (H, H) u O; Y es (H, OH) u O; R 1 se selecciona de alquilo, tioalquilo, arilalquilo, […]
DERIVADOS O-METILADOS DE RAPAMICINA PARA ALIVIAR E INHIBIR TRASTORNOS, del 3 de Enero de 2011, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Uso de un derivado de rapamicina que tiene la estructura química en la que X es (H, H) u O; Y es (H, OH) u O; R 1 se selecciona de alquilo, tioalquilo, arilalquilo, […]
RECEPTORES DE LA CITOQUINA DE CLASE II Y USOS DE LOS MISMOS, del 14 de Septiembre de 2010, de WYETH LLC: Uso de un modulador de un complejo de IL-22R e IL-20Rß, para la fabricación de un medicamento destinado al tratamiento de un sujeto que padece un neoplasma […]
 DETERMINACION SIMULTANEA DE LA ACTIVIDAD INHIBITORIA DE LA PROLIFERACION CELULAR Y LA TOXICIDAD UTILIZANDO CITOMETRIA DE FLUJO, del 10 de Septiembre de 2010, de F. HOFFMANN-LA ROCHE AG: Un método para la determinación simultánea de actividad inhibitoria de la proliferación celular y de toxicidad celular de un compuesto químico de bajo peso molecular […]
DETERMINACION SIMULTANEA DE LA ACTIVIDAD INHIBITORIA DE LA PROLIFERACION CELULAR Y LA TOXICIDAD UTILIZANDO CITOMETRIA DE FLUJO, del 10 de Septiembre de 2010, de F. HOFFMANN-LA ROCHE AG: Un método para la determinación simultánea de actividad inhibitoria de la proliferación celular y de toxicidad celular de un compuesto químico de bajo peso molecular […]
PROMOTOR DE LA FUSIÓN CELULAR Y UTILIZACIÓN DEL MISMO, del 6 de Septiembre de 2011, de KOWA COMPANY, LTD. KITAKAZE, MASAFUMI MINAMINO, TETSUO HIRATA, AKIO: Un método in vitro para producir células fusionadas, que comprende fusionar una célula madre somática y una célula somática en presencia de […]