BIS-(MONOETANOLAMINA) DE ACIDO 3'-((2Z)-(1-(3,4-DIMETILFENIL)-1,5-DIHIDRO-3-METIL-5-OXO-4H-PIRAZOL-4-ILIDENO)HIDRAZINO)-2'-HIDROXI-(1,1'-BIFENIL)-3-CARBOXILICO.
El compuesto bis-(monoetanolamina) de ácido 3''-[(2Z)-[1-(3,4-dimetilfenil)-1,
5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2''-hidroxi-[1,1''-bifenil]-3-carboxílico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US03/16255.
Solicitante: SMITHKLINE BEECHAM CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE FRANKLIN PLAZA P.O. BOX 7929,PHILADELPHIA, PA 19101.
Inventor/es: MOORE, STEPHEN.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K38/18B
- A61K38/19B
- A61K38/20 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interleuquinas.
- C07D231/46 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 231/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,2 o diazol-1,2 hidrogenado. › Atomo de oxígeno en posición 3 ó 5 y átomo de nitrógeno en posición 4.
Clasificación PCT:
- A61K31/4152 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo grupos oxo unidos directamente al heterociclo, p. ej. antipirina, fenilbutazona, sulfinpirazona.
- A61P7/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Agentes antitrombóticos; Anticoagulantes; Inhibidores de la agregación plaquetaria.
- C07D231/08 C07D 231/00 […] › con átomos de oxígeno o azufre unidos directamente a los átomos de carbono del ciclo.
Clasificación antigua:
- A61K31/4152 A61K 31/00 […] › teniendo grupos oxo unidos directamente al heterociclo, p. ej. antipirina, fenilbutazona, sulfinpirazona.
- A61P7/02 A61P 7/00 […] › Agentes antitrombóticos; Anticoagulantes; Inhibidores de la agregación plaquetaria.
- C07D231/08 C07D 231/00 […] › con átomos de oxígeno o azufre unidos directamente a los átomos de carbono del ciclo.
Fragmento de la descripción:
Bis-(monoetanolamina) de ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico.
La presente invención se refiere a un emulador mejorado de trombopoyetina (en lo sucesivo TPO), el ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico. El compuesto está representado por la estructura I:
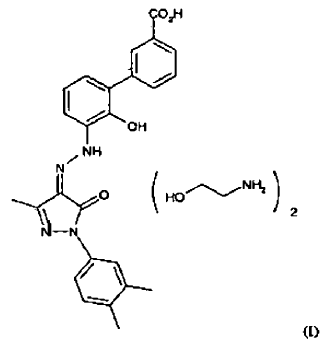
El compuesto de la presente invención es útil como un agonista del receptor de TPO, particularmente para ser usado en la mejora de la producción de plaquetaria.
Descripción detallada de la invención
El ácido 3'-{N'-[1-(3,4-dimetilfenil)-3-metil-5-oxo-1,5-dihidropirazol-4-ilideno]hidrazino}-2'-hidroxibifenil-3-carboxílico es un compuesto que es descrito y reivindicado junto con sus sales, hidratos, solvatos y ásteres farmacéuticamente aceptables, por ser útiles como un agonista del receptor de TPO, particularmente para ser usado en la mejora de la producción plaquetaria y, particularmente, para ser usado en el tratamiento de la trombocitopenia, en la solicitud internacional nº PCT/US01/16863, que tiene una fecha de presentación internacional de 24 de mayo de 2001, número de publicación internacional WO 01/89457 y fecha de publicación internacional de 29 de nombre de 2001; la solicitud internacional nº PCT/US 01/16863 no describe específicamente una forma de sal para ninguno de los compuestos descritos en la misma.
Se ha encontrado ahora sorprendentemente que la sal de bis-(monoetanolamina) del ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico tiene numerosas ventajas sobre el ácido libre. El ácido libre es escasamente soluble en agua (aproximadamente 5 microgramos por mililitro). Esta escasa solubilidad afecta adversamente a la capacidad del ácido libre para ser formulado en formas de dosificaciones farmacéutica y reduce la biodisponibilidad del compuesto in vivo.
Aunque el ácido libre es altamente útil como un agonista del receptor de TPO, particularmente para ser usado en la mejora de la producción plaquetaria y, particularmente, en el tratamiento de la trombocitopenia, la sal de bis-(monoetanolamina) de ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico tiene las ventajas añadidas de una solubilidad y biodisponibilidad mejoradas.
El compuesto de la presente invención, bis-(monoetanolamina) de ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico (en lo sucesivo, "ingrediente activo"), es útil como un agonista del receptor de TPO, particularmente para ser usado en la mejora de la producción plaquetaria y, particularmente, para ser usado en el tratamiento de la trombocitopenia. El ingrediente activo para ser usado en el tratamiento de la trombocitopenia puede ser administrado en una forma de dosificación convencional preparada combinando el ingrediente activo con un vehículo o diluyente convencional farmacéuticamente aceptable según técnicas fácilmente conocidas por los expertos en la técnica, como las descritas en la solicitud internacional nº PCT/US 01/16863. La vía de administración puede ser oral, parenteral o tópica. El término "parenteral", como se usa en la presente memoria descriptiva, incluye una administración intravenosa, intramuscular, subcutánea, intranasal, intrarrectal, intravaginal o intraperitoneal. Generalmente es preferida la administración oral.
Como se usa en la presente memoria descriptiva, el término "monoetanolamina" significa "2-aminoetanol".
Las dosis de ingrediente activo de la presente invención en una unidad de dosificación farmacéutica como se describió anteriormente será una cantidad eficaz y no tóxica, preferentemente seleccionada en el intervalo de 0,001-100 mg/kg de peso corporal total, preferentemente 0,001-50 mg/kg. Cuando se usa en el tratamiento de un paciente humano que necesita un emulador de TPO, la dosis seleccionada es administrada preferentemente de 1-6 veces al día, por vía oral o parenteral. Las formas preferidas de administración parenteral incluyen las vías tópica, rectal, transdermal, mediante inyección y continuamente mediante infusión. Las unidades de dosificación oral para una administración a seres humanos contienen preferentemente de 0,05 a 3500 de ingrediente activo, lo más preferentemente de 0,5 a 1000 mg de ingrediente activo. Es preferida una administración oral, que usa dosificaciones inferiores. Sin embargo, a dosis elevadas, puede ser usada también la administración parenteral cuando sea seguro y conveniente para el paciente. Las dosificaciones anteriores se refieren a la cantidad preferida del ingrediente activo expresada como el ácido libre.
Se reconocerá por un experto en la técnica que la cantidad óptima y la separación de las dosificaciones individuales del ingrediente activo se determinarán mediante la naturaleza y el alcance del estado que este siendo tratado, la forma, vía y sitio de administración y el paciente particular que esté siendo tratado, y que estas cantidades óptimas pueden ser determinadas mediante técnicas convencionales. Se apreciará también por un experto en la técnica que el curso óptimo de tratamiento, es decir, el número de dosis del ingrediente activo proporcionadas por día para un número definido de días, puede ser determinado por los expertos en la técnica usando los medios convencionales de ensayos de determinación del tratamiento.
De forma general, el compuesto de la presente invención es preparado disolviendo el ácido libre, ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico, en un disolvente orgánico apropiado, preferentemente tetrahidrofurano (en lo sucesivo THF) o etanol/IMS (alcohol desnaturalizado industrial), filtrando la mezcla resultante para separar los contaminantes y añadiendo seguidamente esta solución a una solución de dos o más equivalentes de etanolamina en un disolvente orgánico, preferentemente un disolvente miscible con agua, que puede contener una cantidad medida de agua, preferentemente hasta 5 volúmenes de agua, con respecto al ácido libre. El compuesto de la presente invención es separado por filtración y secado, por ejemplo, secado a vacío o secado con aire a una temperatura elevada.
La etanolamina, al 99%, fue adquirida de la empresa Aldrich Chemical Company, Milwaukee, Wisconsin.
El tetrahidrofurano (THF) y el alcohol desnaturalizado industrial 74 O.P. (IMS) fueron adquiridos de los laboratorios BDH Laboratory Supplies, Poole, Inglaterra.
Los siguientes ejemplos ilustran adicionalmente la presente invención.
Ejemplo 1
Preparación de bis-(monoetanolamina) de ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico
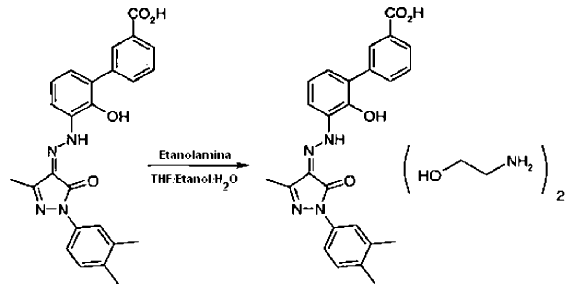
Se agitó ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hi- droxi-[1,1'-bifenil]-3-carboxílico, 1 g de sólido naranja en bruto, en 16,75 de THF a aproximadamente 30ºC. Se añadió lentamente agua (2,0 ml) para mantener una temperatura de más de 28ºC. Cuando se completó la adición, la temperatura se hizo volver a 30ºC y la solución se filtró a través de un cartucho de fibra de vidrio (filtros 2 x Whatman GFC) para separar la materia en forma de partículas. El filtro se lavó por medio de THF (2,0 ml) que se añadió al filtrado. El filtrado se dejó enfriar a temperatura ambiente. Se disolvió etanolamina (0,324 g, 2,35 equivalentes molares) en IMS (26 ml) y se agitó bajo una atmósfera de nitrógeno a temperatura ambiente. El filtrado que contenía el ácido libre se añadió a la solución de etanolamina durante 20 a 30 minutos. La suspensión oscura resultante se filtró durante 3 horas y el sólido se aisló por filtración y se secó a 50ºC en una estufa a vacío durante una noche para producir 1,22 g (96%) del compuesto del título.
RMN protónica (400 MHz, DMSO-d6 + 20 µl TFA, referida a DMSO-D5 d 2,5): d 2,21 (s, 3H), 2,26 (2, 3H), 2,31 (s, 3H), 2,85 (m, 4H)P, 3,57 (t, 4H)P, 7,07 (m), 7,14 (s), 7,18 (d, 3H solapado), 7,61 t), 7,63 (dd, 2H solapado), ~7,7 (m, 2H solapado), 7,78 (d),...
Reivindicaciones:
1. El compuesto bis-(monoetanolamina) de ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico.
2. El compuesto según la reivindicación 1, para ser usado en el tratamiento de trombocitopenia.
3. El compuesto para ser usado según la reivindicación 2, para ser administrado mediante la vía de administración oral.
4. El compuesto para ser usado según la reivindicación 2, para ser administrado mediante la vía de administración parenteral.
5. Un procedimiento para preparar el compuesto de la reivindicación 1, comprendiendo el procedimiento:
i) disolver ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hi- droxi-[1,1'-bifenil]-3-carboxílico en un disolvente orgánico apropiado, para formar una solución;
ii) añadir dos o más equivalentes de etanolamina a la solución; y
iii) aislar el compuesto preparado.
6. Un procedimiento según la reivindicación 5, que comprende:
- disolver ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hi- droxi-[1,1'-bifenil]-3-carboxílico en un disolvente orgánico apropiado,
- filtrar la mezcla resultante para separar contaminantes,
- añadir seguidamente esta solución a una solución de dos o más equivalentes de etanolamina en un disolvente orgánico, y
- filtrar y secar el compuesto.
7. Un procedimiento según la reivindicación 6, en el que el disolvente orgánico apropiado, en el que se disuelve el ácido libre, es tetrahidrofurano (THF) o etanol/IMS (en que IMS es alcohol desnaturalizado industrial).
8. Un procedimiento según la reivindicación 6 ó 7, en el que el disolvente orgánico, en el que está en solución la etanolamina, es un disolvente miscible con agua.
9. Una procedimiento según la reivindicación 8, en el que disolvente miscible con agua contiene hasta 5 volúmenes de agua con respecto al ácido libre.
10. Una composición farmacéutica, que comprende bis-(monoetanolamina) del ácido 3'-[(2Z)-[1-(3,4-dimetilfenil)-1,5-dihidro-3-metil-5-oxo-4H-pirazol-4-ilideno]hidrazino]-2'-hidroxi-[1,1'-bifenil]-3-carboxílico y un vehículo o diluyente farmacéuticamente aceptable.
11. Un procedimiento para preparar una composición farmacéutica que contiene un vehículo o diluyente farmacéuticamente aceptable y una cantidad eficaz de un compuesto como se describe en la reivindicación 1, comprendiendo el procedimiento llevar el compuesto descrito en la reivindicación 1 en asociación con el vehículo o diluyente farmacéuticamente aceptable.
12. Un procedimiento según la reivindicación 11, en el que la composición farmacéutica es adecuada para ser usada en el tratamiento de trombocitopenia.
13. Un procedimiento según la reivindicación 11, en el que la composición farmacéutica es adecuada para ser usada en un procedimiento para mejorar la producción plaquetaria en un ser humano que lo necesita, comprendiendo el procedimiento administrar a este ser humano una cantidad terapéuticamente eficaz del compuesto descrito en la reivindicación 1.
14. Un procedimiento según la reivindicación 11, en el que la composición farmacéutica es adecuada para ser usada en un procedimiento para tratar neuropenia en un ser humano que lo necesita, comprendiendo el procedimiento administrar a este ser humano una cantidad terapéuticamente eficaz del compuesto descrito en la reivindicación 1.
15. Un compuesto según la reivindicación 1 o una composición farmacéutica según la reivindicación 10, para ser usada en un procedimiento para tratar trombocitopenia en un ser humano que lo necesita, comprendiendo el procedimiento administrar a este ser humano una cantidad terapéuticamente eficaz del compuesto descrito en la reivindicación 1.
16. Un compuesto según la reivindicación 1 o una composición farmacéutica según la reivindicación 10, para ser usado en un procedimiento para mejorar la producción plaquetaria un ser humano que lo necesita, comprendiendo el procedimiento administrar a este ser humano una cantidad terapéuticamente eficaz de un compuesto descrito en la reivindicación 1.
17. Un compuesto o una composición farmacéutica para ser usado según la reivindicación 15, comprendiendo adicionalmente el procedimiento la administración conjunta de una cantidad terapéuticamente eficaz de un agente seleccionado entre el grupo que consiste en une factor estimulador de colonias, citoquina, quimioquina, interleucina o agonistas o antagonistas de receptores de citoquinas, receptores solubles, anticuerpos de agonistas o antagonistas de receptores de moléculas o péptidos pequeños que actúan mediante los mismos mecanismos de uno o más de dichos agentes.
18. Un compuesto o una composición farmacéutica para ser usado según la reivindicación 17, en los que el agente se selecciona entre el grupo que consiste en: G-CSF, GM-CSF, TPO, M-CSF, EPO, Gro-beta, IL-11, SCF, ligando FLT3, LIF, IL-3, LI-6,IL-1, progenipoyetina, NESP, SD-01, IL-8 o IL-5 o un derivado biológicamente activo de cualquiera de dichos agentes.
19. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es mielosupresión provocada por quimioterapia o terapia de radiaciones.
20. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a un transplante de órganos.
21. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a un transplante de médula ósea, células madre o de hígado.
22. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a púrpura trombocitopénica y idiopática (ITP).
23. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a síndromes mielodisplásticos (MDS).
24. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a una infección viral, fúngica, microbiana o parasitaria.
25. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a una disfunción hepática.
26. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a procedimientos quirúrgicos.
27. Un compuesto o composición farmacéutica para ser usado según la reivindicación 15, en el que dicha trombocitopenia es debida a un tratamiento con agentes antivirales o antibióticos.
28. Un compuesto según la reivindicación 1 o una composición farmacéutica según la reivindicación 10, para ser usado en un procedimiento para tratar neuropenia en un ser humano que lo necesita, comprendiendo el procedimiento administrar a este ser humano una cantidad terapéuticamente eficaz de un compuesto descrito en la reivindicación 1.
29. Un compuesto según la reivindicación 1 o una composición farmacéutica según la reivindicación 10, para ser usado en un procedimiento para mejorar la producción plaquetaria obtenida a partir de un donante, comprendiendo el procedimiento administrar a este donante una cantidad terapéuticamente eficaz de un compuesto descrito en la reivindicación 1 antes de la aféresis plaquetaria, donación de sangre o donación de plaquetas.
30. Un compuesto según la reivindicación 1 o una composición farmacéutica según la reivindicación 10, para ser usado en un procedimiento para mejorar el número de células madre de sangre periférica obtenida de un donante, comprendiendo el procedimiento administrar a este donante una cantidad terapéuticamente eficaz de un compuesto como se describe en la reivindicación 1, antes de la leucaféresis.
31. Un compuesto o una composición farmacéutica para ser usado según la reivindicación 30, comprendiendo adicionalmente el procedimiento la administración conjunta de una cantidad terapéuticamente eficaz de un agente movilizador de células hematopoyéticas seleccionado entre el grupo que consiste en: factor estimulador de colonias, citoquina, quimioquina, interleucina o agonista de receptor de citoquinas, antagonistas o anticuerpos de moléculas de adhesión.
32. Un compuesto o una composición farmacéutica para ser usado según la reivindicación 31, en el que el agente movilizador se selecciona entre el grupo que consiste en: G-CSF, GM-CSF, TPO, EPO, Gro-beta, IL-8, citoxano, inhibidores de VLA-4, SCF, ligando FLT3 o un derivado biológicamente activo de G-CSF, GM-CSF, TPO, EPO, Gro-beta o IL-8.
33. Una composición farmacéutica según la reivindicación 10, adecuada para una administración conjunta con una cantidad terapéuticamente eficaz de un agente seleccionado entre el grupo que consiste en: un factor estimulador de colonias, citoquina, quimioquina, interleucina o agonista de receptor de citoquinas.
34. La composición según la reivindicación 33, en la que el agente se selecciona entre el grupo que consiste en: G-CSF, GM-CSF, TPO, M-CSF, EPO, Gro-beta, IL-11, SCF, ligando FLT3, LIF, IL-3, IL-6, IL-1 o IL-5 o un derivado biológicamente activo de cualquiera de dichos agentes.
35. Un procedimiento in vitro para mejorar la estimulación de la maduración de megacariocitos y/o la producción de plaquetas, que comprende añadir una cantidad eficaz de un compuesto según la reivindicación 1 a un medio de cultivo de células que expresan el receptor de TPO.
36. Un procedimiento in vitro según la reivindicación 35 para mejorar la estimulación de la maduración de megacariocitos y/o la producción de plaquetas, que comprende añadir una cantidad eficaz de un compuesto según la reivindicación 1 a un medio de cultivo de células madre, células de médula ósea, células de sangre del cordón umbilical o células de sangre periférica.
37. Un procedimiento in vitro o ex vivo para mejorar la supervivencia y/o proliferación de células madre, células de medula ósea, células de sangre del cordón umbilical, células de sangre periférica u otros tipos de células que expresan el receptor de TPO en un cultivo, que comprende cultivar dichas células en un medio que contiene una cantidad eficaz de un compuesto como se describe en la reivindicación 1.
38. Un procedimiento según la reivindicación 37, que comprende adicionalmente la administración conjunta de una cantidad eficaz de un factor estimulador de colonias, citoquina, quimioquina, interleucina o agonista de receptores de citoquinas.
39. Un procedimiento in vitro o ex vivo para mejorar la estimulación de la producción de neutrófilos, que comprende añadir una cantidad eficaz de un compuesto como se describe en la reivindicación 1 a un medio de cultivo de células madre, células de medula ósea, células de sangre del cordón umbilical, células de sangre periférica u otros tipos de células que expresan el receptor de TPO.
Patentes similares o relacionadas:
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]
Liposomas que encapsulan conjuntamente un bifosfonato y un agente anfipático, del 17 de Junio de 2020, de YISSUM RESEARCH DEVELOPMENT COMPANY OF THE HEBREW UNIVERSITY OF JERUSALEM LTD: Un liposoma que comprende una membrana y una fase de agua intraliposómica acuosa, comprendiendo la membrana al menos un lípido que forma un liposoma y […]
Terapia génica y electroporación para el tratamiento de neoplasias malignas, del 27 de Mayo de 2020, de OncoSec Medical Incorporated: Un plasmido que codifica para una forma soluble de un agonista de GITR, CD137, CD134, CD40L o CD27 para usar en un metodo de tratamiento de un sujeto con un […]
Régimen de dosificación de IL-2 para tratar lupus eritematoso sistémico, del 27 de Mayo de 2020, de ASSISTANCE PUBLIQUE, HOPITAUX DE PARIS: Interleucina-2 (IL-2) para su uso en el tratamiento del lupus eritematoso sistémico en un sujeto humano, donde la IL-2 debe administrarse en una […]
Variantes de IL-2 modificadas que activan selectivamente las células T reguladoras para el tratamiento de enfermedades autoinmunes, del 20 de Mayo de 2020, de Delinia, Inc: Una composición farmacéutica formulada para administración parenteral, que comprende una proteína variante de IL-2 que tiene por lo menos un 95% de identidad de secuencia […]
Regímenes de aumento escalonado de la dosis del heterodímero de il-15 e il-15ralfa para tratar afecciones, del 20 de Mayo de 2020, de NOVARTIS AG: Un complejo de IL-15/IL-15Rα para su uso en el tratamiento de linfocitopenia, cancer o una enfermedad infecciosa en un sujeto humano, o para […]
Composiciones y procedimientos para el tratamiento de afecciones degenerativas de la retina, del 6 de Mayo de 2020, de The Provost, Fellows, Foundation Scholars, & the other members of Board, of the College of the Holy & Undiv. Trinity of Queen: Interleucina-18 (IL-18), preferiblemente IL-18 recombinante (rIL-18), para uso en el tratamiento de la degeneración macular asociada con la edad relacionada con […]
Implantación de embriones, del 22 de Abril de 2020, de Ostara Biomedical Ltd: Un método no terapéutico para mejorar las tasas de preñez en hembras no humanas antes de la implantación de un embrión o antes de la inseminación, que […]