BIOSENSOR DE CREATININA ESTABLE PARA TRES ENZIMAS.
Un método para preparar un biosensor de tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos,
comprendiendo dicho biosensor una pluralidad de enzimas inmovilizadas, comprendiendo dicho método la aplicación a dicho biosensor de una composición enzima-polímero que comprende dicha pluralidad de enzimas inmovilizadas, siendo inmovilizadas dichas enzimas por medio de enlaces covalente, comprendiendo dicho método una etapa inicial de modificación química de dichas enzimas enlazando una o más cadenas de polietilen glicol (PEG) por monómero de enzima, donde dicha pluralidad de enzimas inmovilizadas comprende al menos dos de creatinina amidohidrolasa, creatina amidinohidrolasa y sarcosina oxidasa
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/035959.
Solicitante: SIEMENS HEALTHCARE DIAGNOSTICS INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 511 BENEDICT AVENUE,TARRYTOWN, NY 10591.
Inventor/es: CHAN, ANDY D.C., BODEN, MARK W., BERBERICH,JASON, RUSSELL,ALAN.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C12Q1/00B6
Clasificación PCT:
- C12Q1/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
Fragmento de la descripción:
Biosensor de creatinina estable para tres enzimas.
Campo de la invención
La presente invención se relaciona en general con el campo de la medicina diagnóstica y, más específicamente, con métodos para producir un biosensor de uso múltiple para la determinación amperométrica de creatinina que incluye un biopolímero de enzimas inmovilizadas.
Antecedentes de la invención
La determinación de los niveles de creatinina influidos biológicos es una necesidad clínica importante creciente. Los biosensores amperométricos se han desarrollado con base en un sistema de tres enzimas que convierten la creatinina en peróxido de hidrógeno medible amperométricamente. Debido a la complejidad del sistema de tres enzimas, el desarrollo de estos biosensores ha sido lento.
La incorporación de enzimas en redes de polímeros a través de uniones multipunto es una estrategia rápida y efectiva para potenciar la estabilidad de las enzimas, a la vez que retienen la actividad. Esta estrategia involucra la producción de bioplásticos en una etapa individual, empleando ligómeros capaces de reaccionar químicamente con funcionalidades específicas sobre la superficie de la enzima.
La utilidad de las enzimas en biosensores está limitada por su estabilidad. Los analizadores clínicos de sangres requieren enzimas que se usen una y otra vez mientras están en contacto con la sangre entera. Muchos analizadores de sangre operan a 37ºC lo cual limita adicionalmente la estabilidad de la enzima. Una variedad de procedimientos de inmovilización está descrita en la literatura para uso con biosensores. Aunque la mayor parte de los procedimientos descritos sugieren ser útiles para los biosensores, frecuentemente no están probados bajo condiciones que serían aplicables en condiciones de la vida real, tales como temperatura ambiente o a 37ºC mientras está en contacto con el fluido. La inmovilización de la enzima es especialmente crítica para el uso continuo de biosensores donde la pérdida de enzima puede ser una preocupación.
La inmovilización de la enzima en un biopolímero
mediante uniones covalentes multipunto proporciona un método directo y conveniente para la preparación de enzimas inmovilizadas para los biosensores. No solamente la inmovilización covalente con puntos múltiples previene la pérdida de enzima, sino que también incrementa la estabilidad de la enzima al calor, pH, solventes orgánicos, peróxidos y la degradación proteolítica y microbiana.
Así, hay necesidad para el desarrollo de biosensores de uso múltiple que tengan incorporadas como componente enzimas estables que retengan su actividad. La presente invención satisface esta necesidad y proporciona ventajas relacionadas.
Resumen de la invención
La invención proporciona métodos para preparar un biosensor de tres enzimas de uso múltiple estable para la determinación amperométrica de creatinina en líquidos biológicos que tiene un tiempo de vida útil significativamente más allá de los biosensores amperómetricos disponibles actualmente. El biosensor preparado por lo métodos de la invención abarca una pluralidad de enzimas inmovilizadas que son aplicadas al biosensor como una composición enzima-polímero. Las enzimas, que pueden incluir creatinina amidohidrolasa, creatina amidinohidrolasa y sarcosina oxidasa, se inmovilizan en la composición enzima-polímero simultáneamente a medida que son aplicadas al biosensor de manera simultánea. Antes de ser inmovilizadas las enzimas son modificadas químicamente enlazando una o más cadenas de polietilen glicol (PEG) por monómero de enzima. El componente polimérico puede ser suministrado mediante una membrana de poliuretano. La invención también provee un método para preparar un biosensor que limita la difusión de los iones plata que emanan del electrodo de referencia, previniendo por lo tanto el contacto entre los iones plata y las enzimas. También se proveen métodos relacionados para preparar una composición enzima-polímero para incorporación en un biosensor de tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos. La invención también proporciona biosensores para uso múltiple y composiciones enzima-polímeros preparados por los métodos divulgados.
Breve descripción de los dibujos
La Figura 1 muestra la retención de actividad de MSOX PEGilada modificada utilizando PEG-NCO a pH 7.5 (círculos cerrado) y pH 8.5 (cuadrados cerrados).
La Figura 2 muestra la retención de actividad de MSOX después de la PEGilación en la presencia de inhibidores (10: 1 (sólido) y 10: 1 (blanco) relación isocianato a amina). La concentración de inhibidor fue 50 mM.
La Figura 3 muestra la estabilidad de la sarcosina oxidasa como una función del número de PEGs unidos a 37ºC. La enzima nativa (cuadrados abiertos); un PEG unido (cuadrados cerrados); dos PEGs unidos (círculos cerrados).
La Figura 4 muestra la actividad relativa de la MSOX que contiene poliuretanos como una función del contenido de enzimas.
La Figura 5 muestra la posibilidad de reutilizar los hidrogeles de poliuretano que contienen MSOX.
La Figura 6 muestra la pérdida de sarcosina oxidasa a partir de los geles de poliuretano. 1 mg de MSOX/g polímero (triángulos cerrados); 2 mg de MSOX/g polímero (cuadrados abiertos).
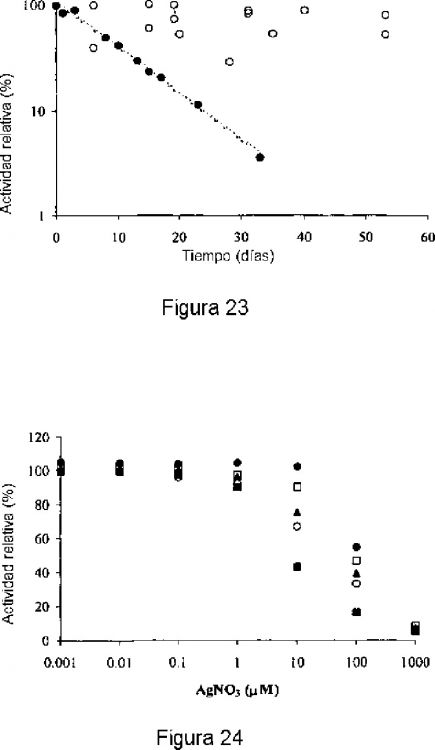
La Figura 7 muestra la estabilidad de MSOX que contienen hidrogeles de poliuretano almacenados en regulador a 37ºC. Las ratas fueron normalizadas con respecto a la rata de consumo de oxígeno después del primer día. Enzima nativa (círculos cerrados); enzima inmovilizada (círculos abiertos).
La Figura 8 muestra la inhibición irreversible inducida por iones de la actividad de la sarcosina oxidasa. Tiempo de incubación: 5 min (círculos cerrados); 1 hora (cuadrados abiertos); 3 horas (triángulos cerrados; 5 horas (círculos abiertos); 21 horas (cuadrados cerrados).
La Figura 9 muestra la estabilidad de creatina amidinohidrolasa como una función de número de PEGs unidos a 37ºC. Enzima nativa (diamantes cerrados). Un PEG unido (triángulos cerrados); tres PEGs unidos (círculos cerrados); cinco PEGs unidos (cuadrados cerrados).
La figura 10 muestra la estabilidad de los hidrogeles de poliuretano que contienen creatina amidinohidrolasa almacenados en un regulador a 37ºC. Las ratas fueron normalizadas con respecto a la rata de consumo de oxígeno después del primer día. Enzima nativa (círculos abiertos); enzima inmovilizada: 10 unidades/g polímero (triángulos cerrados); 50 unidades/g de polímero (cuadrados cerrados); 100 unidades/g de polímero (círculos cerrados).
La Figura 11 muestra la desactivación inducida por plata de la creatina amidinohidrolasa en solución. Tiempo de incubación: 5 min (círculos cerrados); 15 min (cuadrados cerrados).
La Figura 12 muestra la protección de la creatina amidinohidrolasa de la inactivación inducida por plata.
La Figura 13 muestra las fluctuaciones residuales en creatinasa. Panel (A) Comparación de la predicción (mediante GNM; mostrado en azul) y lo experimental (rayos-X cristalográficos; rojo) de factores B. Panel (B) diagrama de cinta con codificación de color del monómero mostrando las regiones más flexibles (picos en panel a) en rojo, y las menos flexibles (mínimas) en azul. El diagrama de cinta de panel (C) ilustra las posiciones relativas de los monómeros A y B con respecto al ligando.
La Figura 14 muestra la distribución de las movilidades en el modo global dominante del dímero de creatinasa. Los residuos catalíticos Phe62, Arg64, His231, Tyr257, Glu261, Arg334 y Glu357 son mostrados mediante los círculos azules abierto y Cys60, Cys249 y Cys297 son mostrados mediante cuadrados naranja, en ambos monómeros (separados por la línea punteada). Las flechas rojas indican los residuos catalíticos que coordinan el CMS en la estructura cristalina examinada.
La Figura 15 en el Panel (A) muestra el diagrama de cintas codificadas por color que ilustra la movilidad de los residuos de creatinasa en movimientos globales. Los colores azul-verde-amarillos-naranja-rojo son utilizados en el orden de movilidad creciente. El análogo de la creatina, CMS, se muestra en una representación llenando espacios. Las flechas amarillas indican las tres cisteínas (mostradas en bolas y barras) sobre el monómero B, y la flecha blanca el CYs60 sobre el monómero A. Los átomos en CMS y las cisteínas están coloreados según la convención CPK. El Panel (B) muestra la dinámica cerca del sitio activo. El análogo...
Reivindicaciones:
1. Un método para preparar un biosensor de tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos, comprendiendo dicho biosensor una pluralidad de enzimas inmovilizadas, comprendiendo dicho método la aplicación a dicho biosensor de una composición enzima-polímero que comprende dicha pluralidad de enzimas inmovilizadas, siendo inmovilizadas dichas enzimas por medio de enlaces covalente, comprendiendo dicho método una etapa inicial de modificación química de dichas enzimas enlazando una o más cadenas de polietilen glicol (PEG) por monómero de enzima, donde dicha pluralidad de enzimas inmovilizadas comprende al menos dos de creatinina amidohidrolasa, creatina amidinohidrolasa y sarcosina oxidasa.
2. El método de la reivindicación 1, donde dichas enzimas son inmovilizadas simultáneamente en la composición enzima-polímero.
3. El método de la reivindicación 1, donde dichas enzimas son aplicadas a dicho sensor simultáneamente.
4. El método de la reivindicación 1, donde antes de dicha modificación dicha sarcosina oxidasa se pone en contacto con un inhibidor en una cantidad efectiva para prevenir la inactivación durante la modificación.
5. El método de la reivindicación 4, donde dicho inhibidor es ácido pirrol-2-carboxílico o ácido (metiltio) acético.
6. El método de cualquiera de las reivindicaciones precedentes, donde dicho polímero es seleccionado del grupo consistente de poliuretano, cloruro de polivinilo, poliéster, policarbonato, copolímero de acetato de vinilo, nylon, poli (1,4-butilentereftalato), propionato de celulosa, copolímero de etileno/ácido acrílico, polibutadieno, polietileno, polipropileno, poliimida, película acrílica, poliestireno y fluoruro de polivinilo.
7. El método de la reivindicación 4, donde dicha composición enzima-polímero comprende poliuretano.
8. El método de cualquiera de las reivindicaciones precedentes, donde el biosensor comprende al menos un electrodo de trabajo, al menos un electrodo de referencia y al menos un contraelectrodo.
9. El método de la reivindicación 8, donde la composición enzima-polímero se aplica a dicho electrodo de trabajo, dicho electrodo de referencia y dicho contraelectrodo.
10. El método de la reivindicación 8 o 9, donde dicho electrodo de referencia es un electrodo Ag/AgCl.
11. El método de la reivindicación 10, donde dicho electrodo de referencia está recubierto con un material que limita la difusión de iones plata que emanan de dicho electrodo de referencia, previniendo por tanto el contacto entre los iones plata y las enzimas.
12. Un método para la preparación de una composición enzima-polímero que comprende
13. El método de la reivindicación 12, donde dicho inhibidor es un ácido pirrol-2-carboxílico o ácido (metiltio) acético.
14. El método de la reivindicación 12 o 13, donde dicho polímero es seleccionado de un grupo consistente de poliuretano, cloruro de polivinilo, poliéster policarbonato, copolímero de acetato de vinilo, nylon, poli (1,4-butilentereftalato), propionato de celulosa, copolímero de etileno/ácido acrílico, polibutadieno, polietileno, polipropileno, poliimida, película acrílica, polistireno y fluoruro de polivinilo.
15. El método de la reivindicación 14, donde dicha composición enzima-polímero comprende poliuretano.
16. Un biosensor para tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos que comprende una composición enzima-polímero que comprende las enzimas creatinina amidohidrolasa, creatina aminohidrolasa y sarcosina oxidasa, donde al menos una de las dichas enzimas está enlazada a una o más cadenas de polietilen glicol (PEG) e inmovilizada en la composición por dicha una o más cadenas de PEG.
Patentes similares o relacionadas:
SENSOR DE NITRÓGENO UREICO EN SANGRE (BUN), del 13 de Julio de 2011, de ABBOTT POINT OF CARE, INC: Dispositivo para detectar urea en una muestra, que comprende: (a) un sensor con el que puede ponerse en contacto una muestra que se sospecha que contiene urea, incluyendo […]
 ELECTRODO PARA BIOSENSOR, del 22 de Diciembre de 2010, de ABBOTT LABORATORIES: Una tira de electrodos desechable de un solo uso para la unión al circuito de lectura de señales de un sistema sensor para detectar una corriente representativa de un analito […]
ELECTRODO PARA BIOSENSOR, del 22 de Diciembre de 2010, de ABBOTT LABORATORIES: Una tira de electrodos desechable de un solo uso para la unión al circuito de lectura de señales de un sistema sensor para detectar una corriente representativa de un analito […]
 MICROSENSOR PARA LA DETECCION DE D-AMINOACIDOS, del 24 de Mayo de 2010, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
UNIVERSITE CLAUDE BERNARD - LYON 1
UNIVERSITE PARIS XI
UNIVERSITE D'INSUBRIA: Un microelectrodo para medir y/o detectar la concentración de D-serina, y dicho microelectrodo comprende:
- un medio para la oxidación de dicha D-serina, […]
MICROSENSOR PARA LA DETECCION DE D-AMINOACIDOS, del 24 de Mayo de 2010, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
UNIVERSITE CLAUDE BERNARD - LYON 1
UNIVERSITE PARIS XI
UNIVERSITE D'INSUBRIA: Un microelectrodo para medir y/o detectar la concentración de D-serina, y dicho microelectrodo comprende:
- un medio para la oxidación de dicha D-serina, […]
 BIOSENSOR, del 13 de Enero de 2010, de MATSUSHITA ELECTRIC INDUSTRIAL CO., LTD.: Biosensor que comprende una primera placa aislante de base que tiene un electrodo de trabajo, una segunda placa aislante de base que tiene […]
BIOSENSOR, del 13 de Enero de 2010, de MATSUSHITA ELECTRIC INDUSTRIAL CO., LTD.: Biosensor que comprende una primera placa aislante de base que tiene un electrodo de trabajo, una segunda placa aislante de base que tiene […]
 BIOSENSOR, del 7 de Enero de 2010, de CCI CORPORATION
ULTIZYME INTERNATIONAL LTD: Biosensor para medir la concentración de grasas neutras en base al valor de la corriente que fluye en un sistema de electrodos, que comprende: un sustrato aislante; […]
BIOSENSOR, del 7 de Enero de 2010, de CCI CORPORATION
ULTIZYME INTERNATIONAL LTD: Biosensor para medir la concentración de grasas neutras en base al valor de la corriente que fluye en un sistema de electrodos, que comprende: un sustrato aislante; […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Sistema y método para medir una concentración de analito corregida usando un sensor electroquímico, del 20 de Mayo de 2020, de CILAG GMBH INTERNATIONAL: Un método para determinar una concentración de un analito en una muestra, el método comprendiendo: introducir una muestra que incluye un analito en una […]