ANTICUERPOS REPARADOS CON CDR.
Método de preparación de un anticuerpo alterado que comprende incorporar residuos de la región hipervariable no humana en una región de entramado humana aceptora,
y que además comprende introducir una o más sustituciones de aminoácidos en una o más regiones hipervariables, sin modificar la secuencia de la región de entramado humana aceptora, y seleccionar un anticuerpo con un valor de afinidad de unión (Kd) de no más de aproximadamente 5 x 10-7 M
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/005270.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY,SOUTH SAN FRANCISCO CA 94080-4.
Inventor/es: DENNIS, MARK, S..
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07K16/28B12
- C07K16/28Z
- C07K16/42M10
- C07K16/46B2
Clasificación PCT:
- C07K16/46 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
Clasificación antigua:
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
Fragmento de la descripción:
Anticuerpos reparados con CDR.
Campo de la invención
La presente invención se refiere a la restauración de la unión a antígeno durante la humanización de anticuerpos mediante la selección de regiones hipervariables reparadas en vez de mediante cambios en el entramado.
Antecedentes de la invención
Muchos anticuerpos monoclonales potencialmente interesantes pueden producirse rápidamente en el sistema inmunitario del ratón para estudios biológicos. Sin embargo, en una práctica clínica, el uso de estos anticuerpos murinos puede dar como resultado una respuesta de los anticuerpos humanos anti-ratón (HAMA), anulando así su utilidad. Un método de transferencia de la información de la unión a antígeno murino a un aceptor de anticuerpo humano no inmunogénico, un procedimiento conocido como humanización, ha dado como resultado muchos fármacos terapéuticamente útiles. Generalmente, el método de humanización comienza mediante la transferencia de las seis regiones determinantes de complementariedad (CDR) murinas en una región de entramado de anticuerpo humano (Jones et al., Nature 321, 522-525 (1986)). Generalmente, estos anticuerpos con CDR injertadas no conservan su afinidad original para la unión a antígeno, y de hecho, a menudo la afinidad se ve gravemente alterada. Además de las CDR, también deben incorporarse residuos de la región de entramado de anticuerpo no humano seleccionados para mantener la conformación de CDR apropiada (Chothia et al., Nature 342:877 (1989)). Se ha demostrado que la transferencia de residuos clave de la región de entramado de ratón al aceptor humano con el fin de apoyar la conformación estructural de las CDR injertadas, restaura la afinidad y la unión a antígeno (Riechmann et al., J. Mol. Biol. 224, 487-499 (1992); Foote and Winter, J. Mol. Biol., 224:487-499 (1992); Presta et al., J. Immunol. 151, 2623-2632 (1993); Werther et al., J. Immunol. Methods 157:4986-4995 (1996); y Presta et al., Thromb. Haemost. 85:379-389 (2001)). Se han identificado muchas de las posiciones de la región de entramado que es posible que afecten la afinidad, por tanto el modelamiento estructural para seleccionar nuevos residuos de una manera gradual generalmente puede conducir a variantes con unión a antígeno restaurada. Alternativamente, también pueden usarse bibliotecas de anticuerpos de fagos dirigidos hacia estos residuos para mejorar y acelerar el proceso de maduración de la afinidad (Wu et al., J. Mol. Biol. 294:151-162 (1999) y Wu, H., Methods in Mol. Biol. 207:197-212 (2003)).
Se han tomado dos enfoques cuando se elige un aceptor humano de partida. Un enfoque compara la secuencia del anticuerpo murino con una lista de secuencias de anticuerpos humanos conocidos, con el fin de elegir el anticuerpo humano más homólogo al anticuerpo murino (Shearman et al., J. Immunol. 147:4366 (1991); Kettleborough et al., Protein Eng. 4, 773 (1991); Tempest et al., Biotechnology 9:266 (1991); Co et al., Proc. Natl. Acad. Sci. USA 88:2869 (1991); Routledge et al., Eur. J. Immunol. 21:2717 (1991)). Este enfoque se diseña para reducir la probabilidad de alterar la integridad de las CDR tras injertarlas en el nuevo aceptor humano. Un segundo enfoque utiliza una región de entramado consenso humana derivada de subgrupos humanos de VL y VH. Eligiendo la secuencia usada más frecuentemente como un aceptor, se ha demostrado que este enfoque reduce el potencial de una respuesta inmunológica al anticuerpo humanizado (Presta et al., J. Immunol. 151:2623-2632 (1993)). Tras la transferencia de residuos de CDR en un aceptor elegido mediante cualquiera de estos métodos, ha sido necesario alterar los residuos de la región de entramado en el aceptor con el fin de restaurar y mejorar la afinidad de la unión a antígeno.
Los anticuerpos humanizados anti-IgE, anti-CD11a y anti-factor tisular (FT) se han descrito en Presta et al., J. Immunol. 151, 2623-2632 (1993), Werther et al., J. Immunol. Methods 157:4986-4995 (1996) y Presta et al., Thromb. Haemost. 85:379-389 (2001), respectivamente.
Las publicaciones de patentes que describen variantes de anticuerpos humanizados incluyen la patente estadounidense n.º 6.407.213 y los documentos WO92/22653 (Carter y Presta), WO98/45332 (Wells et al.), WO98/45331 (Baca et al.), así como los documentos US2003/0228663A1 y WO03/087131A2 (Lowman et al.)
El documento US 2004/0162413, Watkins et al., publicado en agosto de 2004 se refiere a métodos para optimizar la afinidad de la unión de la región variable del anticuerpo. El documento WO03/105782 A2, Rybak et al., publicado en diciembre de 2003, hace referencia al injerto de especificidad de un anticuerpo murino en una región de entramado humana.
Sumario de la invención
Las interacciones moleculares entre regiones hipervariables y la antigua región de entramado a menudo se pierden tras el injerto de regiones hipervariables en una nueva región de entramado, dando como resultado una perturbación de estas regiones hipervariables y una pérdida en la afinidad de unión a antígeno. En lugar de transferir residuos murinos que interaccionan con la(s) región/regiones hipervariable(s) a la nueva región de entramado, la presente solicitud demuestra que el ajuste molecular entre la nueva región de entramado y la región hipervariable injertada puede restaurarse mediante el cambio de residuos que residen dentro de la(s) región/regiones hipervariable(s). Usando una biblioteca de fagos diseñada para mantener un sesgo en la secuencia hacia las regiones hipervariables injertadas, se introdujeron mutaciones en las seis regiones hipervariables y se seleccionaron clones con alta afinidad de unión a antígeno, pero que carecían de cualquier cambio en la región de entramado. En esta solicitud, se demuestra que la unión de alta afinidad puede restaurarse rápidamente mediante ligeras modificaciones en regiones hipervariables murinas injertadas en un aceptor humano, sin ningún cambio en los residuos de la región de entramado.
En el método de preparar un anticuerpo alterado descrito a continuación, se consideran diversas formas del anticuerpo alterado. Por ejemplo, el anticuerpo alterado puede ser un anticuerpo intacto (por ejemplo, un anticuerpo frente a IgG1 humana) o un fragmento del anticuerpo (por ejemplo, un Fab o F(ab')2). Además, el anticuerpo alterado puede estar marcado con un marcador detectable, inmovilizado en una fase sólida y/o conjugado con un compuesto heterólogo (tal como un agente citotóxico).
La invención proporciona un método de preparación de un anticuerpo alterado que comprende incorporar residuos de la región hipervariable no humana en una región de entramado humana aceptora, y que comprende además introducir una o más sustituciones de aminoácidos en una o más regiones hipervariables, sin modificar la secuencia de la región de entramado humana aceptora, y seleccionar un anticuerpo con un valor de afinidad de unión (Kd) de no más de aproximadamente 5 x 10-7 M.
Aún en un aspecto adicional, la invención proporciona un método de selección de un anticuerpo alterado que comprende:
Breve descripción de los dibujos
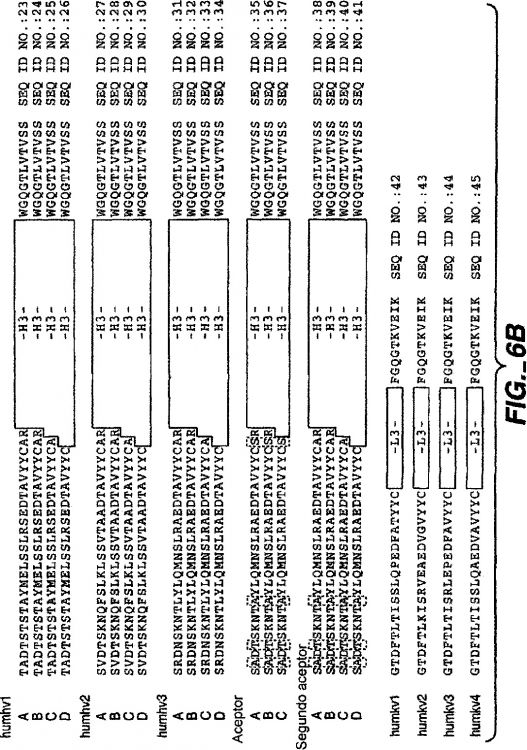
Las figuras 1A-1B representan secuencias de aminoácidos de la región de entramado consenso humana aceptora y los anticuerpos monoclonales murinos: MHM24 (que se une a CD11a), Mae11 (que se une a IgE) y D3 (que se une al factor tisular, FT). La numeración es según Kabat et al. (Kabat et al., Sequences of Proteins of Immnunological Interest, 5ª ed., Servicio de Salud Pública, Institutos Nacionales de Salud, Bethesda, MD (1991)). Las regiones hipervariables extendidas están enmarcas en un recuadro. Las diferencias entre la región de entramado...
Reivindicaciones:
1. Método de preparación de un anticuerpo alterado que comprende incorporar residuos de la región hipervariable no humana en una región de entramado humana aceptora, y que además comprende introducir una o más sustituciones de aminoácidos en una o más regiones hipervariables, sin modificar la secuencia de la región de entramado humana aceptora, y seleccionar un anticuerpo con un valor de afinidad de unión (Kd) de no más de aproximadamente 5 x 10-7 M.
2. Método según la reivindicación 1, en el que el anticuerpo alterado se presenta en un fago o fagémido.
3. Método según la reivindicación 2, en el que se crea una biblioteca de anticuerpos alterados, mediante lo cual se preparan sustituciones en las regiones hipervariables en condiciones que mantienen un sesgo hacia la secuencia de la región hipervariable no humana.
4. Método según la reivindicación 3, que comprende introducir una tasa de mutación de aproximadamente el 10-50 por ciento en un ácido nucleico que codifica para cada posición de la región hipervariable que va a sustituirse.
5. Método según la reivindicación 4, en el que un codón que codifica para el aminoácido de la región hipervariable de tipo natural que va a someterse a mutación se contamina con una mezcla de otros nucleótidos.
6. Método según la reivindicación 5, en el que se usa una mezcla 70-10-10-10 de nucleótidos.
7. Método de selección de un anticuerpo alterado que comprende:
8. Método según la reivindicación 7, en el que los anticuerpos alterados se presentan en el fago o fagémido.
Patentes similares o relacionadas:
AGENTE INMUNOTERAPÉUTICO PARA CD37 Y COMBINACIÓN CON UN AGENTE QUIMIOTERAPÉUTICO BIFUNCIONAL DEL MISMO, del 21 de Noviembre de 2011, de Emergent Product Development Seattle, LLC: Una molécula de unión específica a CD37, que comprende una secuencia de aminoácidos como se muestra en el SEQ ID NO. 253
BLOQUEO DE LA MIGRACIÓN DE LEUCOCITOS Y DE LA INFLAMACIÓN POR INTERFERENCIA CON CD99/HEC2, del 17 de Noviembre de 2011, de CORNELL RESEARCH FOUNDATION, INC.: Un anticuerpo anti-CD99 que inhibe la migración transendotelial (MTE) de leucocitos mediada por CD99, para uso en un procedimiento para el tratamiento de una estado […]
ENSAYOS Y MÉTODOS USANDO BIOMARCADORES, del 21 de Septiembre de 2011, de GENENTECH, INC.: Un procedimiento para predecir la sensibilidad de una muestra de tejido o de células de mamífero a un anticuerpo agonista de DR4 o anticuerpo agonista de DR5, […]
FRAGMENTO DE ANTICUERPO CAPAZ DE MODULAR LA MULTIRRESISTENCIA Y COMPOSICIONES Y KITS Y MÉTODOS QUE UTILIZAN EL MISMO, del 2 de Septiembre de 2011, de TECHNION RESEARCH AND DEVELOPMENT FOUNDATION, LTD.: Un anticuerpo Fv monocatenario que comprende una región de fijación de antígeno capaz de fijar una porción extracelular de una glicoproteína P, en donde el anticuerpo […]
PREVENTIVO O REMEDIO PARA ENFERMEDADES INFLAMATORIAS DEL INTESTINO QUE CONTIENE ANTICUERPO ANTI-CD81 COMO PRINCIPIO ACTIVO, del 16 de Agosto de 2011, de DAINIPPON SUMITOMO PHARMA CO., LTD.: Uso de anticuerpo anti-CD81 para la preparación de una composición farmacéutica para prevenir, mejorar o tratar enfermedad inflamatoria del intestino (EII)
 UTILIZACIÓN DE UN ANTICUERPO ANTI-CD151 PARA EL TRATAMIENTO DEL CÁNCER, del 21 de Junio de 2011, de PIERRE FABRE MEDICAMENT: Uso de al menos un anticuerpo o uno de sus fragmentos funcionales, capaz de unirse a la proteína CD151 y de inhibir así el crecimiento tumoral para la preparación […]
UTILIZACIÓN DE UN ANTICUERPO ANTI-CD151 PARA EL TRATAMIENTO DEL CÁNCER, del 21 de Junio de 2011, de PIERRE FABRE MEDICAMENT: Uso de al menos un anticuerpo o uno de sus fragmentos funcionales, capaz de unirse a la proteína CD151 y de inhibir así el crecimiento tumoral para la preparación […]
 ANTICUERPOS CONTRA EL RECEPTOR DEL FACTOR I DE CRECIMIENTO SIMILAR A INSULINA Y USOS DE LOS MISMOS, del 6 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Anticuerpo ligante de IGF-1R humano, caracterizado porque comprende: a) una cadena pesada de anticuerpo que comprende como CDRs, la CDR1 de aminoácidos 31 a 35, la CDR2 de […]
ANTICUERPOS CONTRA EL RECEPTOR DEL FACTOR I DE CRECIMIENTO SIMILAR A INSULINA Y USOS DE LOS MISMOS, del 6 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Anticuerpo ligante de IGF-1R humano, caracterizado porque comprende: a) una cadena pesada de anticuerpo que comprende como CDRs, la CDR1 de aminoácidos 31 a 35, la CDR2 de […]
COMPOSICIONES FARMACÉUTICAS DE ANTICUERPOS PARA ENFERMEDADES CAUSADAS POR VIRUS, del 3 de Junio de 2011, de THERANOR SPRL: Una composición farmacéutica para usar en el tratamiento de una enfermedad causada por virus de la gripe en seres humanos, conteniendo dicha composición una […]