ANTICUERPOS HUMANIZADOS CONTRA ICAM-1, SU PRODUCCIÓN Y USOS.
Un anticuerpo humanizado que se une a ICAM-1, en el que dicho anticuerpo tiene un dominio VH y VL seleccionado de:
SEQ ID NO: 1 y 3 (HumA); SEQ ID NO: 4 y 5 (HumB); SEQ ID NO: 6 y 7 (HumC); SEQ ID NO: 8 y 9 (HumD); SEQ ID NO: 12 y 13 (HumF); SEQ ID NO: 16 y 17 (HumH); SEQ ID NO: 18 y 19 (Huml): y SEQ ID NO: 5 y 20 (Hum40)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/023002.
Solicitante: PERLAN THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 6310 NANCY RIDGE DRIVE, SUITE 102 SAN DIEGO, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FANG, FANG, LUO,Guang-Xiang, KOHLSTAEDT,Lori,Allison, CHARLES,Catherine,Helen.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Julio de 2002.
Clasificación Internacional de Patentes:
- C07K16/28A20
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P31/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Antivirales.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P31/12 A61P 31/00 […] › Antivirales.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356896_T3.pdf
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La invención se refiere a composiciones de anticuerpos humanizados y métodos para preparar y usar anticuerpos humanizados.
ANTECEDENTES DE LA INVENCIÓN 5
Los anticuerpos monoclónicos se han vuelto una clase importante de proteínas terapéuticas. Sin embargo, las inmunoglobulinas ajenas, usadas en seres humanos pueden producir una respuesta de anti-globulina que puede interferir con la terapia o causar una hipersensibilidad compleja alérgica o inmune. Para evitar este problema, el anticuerpo monoclónico puede ser "humanizado", y esto se realiza típicamente mediante el injerto de CDR.
Las CDR, también llamadas regiones hipervariables, están presentes en las cadenas ligeras y pesadas de 10 inmunoglobulina y están bordeadas por las regiones "marco". El injerto de CDR fue descrito por primera vez en Jones et al. ((1986) Nature 321:522-525). En ésta y en publicaciones posteriores, las CDR de tres anticuerpos de ratón fueron injertadas en el marco del dominio variable de la inmunoglobulina humana NEW (VH) y REI (VL). Los anticuerpos humanizados que resultaron tenían la misma especificidad de antígeno y una afinidad similar que el anticuerpo monoclónico murino parenteral (mAb) (Jones supra; Verhoeyen et al. (1988) Science 239:1534-1536; Riechmann et al. 15 (1988) Nature 332:323-327; patente de EE.UU. Nº. 5.225.539).
El injerto de CDR ha sido descrito por Queen y colaboradores que describieron la humanización de cuatro anticuerpos monoclónicos murinos (Queen et al. (1989) Proc. Natl. Acad. Sci. USA 86:10029-10033; Co et al. (1991) Proc. Natl. Acad. Sci. USA 88:2869-2873; Co et al. (1992) J. Immunol. 148:1149-1154; y patentes de EE.UU. Nº. 5-585.089; 5.693.761; y 5.693.762). Los residuos murinos fueron insertados en el marco humano a fin de mantener la afinidad y, en 20 cada caso fue mantenida la especificidad del antígeno original. Las afinidades de los anticuerpos humanizados están en el intervalo de 1/3 a 3 veces de los anticuerpos murinos no modificados parenterales.
COMPENDIO
La invención proporciona anticuerpos humanizados que se unen a ICAM-1, en el que el anticuerpo tiene un dominio VH y VL seleccionado de: SEQ ID NO:1 y 3 (HumA); SEQ ID NO:4 y 5 (HumB); SEQ ID NO:6 y 7 (HumC); SEQ ID NO:8 y 9 25 (HumD); SEQ ID NO:12 y 13 (HumF); SEQ ID NO:16 y 17 (HumH); y SEQ ID NO:18 y 19 (HumI); y SEQ ID NO:5 y 20 (Hum40). Se proporcionan subsecuencias de anticuerpos que se unen a ICAM-1, por ejemplo, fragmentos de cadena sencilla, Fab, Fab' y (Fab)2. El anticuerpo humanizado tiene mayor afinidad para ICAM-1 que el anticuerpo (no humano) parenteral. También son proporcionadas las formas variantes y modificadas de anticuerpos que se unen a ICAM-1, por ejemplo, anticuerpos que tienen un dominio VH y VL seleccionado de: SEQ ID NO:1 y 3 (HumA); SEQ ID NO:4 y 5 30 (HumB); SEQ ID NO:6 y 7 (HumC); SEQ ID NO:8 y 9 (HumD); SEQ ID NO:12 y 13 (HumF); SEQ ID NO:16 y 17 (HumH); y SEQ ID NO: 18 y 19 (HumI); y SEQ ID NO:5 y 20 (Hum40), teniendo una de cada diez sustituciones de aminoácidos conservadoras.
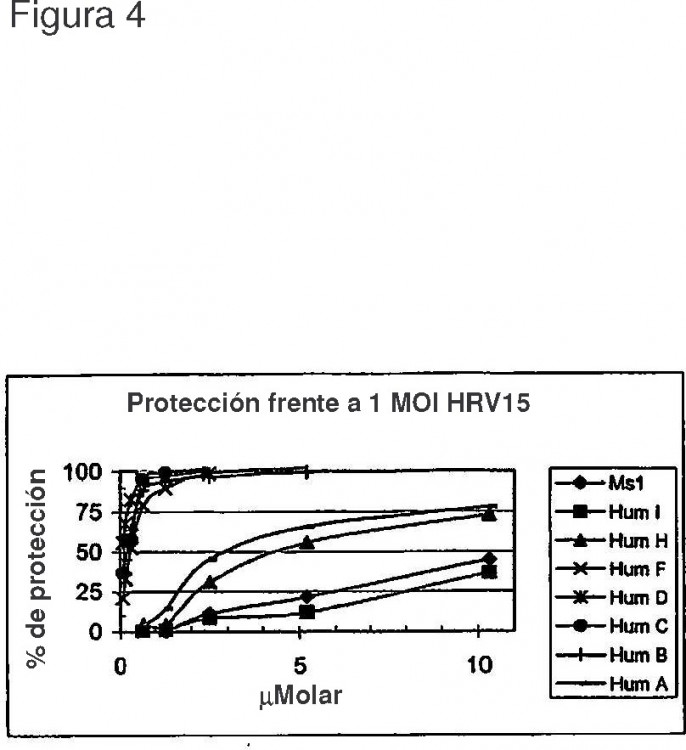
La invención también proporciona los anticuerpos humanizados como los que se definen más arriba que se unen a ICAM-1 e inhiben la infección patógena de células que expresan ICAM-1. Tales anticuerpos de la invención incluyen los 35 anticuerpos que proporcionan una protección igual o mayor de la infección patógena que el anticuerpo (no humano) parenteral. En aspectos particulares, un anticuerpo humanizado tiene una eficacia protectora igual o al menos 2 veces mayor, 5 veces mayor, 10 veces mayor, 20 veces mayor, 30 veces mayor que el anticuerpo no humanizado. Los patógenos son rinovirus humano (RVH), virus coxaclde A, virus respiratorio sincitial (VSR) o los patógenos que causan la malaria. 40
Los anticuerpos humanizados de la invención incluyen moléculas de inmunoglobulina intactas, que comprenden 2 cadenas pesadas de la cadena entera y 2 cadenas ligeras de la cadena entera, por ejemplo, IgG, IgA, IgM, IgE, e IgD, y subsecuencias que inhiben la infección por el patógeno. Las subsecuencias particulares incluyen, por ejemplo, un fragmento de cadena sencilla, Fab, Fab' o (Fab)2.
Los anticuerpos humanizados de la invención incluyen anticuerpos multiespecíficos o multifuncionales. En un aspecto, 45 tal anticuerpo se forma uniendo un anticuerpo humanizado a uno o varios anticuerpos idénticos o diferentes para formar un multímero (p.ej usando un conector). Los multímeros de anticuerpo incluyen un homo-o hetero-dímero, trímero, tetrámero o cualquier otro oligómero de orden más alto. Los multímeros de anticuerpos que incluyen diferentes anticuerpos son humanos, humanizados o no humanos. Las formas multiméricas incluyen oligómeros de anticuerpo que se forman a través de un dominio de multimerización (p.ej una secuencia de aminoácidos humana) o un enlace 50 covalente. Los multímeros de anticuerpo que incluyen un dominio de multimerización, incluyen además formas que localizan un conector entre el dominio de multimerización y el anticuerpo.
Además, se describen métodos para producir anticuerpos humanizados. Un método incluye: seleccionar una secuencia marco humana como aceptadora, en donde dicha secuencia tiene el 50 % o más identidad (p.ej, 50-55 %, 55-60 %, 60-65 %, 65-70 %, 70-75 %, 75-80 %, 80-85 %, 85-90 %, 90-95 %, o más identidad) respecto a una región marco del 55 anticuerpo donador no humano; injertar un CDR del anticuerpo no humano donador (p.ej, murino) en el marco humano;
comparar los residuos de la zona de vernier del aceptador humano y las regiones marco del donador no humanas; y mantener uno o más de los residuos del aceptador humano en la zona de vernier cuando los residuos del donador no humanos y humanos son estructuralmente o químicamente similares, o sustituir uno o varios de los residuos de zona de vernier con un residuo que es diferente tanto del residuo de la zona vernier no humano del donador como del residuo de la zona vernier humano del aceptador si el residuo de la zona vernier no humano del donador es estructuralmente o 5 químicamente distinto al residuo humano, en donde el residuo diferente es estructuralmente o químicamente similar al residuo de la zona vernier no humano del donador. Además, las secuencias marco del aceptador humano se seleccionan de una secuencia consenso, por ejemplo, las secuencias consenso del subgrupo I y subgrupo II del dominio VH.
También se proporcionan secuencias de ácidos nucleicos que codifican anticuerpos humanizados, subsecuencias y sus 10 formas modificadas (p.ej, adiciones de aminoácidos, eliminaciones o sustituciones). Las secuencias de ácidos nucleicos además incluyen casetes de expresión en los que el ácido nucleico que codifica anticuerpos humanizados está operativamente unido a un elemento del control de la expresión. También se proporcionan los vectores y las células (procariotas y eucariotas) que incluyen los ácidos nucleicos.
La invención proporciona además composiciones farmacéuticas que incluyen anticuerpos humanizados como se define 15 en las reivindicaciones, subsecuencias, multímeros, variantes y formas modificadas, y ácidos nucleicos que las codifican, y un vehículo farmacéuticamente aceptable. En aspectos particulares, el vehículo farmacéuticamente aceptable es compatible con la inhalación o administración nasal a un sujeto.
La invención se refiere además a métodos para inhibir la infección patógena de una célula. En una realización, un método incluye poner en contacto un patógeno o una célula con una cantidad de un anticuerpo humanizado, 20 subsecuencia, multímero, forma variante o modificada suficiente para inhibir la infección patógena de la célula. En un aspecto, la célula expresa ICAM-1. En otro aspecto, la célula (p.ej., la célula epitelial) está presente en un sujeto.
La invención también se refiere a métodos para inhibir la infección por RVH de una célula. En una realización, un método incluye el RVH que se pone en contacto, o una célula susceptible a la infección por RVH, con una cantidad de un anticuerpo humanizado, subsecuencia, multímero, forma variante o modificada eficaz para inhibir la infección por 25 RVH de la célula (p.ej., célula epitelial). En un aspecto, la célula está presente en un sujeto. En otro aspecto, la célula está presente en un sujeto que padece o está en peligro de padecer asma. En otro aspecto más, el sujeto es un recién nacido o entre los años de 1 a 5, de 5 a 10 o de 10 a 18. En todavía otro aspecto más, el anticuerpo, subsecuencia, multímero, la forma... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo humanizado que se une a ICAM-1, en el que dicho anticuerpo tiene un dominio VH y VL seleccionado de: SEQ ID NO: 1 y 3 (HumA); SEQ ID NO: 4 y 5 (HumB); SEQ ID NO: 6 y 7 (HumC); SEQ ID NO: 8 y 9 (HumD); SEQ ID NO: 12 y 13 (HumF); SEQ ID NO: 16 y 17 (HumH); SEQ ID NO: 18 y 19 (Huml): y SEQ ID NO: 5 y 20 (Hum40).
2. El anticuerpo humanizado de la reivindicación 1, en el que dicho anticuerpo es una subsecuencia de una molécula de 5 inmunoglobulina intacta, siendo capaz la subsecuencia de unirse a un epítopo de ICAM-1, y en el que dicha subsecuencia se selecciona del grupo que consiste en anticuerpos de cadena solos y fragmentos Fab, Fab' y (Fab)2.
3. Un anticuerpo humanizado, diferenciándose dicho anticuerpo del anticuerpo que se define en la reivindicación 1 en la cual tiene de 1 a 3, de 3 a 5 o de 5 a 10 sustituciones de aminoácidos, a condición de que dicho anticuerpo humanizado sea capaz de unirse a un epítopo de ICAM-1, y en el que dicho anticuerpo humanizado tiene mayor afinidad de unión 10 con el antígeno con relación al anticuerpo no humanizado parenteral, en el que dicho anticuerpo no humanizado parenteral es el anticuerpo 1A6 murino, y en el que dichas sustituciones son sustituciones conservadoras.
4. El anticuerpo humanizado de la reivindicación 3, teniendo dicho anticuerpo una eficacia protectora de al menos 2 veces mayor que el anticuerpo no humanizado.
5. El anticuerpo humanizado de la reivindicación 3, teniendo dicho anticuerpo una eficacia protectora al menos 5 veces 15 mayor que el anticuerpo no humanizado.
6. El anticuerpo humanizado de la reivindicación 3, teniendo dicho anticuerpo una eficacia protectora al menos 10 veces mayor que el anticuerpo no humanizado.
7. El anticuerpo humanizado de la reivindicación 3, teniendo dicho anticuerpo una eficacia protectora al menos 20 veces mayor que el anticuerpo no humanizado. 20
8. El anticuerpo humanizado de la reivindicación 3, teniendo dicho anticuerpo una eficacia protectora al menos 30 veces mayor que el anticuerpo no humanizado.
9. El anticuerpo humanizado de la reivindicación 3, en el que dicho anticuerpo no humanizado parenteral tiene las cadenas pesadas y ligeras de SEQ ID NOS: 77 y 79, respectivamente.
10. El anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 9, en el que el patógeno es rinovirus humano 25 (RVH).
11. El anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 9, en el que el patógeno es un virus coxsackie, virus respiratorio sincitial o causativo de la malaria.
12. El anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 11, en el que el anticuerpo es multiespecífico o multifuncional. 30
13. El anticuerpo humanizado de la reivindicación 1 o 10, en el que el anticuerpo es una molécula de inmunoglobulina intacta que comprende 2 polipéptidos de la cadena pesadas de la cadena entera y 2 polipéptidos de la cadena ligera de la cadena entera.
14. El anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 13, en el que el anticuerpo se une a otros anticuerpos idénticos o diferentes para formar un multímero. 35
15. El anticuerpo humanizado de la reivindicación 14, en el que el multímero comprende un homo- o hetero-dímero, trímero, tetrámero o pentámero.
16. El anticuerpo humanizado de la reivindicación 14 o 15, en el que el multímero está formado por medio de un dominio multimerización.
17. El anticuerpo humanizado de la reivindicación 16, en el que el dominio de multimerización comprende una secuencia 40 de aminoácidos humana.
18. El anticuerpo humanizado de la reivindicación 16 o 17, que comprende además un conector localizado entre el dominio de multimerización y el anticuerpo.
19. El anticuerpo humanizado de la reivindicación 14 o 15, en el que los anticuerpos diferentes son humanos, humanizados o no humanos.
20. Una secuencia de ácidos nucleicos que codifica un anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 5 19.
21. Un casete de expresión que comprende la secuencia de ácidos nucleicos de la reivindicación 20 operativamente unido a un elemento del control de la expresión.
22. Un vector que comprende la secuencia de ácidos nucleicos de la reivindicación 20.
23. El vector de la reivindicación 22, en el que la secuencia de ácidos nucleicos está operativamente unida a un 10 elemento del control de la expresión.
24. Una célula que comprende la secuencia de ácidos nucleicos de la reivindicación 20 o el casete de expresión de la reivindicación 21 o el vector de la reivindicación 22 o 23.
25. La célula de la reivindicación 24, en el que la célula es procariota o eucariota.
26. Una composición farmacéutica que comprende un anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 15 19, y un vehículo farmacéuticamente aceptable.
27. La composición farmacéutica de la reivindicación 26, en la que el vehículo es compatible con una inhalación o administración nasal a un sujeto.
28. Un método in vitro para inhibir la infección patógena de una célula que comprende poner en contacto un patógeno o una célula con una cantidad de un anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 19 suficiente para 20 inhibir la infección patógena de la célula.
29. Un método in vitro para inhibir la infección por RVH de una célula que comprende poner en contacto RVH o una célula susceptible a la infección por RVH con una cantidad de un anticuerpo humanizado de cualquiera de las reivindicaciones 10 o 12 a 19 eficaces para inhibir la infección por RVH de la célula.
30. El uso del anticuerpo humanizado de cualquiera de las reivindicaciones 1 a 19 para la preparación de una 25 composición farmacéutica para la inhibición de una infección patógena.
31. El uso del anticuerpo humanizado de cualquiera de las reivindicaciones 10 o de 12 a 19 de la preparación de una composición farmacéutica para la inhibición de una infección por RVH, para la inhibición de la progresión del RVH o para el tratamiento de una infección por RVH.
32. El método de la reivindicación 28 o 29 o el uso de la reivindicación 30 o 31, en el que el anticuerpo se une a un 30 antígeno presente en la superficie de la célula.
33. El método de la reivindicación 28, 29 o 32 o el uso de la reivindicación 30, 31 o 32, en el que la célula expresa ICAM-1.
34. El método de cualquiera de las reivindicaciones 28, 29, 32 o 33 o el uso de cualquiera de las reivindicaciones 30 a 33, en el que la célula es una célula epitelial. 35
35. El uso del anticuerpo humanizado de cualquiera de las reivindicaciones 10 o de 12 a 19 de la preparación de una composición farmacéutica para la inhibición de uno o varios síntomas del resfriado común.
36. El uso de cualquiera de las reivindicaciones 30 a 35, en el que el anticuerpo humanizado debe ser administrado localmente.
37. El uso de cualquiera de las reivindicaciones 30 a 36, en el que el anticuerpo humanizado debe ser administrado por medio de inhalación o intranasalmente.
38. El uso de cualquiera de las reivindicaciones 30 a 37, en el que la composición farmacéutica debe ser administrada a un sujeto que padece o está en peligro de padecer asma.
39. El uso de cualquiera de las reivindicaciones 30 a 38, en el que la composición farmacéutica debe ser administrada a 5 un sujeto que es un recién nacido o tiene de 1 a 5, de 5 a 10 o de 10 a 18 años.
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Anticuerpo de PDL-1, composición farmacéutica del mismo y sus usos, del 13 de Mayo de 2020, de Sichuan Kelun-Biotech Biopharmaceutical Co., Ltd: Un anticuerpo monoclonal anti-PDL-1 o un fragmento de unión a antígeno del mismo, en donde, dicho anticuerpo monoclonal anti-PDL-1 tiene […]
Anticuerpos anti-CD40, del 29 de Abril de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un anticuerpo anti-CD40 humanizado que tiene una cadena pesada variable y una cadena ligera variable que comprende las secuencias de aminoácidos de SEQ ID NO: 53 y SEQ ID NO: […]
Polipéptidos biespecíficos de unión a antígeno, del 29 de Abril de 2020, de X-Body, Inc: Un polipéptido biespecífico de unión a antígeno aislado desprovisto de cadenas ligeras de anticuerpo que comprende una cadena pesada de anticuerpo […]
Anticuerpos anti-ricina y sus usos, del 8 de Abril de 2020, de HER MAJESTY THE QUEEN IN RIGHT OF CANADA AS REPRESENTED BY THE MINISTER OF NATIONAL DEFENCE: Un anticuerpo, aislado o purificado, o fragmento de este, que comprende una cadena ligera variable que comprende una CDR L1 de secuencia KASQDINNYLR […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Composiciones para inhibir la activación del complemento dependiente de MASP-2, del 11 de Marzo de 2020, de OMEROS CORPORATION: Un anticuerpo monoclonal humano aislado, o fragmento de unión a antígeno del mismo, que se une a MASP-2 humana e inhibe la activación del complemento dependiente de MASP-2, […]
Anticuerpos anti-MIF para su uso en el tratamiento de enfermedades inflamatorias, del 19 de Febrero de 2020, de Baxalta Incorporated: Anticuerpo monoclonal o parte de unión a antígeno del mismo que se une específicamente a la región que abarca los aa 50-68 o la región que abarca los aa 86-102 de MIF humano, […]