ANTICUERPO MONOCLONAL HUMANO ESPECIFICO PARA LIPOPOLISACARIDOS (LPS) DE SEROTIPO IATS 011 DE PSEUDOMONAS AERUGINOSA.
Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P.
aeruginosa que comprende una cadena ligera y una cadena pesada en donde la región variable de la cadena ligera tiene la secuencia de aminoácidos de SEQ ID NO:7 y la región variable de la cadena pesada tiene la secuencia de aminoácidos de SEQ ID NO:8, o una muteína de dicho anticuerpo capaz de unirse a dicho LPS, en donde la secuencia de aminoácidos de la región variable de la cadena ligera del anticuerpo es al menos el 95% homóloga a SEQ ID NO:7 y la secuencia de aminoácidos de la región variable de la cadena pesada del anticuerpo es al menos el 95% homóloga a SEQ ID NO:8
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/001289.
Solicitante: KENTA BIOTECH AG.
Nacionalidad solicitante: Suiza.
Dirección: REHHAGSTRASSE 79 3018 BERN SUIZA.
Inventor/es: LANG, ALOIS B., DR., HORN,MICHAEL P.,DR, IMBODEN,MARTIN A.,DR, ZUERCHER,ADRIAN.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Febrero de 2006.
Fecha Concesión Europea: 8 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07K16/12A14
- C07K7/06A
- C07K7/08A
Clasificación PCT:
- A61K31/7088 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que tienen al menos tres nucleósidos o nucleótidos.
- A61K39/40 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › bacterianos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07K16/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales bacterianos.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
- C12N15/79 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a huéspedes eucariotas.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
- G01N33/577 G01N 33/00 […] › en los que interviene anticuerpos monoclonados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
La presente invención se refiere a un anticuerpo monoclonal 5 humano específico para el serotipo IATS O11 de P. aeruginosa, un hibridoma que lo produce, ácidos nucleicos que lo codifican y células huésped transfectadas con los mismos. Además, la presente invención se refiere a métodos para producir dicho anticuerpo monoclonal. Además, la presente invención se refiere 10 a composiciones farmacéuticas que comprenden al menos un anticuerpo o al menos un ácido nucleico que codifica dicho anticuerpo.
P. aeruginosa es una bacteria medioambiental ubicua Gram negativa que se encuentra en el agua dulce y la tierra. Es un 15 patógeno oportunista clásico que normalmente no representa una amenaza al huésped inmunocompetente, que lo elimina por medio de anticuerpos opsonizantes y fagocitosis. Sin embargo, los pacientes de fibrosis quística e individuos inmunodeprimidos – incluyendo víctimas de quemaduras, pacientes entubados en las 20 UCI, pacientes de cáncer y SIDA, así como pacientes sometidos a trasplante de órganos- tienen particularmente alto riesgo de contraer infecciones nocosomiales. Junto con S. aureus resistente a meticilina (SARM) y enterococos resistentes a vancomicina (ERV), P. aeruginosa es responsable de hasta el 34% 25 de todas las infecciones nocosomiales que han aumentado desde 7,2/1000 pacientes día en 1975 hasta 9,8/1000 pacientes día en 1995. Entre las formas de infección nocosomial observadas con mayor frecuencia están la bacteriemia y la neumonía.
Para la prevención de infecciones crónicas por P. 30 aeruginosa en pacientes de fibrosis quística, se ha establecido una vacuna octavalente conjugada que consiste en los 8 serotipos de LPS más relevantes de P. aeruginosa acoplados a toxina A detoxificada de P. aeruginosa para la inmunización activa. Los estudios a largo plazo con esta vacuna han mostrado que la 35 proporción de pacientes infectados de forma crónica cayó desde
alrededor del 72% hasta el 32% a la edad de 18 años. Sin embargo, la vacunación activa solo es posible en pacientes inmunocompetentes, así como en situaciones previsibles. De esta manera, la mayoría de las víctimas de P. aeruginosa no se pueden inmunizar activamente con la vacuna octavalente. Debido a esto y 5 debido al hecho de que la mayoría de las cepas de P. aeruginosa son multirresistentes, existe una necesidad para una herramienta terapéutica alternativa para tratar a los pacientes infectados con P. aeruginosa. Un intento es crear anticuerpos monoclonales humanos basados en la tecnología clásica de hibridomas o usando 10 clonación de repertorio por presentación en fagos.
Ambos métodos y los anticuerpos creados mediante los mismos muestran serios inconvenientes.
La tecnología clásica del hibridoma (el planteamiento de “Kohler y Milstein”) se basa en la inducción de células B 15 murinas de la especificidad deseada mediante inmunización activa con un antígeno de elección e inmortalización mediante fusión con un compañero de mieloma. Después de ello, la información genética de un clon productor de anticuerpo necesita humanizarse mediante ingeniería genética y producir el anticuerpo en un 20 sistema de expresión adecuado. Asimismo, la clonación de un repertorio de presentación en fago requiere una manipulación genética sofisticada del anticuerpo y el establecimiento de un sistema de expresión adecuado.
Se sabe que los anticuerpos monoclonales murinos dirigidos 25 contra LPS bacteriano reconocen epítopos diferentes que los anticuerpo humanos. Por lo tanto, la generación de anticuerpos monoclonales en ratones seguida por humanización no produciría necesariamente el aislamiento de anticuerpos con la especificidad de interés para su uso en seres humanos. 30
Además, los anticuerpos de isotipo IgM son los más eficaces debido a los mecanismos efectores ligados a IgM que son óptimos para la inmunidad antibacteriana. Sin embargo, hasta la fecha no se ha alcanzado la expresión recombinante de anticuerpos IgM debido a la forma pentamérica compleja de esta molécula. Por 35 consiguiente, la expresión de anticuerpos aislados mediante la
tecnología de presentación en fago está limitada a isotipos diferentes de IgM.
De forma alternativa, han existido diferentes intentos de generar anticuerpos monoclonales humanos contra grupos de LPS de P. aeruginosa. Sin embargo, bien los métodos usados para 5 producir dichos anticuerpos tenían desventajas (debido a la inestabilidad de las células linfoblastoides) o bien los anticuerpos mostraron un patrón de glicosilación no humano o se requerían cantidades muy grandes del anticuerpo. Además, muchos de los anticuerpos descritos en la técnica anterior carecen de 10 funciones efectoras y por tanto no eran protectores.
Según esto, un problema técnico subyacente a la presente invención es proporcionar un anticuerpo monoclonal humano específico para LPS de un serotipo particular de P. aeruginosa en donde el anticuerpo muestra gran capacidad de protección, en 15 particular in vivo.
El problema técnico se resuelve mediante los anticuerpos monoclonales humanos como se definen a continuación.
Según la presente divulgación, se proporciona un anticuerpo monoclonal humano denominado 1BO11, específico para LPS del 20 serotipo IATS O11 de P. aeruginosa en donde la región variable de la cadena ligera del anticuerpo comprende al menos una de SEQ ID NO:1 en la región CDR1, SEQ ID NO:2 en la región CDR2 y SEQ ID NO:3 en la región CDR3, y en donde la región variable de la cadena pesada del anticuerpo comprende al menos una de SEQ ID 25 NO:4 en la región CDR1, SEQ ID NO:5 en la región CDR2 y SEQ ID NO:6 en la región CDR3; o un fragmento o derivado del mismo capaz de unirse a dicho LPS.
La presente invención proporciona además un hibridoma capaz de producir el anticuerpo monoclonal y los ácidos nucleicos que 30 codifican la cadena ligera y pesada del anticuerpo, respectivamente. Además, la presente invención proporciona vectores y células huésped, que comprenden el ácido nucleico. Además, se proporcionan métodos para producir los anticuerpos monoclonales. Además, se proporcionan composiciones 35
farmacéuticas que comprenden al menos un anticuerpo y/o al menos un ácido nucleico, y segundos usos médicos de las mismas.
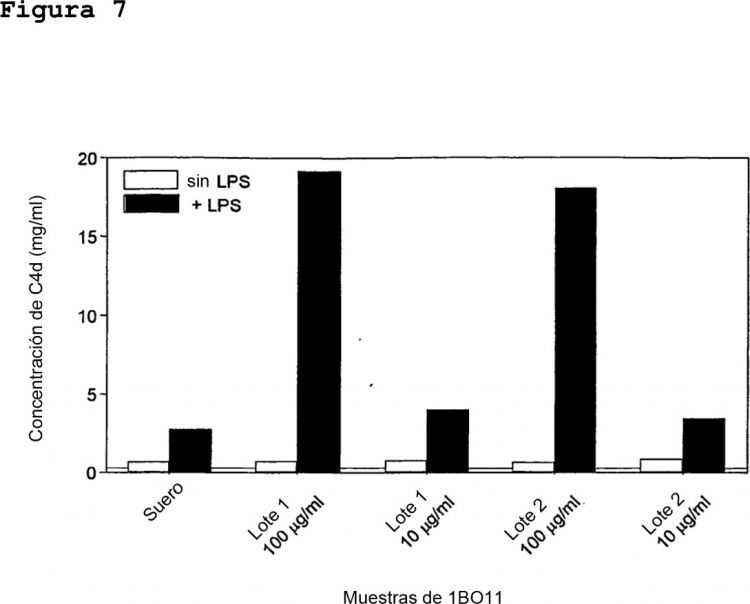
Sorprendentemente, se ha determinado que los anticuerpos monoclonales humanos según la invención muestran gran capacidad de protección. En particular, se demostró que el anticuerpo 5 monoclonal humano era opsonofagocítico in vitro. Incluso más importante, los anticuerpos monoclonales según la presente invención muestran capacidad de protección in vivo determinada por la protección a bacteriemia en el modelo murino de quemaduras así como protección de infección en el aparato 10 respiratorio en un modelo de infección pulmonar aguda en ratones como se muestra en los ejemplos.
Con los anticuerpos monoclonales humanos según la invención, se alcanza la opsonofagocitosis a dosis mucho más bajas así como una mayor protección comparada con los 15 anticuerpos monoclonales humanos descritos por Collins y col. (Collins MS et al., 1990. FEMSIM 64:263-268).
En contraste con los anticuerpos monoclonales descritos en el estado de la técnica (Harrison FJJ et al. 1997. Hybridoma 16(5):413-420; Zweerink HJ et al. 1988. Infection and Immunity 20 56(8):1873-1879), los anticuerpos monoclonales humanos según la invención se generan además a partir de sangre de individuos sanos activamente inmunizados con una vacuna conjugada. En general se sabe que los anticuerpos contra polisacáridos son de menor calidad (es decir, baja afinidad con poco potencial 25 efector) debido a la falta de ayuda de células T. Sólo mediante el uso de una vacuna conjugada se pueden generar anticuerpos valiosos que tengan gran afinidad con gran potencial efector contra dianas polisacáridos. Además, la tasa de producción de anticuerpos monoclonales humanos según la invención es mayor 30 comparada con la tasa de producción de anticuerpos monoclonales descritos en el estado de la técnica (Zweerink HJ et al. 1988. Infection and Immunity 56(8):1873-1879).
En el estado de la técnica no se ha descrito ningún anticuerpo monoclonal humano que muestre protección para 35 infección pulmonar producida por P. aeruginosa.
Según la presente invención el anticuerpo es específico para el LPS del serotipo IATS O11 de P. aeruginosa y muestra actividad opsonofagocítica a concentraciones tan bajas como 0,1 ng/ml determinadas usando bacterias...
Reivindicaciones:
1. Anticuerpo monoclonal humano específico para el lipopolisacárido (LPS) del serotipo IATS 011 de P. aeruginosa que comprende una cadena ligera y una cadena 5 pesada en donde la región variable de la cadena ligera tiene la secuencia de aminoácidos de SEQ ID NO:7 y la región variable de la cadena pesada tiene la secuencia de aminoácidos de SEQ ID NO:8, o una muteína de dicho anticuerpo capaz de unirse a dicho LPS, en donde la 10 secuencia de aminoácidos de la región variable de la cadena ligera del anticuerpo es al menos el 95% homóloga a SEQ ID NO:7 y la secuencia de aminoácidos de la región variable de la cadena pesada del anticuerpo es al menos el 95% homóloga a SEQ ID NO:8. 15
2. Anticuerpo monoclonal humano de la reivindicación 1 en donde la cadena ligera es de tipo kappa.
3. Anticuerpo monoclonal humano de la reivindicación 1 en donde 20 la cadena ligera es de tipo lambda.
4. Anticuerpo monoclonal humano de las reivindicaciones 1 a 3 en donde la cadena pesada es del tipo IgM, IgA o IgG.
25
5. Anticuerpo monoclonal humano de la reivindicación 4 en donde la cadena pesada es del tipo IgM.
6. Anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 4 en donde el anticuerpo consiste 30 completamente en secuencia de aminoácidos humana.
7. Anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 6 en donde el anticuerpo muestra reconocimiento antigénico humano. 35
8. Anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 7 en donde el anticuerpo está modificado en el N-terminal, internamente y/o en el C-terminal, en donde la modificación se selecciona de al menos una de oligo, di- o polimerización, modificaciones de las 5 cadenas laterales, modificaciones postraduccionales y conjugación a un fármaco y/o un marcador.
9. Anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 7 obtenible de una célula B humana o un 10 hibridoma obtenido mediante fusión de dicha célula B humana con una célula de mieloma o heteromieloma.
10. Hibridoma capaz de producir el anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 7 ó 9. 15
11. Ácido nucleico que codifica la cadena ligera del anticuerpo monoclonal humano y la cadena pesada del anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 7 ó 9. 20
12. Vector que comprende el ácido nucleico que codifica la cadena ligera y la cadena pesada de la reivindicación 11.
13. Vector según la reivindicación 12, en donde el vector 25 también comprende un promotor operativamente unido al ácido nucleico para facilitar la expresión del mismo.
14. Célula huésped que comprende el vector de la reivindicación 12 y/o el ácido nucleico de la reivindicación 11. 30
15. Un método para producir el anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 7 ó 9 que comprende cultivar el hibridoma de la reivindicación 10 bajo condiciones que permiten la secreción de un anticuerpo o 35 cultivar la célula huésped de la reivindicación 14 en
condiciones adecuadas para la expresión del anticuerpo monoclonal humano y, opcionalmente, purificar el anticuerpo del sobrenadante del cultivo.
16. Composición farmacéutica que comprende al menos un 5 anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 9 y/o al menos un ácido nucleico de la reivindicación 11 y, opcionalmente, ingredientes farmacéuticamente aceptables.
10
17. Anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 9 y/o el ácido nucleico de la reivindicación 11 para uso en la profilaxis y/o tratamiento de una infección de P. aeruginosa en un paciente humano.
15
18. Uso del anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 9 y/o del ácido nucleico de la reivindicación 11 para la preparación de un medicamento para la profilaxis y/o tratamiento de una infección por P. aeruginosa en un paciente humano. 20
19. Anticuerpo monoclonal humano y/o el ácido nucleico para el uso según la reivindicación 17 o el uso según la reivindicación 18 en donde la infección por P. aeruginosa es una infección intrahospitalaria. 25
20. Kit de prueba para el diagnóstico de una infección por P. aeruginosa en una muestra que comprende al menos un anticuerpo monoclonal humano de cualquiera de las reivindicaciones 1 a 9 y/o al menos un ácido nucleico de la 30 reivindicación 11, y opcionalmente, ingredientes adecuados adicionales para llevar a cabo la prueba de diagnóstico.
Patentes similares o relacionadas:
OLIGOPÉPTIDOS NO PROTEOLIZABLES INHIBIDORES DE LA GLICOPROTEINA GP41 DEL VIH, del 21 de Octubre de 2011, de UNIVERSIDAD DEL PAIS VASCO UNIVERSIDAD DE VALENCIA: Oligopéptidos no proteolizables inhibidores de la glicoproteína 41 del virus del SIDA. La presente invención se refiere a la identificación de oligopéptidos, […]
PÉPTIDOS ESPECÍFICOS PARA LAS METÁSTASIS Y SUS APLICACIONES EN DIAGNÓSTICO Y TERAPÉUTICAS, del 19 de Julio de 2011, de UNIVERSITA' DEGLI STUDI DI TORINO: Un péptido capaz de fijarse selectivamente a células metastásicas, preferiblemente células de metástasis hepáticas humanas, que tiene el motivo de secuencia LRS, una longitud […]
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
COMPOSICIÓN COSMÉTICA O FARMACÉUTICA QUE CONTIENE PÉPTIDOS CON LA SECUENCIA ARG-GLY-SER, del 3 de Junio de 2011, de SOCIETE D'EXTRACTION DES PRINCIPES ACTIFS ( VINCIENCE SA): Composición cosmética y/o dermatológica y/o farmacéutica caracterizada porque contiene en un medio aceptable, como principio activo, por lo menos un péptido de fórmula […]
LIGACIÓN QUÍMICA "SEUDO"- NATURAL, del 1 de Junio de 2011, de AMYLIN PHARMACEUTICALS, INC.: Procedimiento para sintetizar un polipéptido deseado de fórmula: aaNH2-Q-aax-aay-W-aaCOOH en la que Q y W indican cada uno la presencia opcional de uno o más restos […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]
POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]