ANTICUERPO MONOCLONAL HUMANO CONTRA LA MOLECULA AILIM COESTIMULADORA Y TRANSDUCTORA DE SEÑALES Y USO FARMACEUTICO DEL MISMO.
Un anticuerpo monoclonal humano que se une a AILIM humana, en el que una región variable de cadena pesada de dicho anticuerpo monoclonal humano posee una secuencia de aminoácidos de los siguientes puntos (a) o (b):
(c) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 117 de la SEQ ID NO: 28, o (d) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 117 de la SEQ ID NO: 28, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos, siempre que, cuando la región variable de cadena pesada posee la secuencia de aminoácidos del punto anterior (b) dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii): (iv) una actividad para impedir la reacción linfocitaria mixta; (v) una actividad para inducir la transducción de señales para inducir interferón-γ ;o (vi) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a células que expresan AILIM
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E01111930.
Solicitante: JAPAN TOBACCO INC..
Nacionalidad solicitante: Japón.
Dirección: 2-1, TORANOMON 2-CHOME, MINATO-KU,TOKYO 105-8422.
Inventor/es: TAKASHI,TSUJI, KATSUNARI,TEZUKA,PHARMACEUTICAL FRONTIER RES.LAB, NOBUAKI,HORI.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Mayo de 2001.
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/11 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
- C12N5/20 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › siendo uno de los integrantes de la fusión un linfocito B.
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
- C12N5/20 C12N 5/00 […] › siendo uno de los integrantes de la fusión un linfocito B.
- G01N33/543 G01N 33/00 […] › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
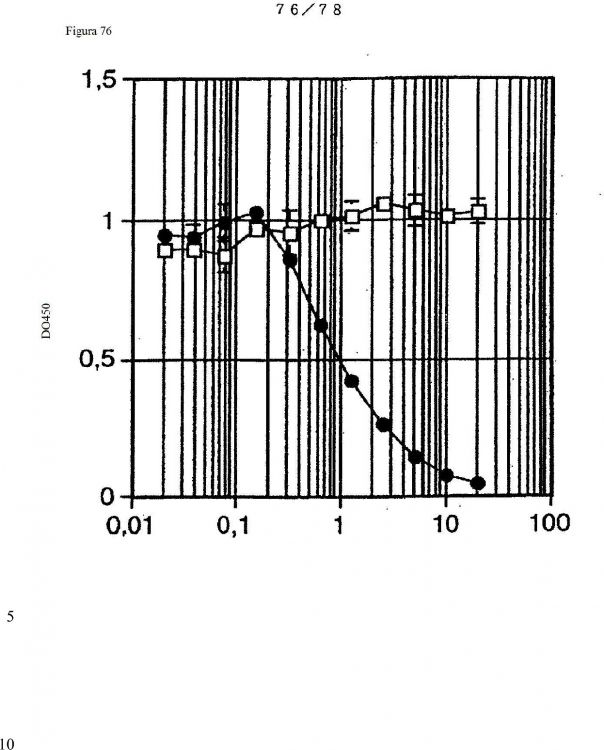
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a anticuerpos humanos que se unen a AILIM (molécula inmunomoduladora de linfocitos inducible por activación, también denominada ICOS (coestimulador inducible); a anticuerpos monoclonales humanos que se unen a AILIM o a una porción de la misma; a ADN que codifica dicho anticuerpo monoclonal humano o a una porción del mismo, o a una porción de dicho ADN; a células (incluyendo células recombinantes genéticas) que producen dicho anticuerpo monoclonal humano o una porción del mismo; a un anticuerpo monoclonal humano o una porción del mismo producido por dichas células recombinantes genéticas; a una composición farmacéutica que comprende dicho anticuerpo monoclonal humano o una porción del mismo; a una composición farmacéutica que comprende el anticuerpo contra AILIM para tratar trastornos relacionados con la alergia retardada; a un método para identificar, cuantificar o ensayar sustancias que se unen a AILIM o al ligando de AILIM; y a un kit utilizado para dicho método.
ANTECEDENTES DE LA INVENCIÓN
Un organismo vivo de mamíferos posee sistemas de respuesta inmunitaria que excluye a microorganismos patógenos (virus, bacterias, parásitos, etc.) o a cuerpos extraños (denominados ambos "antígeno" en lo sucesivo) que han invadido el organismo vivo. Uno de ellos se denomina sistema de respuesta inmune natural; el otro, sistema de respuesta inmune adquirida. El primero es un mecanismo de exclusión que comprende fagocitosis por parte de fagocitos (leucocitos polimorfonucleares, monocitos, macrófagos, etc.), ataque por parte de células citolíticas naturales (NK), y reconocimiento no específico tal como opsonización del antígeno por complementos. El segundo, el sistema de respuesta inmune adquirida, es un mecanismo de exclusión mediante linfocitos (principalmente células T y células B) que adquirieron la especificidad por el antígeno (a saber, linfocitos activados). Las células B que adquirieron la especificidad por el antígeno atacan al antígeno que existe fuera de las células a través de la producción de anticuerpos específicos contra el antígeno. Las células T que adquirieron la especificidad por el antígeno (a saber, células T activadas) se clasifican en células T ayudantes y células T citotóxicas (linfocitos citotóxicos, CTL). Las células T ayudantes regulan la diferenciación de las células B y la producción de anticuerpos, y destruyen el antígeno cooperando con los fagocitos. Las últimas, los CTLs, atacan las células infectadas con virus, etc., por sí mismas. (Experimental Medicine: SUPPLEMENT, "Bio Science Term Library, Immunity", Yodosha, páginas14-17 (1995)).
Esta adquisición de especificidad por el antígeno por parte de las células T (a saber, la activación de células T) se inicia a través del reconocimiento por parte de las células T del antígeno presentado por las células presentadoras de antígenos (APC), tales como macrófagos, células B o células dendríticas. Las células presentadoras de antígenos procesan los antígenos así incorporados y presentan estos antígenos procesados uniéndolos al complejo mayor de histocompatibilidad (MHC). Las células T reciben la señal primaria para la activación de las células (o adquisición de especificidad) reconociendo los antígenos procesados presentados por las células presentadoras de antígenos a través de un complejo entre el receptor de las células T (TcR) y el antígeno CD3 que existe sobre la superficie de la membrana celular (complejo TcR/CD3).
Sin embargo, la sola señal primaria mediada por el complejo TcR/CD3 no puede activar las células T suficientemente y lleva a una ausencia de reacción o anergia clonal, de manera que las células no pueden reaccionar con cualquier estímulo recibido a partir de ese momento. La liberación autocrina de interleuquina 2 (IL-2) es necesaria para que las células T se activen, se diferencien en clones de células T específicas del antígeno y proliferen. En la anergia clonal, las células T se inactivan debido a la falta de producción de IL-2 y a la falta de división celular. A saber, la activación de células T acompañada por la producción de citoquinas tales como IL-2 requiere la señal secundaria después de la primera señal a través del complejo TcR/CD3. Esta señal secundaria se denomina señal coestimuladora.
Las células T reciben esta señal secundaria y la transmiten a las células interactuando (adhesión celular) con moléculas distintas de MHC sobre las células presentadoras de antígenos a través de moléculas distintas del complejo TcR/CD3 sobre la superficie de células T. Esta señal secundaria evita la anergia celular (anergia clonal) y activa las células.
Aunque alguna parte del mecanismo de la transmisión de la señal secundaria entre células presentadoras de antígenos y linfocitos tales como las células T aún no ha sido aclarada en detalle, los estudios hasta el momento han revelado que un importante factor para la transmisión de la señal secundaria es la interacción de CD28 (también denominada Tp44, T44 o antígeno 9.3), que es una molécula de la superficie celular expresada principalmente sobre células T y células del timo, con CD80 (también denominada B7-1, B7, BB1 o B7/BB1), que es una molécula de la superficie celular expresada sobre células presentadoras de antígenos (macrófagos, monocitos, células dendríticas, etc.) y con CD86 (también denominada B7-2 o B70), que es también una molécula de la superficie celular sobre células presentadoras de antígenos (a saber, adhesión celular a través de la unión entre estas moléculas). Además, se ha aclarado experimentalmente que la interacción del antígeno-4 asociado a linfocitos T citolíticos (CTLA-4), cuya expresión se considera potenciada dependiendo de la señal secundaria, con CD80 (B7-1) y CD86 (B7-2) (a saber, adhesión celular a través de la unión entre estas moléculas) también desempeña un papel importante en la regulación de la activación de células T mediante la señal secundaria. En otras palabras, la regulación de la activación de células T mediante la transmisión de la señal secundaria implica al menos la interacción entre CD28 y CD80/CD86, el aumento de la expresión de CTLA-4, que se considera depende de la interacción, y la interacción entre CTLA-4 y CD80/CD86.
Se sabe que CD28 es una molécula coestimuladora que transmite la señal secundaria (señal coestimuladora) requerida para la activación de células T y para la prevención de la anergia. La señal secundaria transmitida uniendo esta molécula a moléculas coestimuladoras, CD80 (B7-1) y CD86 (B7-2), sobre las células presentadoras de antígenos (adhesión celular a través de la unión entre estas moléculas), estabiliza el ARNm de las citoquinas de tipo Th1 y en consecuencia promueve la producción por parte de las células T de una gran cantidad de citoquinas de tipo Th1 tales como 1L-2, IFNº y TNFº. La expresión de CTLA-4 es inducida por la señal primaria transmitida a través de TcR/CD3, y la expresión también es potenciada por la señal secundaria transmitida por la unión entre CD28 y CD80. Se está revelando que CTLA-4 recibe estas señales para funcionar inhibiendo la función de las células T, que es contraria a la activación de células T mediante la señal secundaria transmitida por CD28.
CD28 y CTLA-4 humanas son glicoproteínas de tipo I cuyos pesos moleculares son 44 kD y 41 a 43 kD, respectivamente. Ambas poseen un dominio similar a la inmunoglobulina, pertenecen a la superfamilia de las inmunoglobulinas, y funcionan ambas como molécula de adhesión celular y como molécula de transmisión de señales.
CD28 humana forma un homodímero con un enlace disulfuro mientras que CTLA-4 existe como monómero. Ambos genes CD28 y CTLA-4 están ubicados en "2q33" en el cromosoma humano y "1C" en el cromosoma de ratón, y están compuestos por cuatro (4) exones. CD28 y CTLA-4 humanas están constituidas por 220 y 223 aminoácidos, respectivamente, incluyendo las secuencias líderes, y la homología de aminoácidos entre ellas es 20 a 30%.
Los ligandos para CD28 y CTLA-4 son CD80 (B7-1) y CD86 (B7-2) en el ser humano y el ratón. CTLA-4 posee una afinidad para ambos ligandos aproximadamente 20 veces más alta que CD28. Se ha aclarado que la estructura de la secuencia de aminoácidos "MYPPPY (Met-Tyr-Pro-Pro-Pro-Tyr)" conservada a través de las especies animales es importante para la unión de CD28 y CTLA-4 a CD80 (B7-1). También se ha informado que, cuando CD28 es estimulada, la quinasa...
Reivindicaciones:
1. Un anticuerpo monoclonal humano que se une a AILIM humana, en el que una región variable de cadena pesada de dicho anticuerpo monoclonal humano posee una secuencia de aminoácidos de los siguientes puntos (a) o (b):
(c) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 117 de la SEQ ID NO: 28, o
(d) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 117 de la SEQ ID NO: 28, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando la región variable de cadena pesada posee la secuencia de aminoácidos del punto anterior (b) dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(iv) una actividad para impedir la reacción linfocitaria mixta;
(v) una actividad para inducir la transducción de señales para inducir interferón-º;o
(vi) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a células que expresan AILIM.
2. Un anticuerpo monoclonal humano que se une a AILIM humana, en el que un polipéptido de cadena pesada de dicho anticuerpo monoclonal humano posee una secuencia de aminoácidos de los siguientes puntos (a) o (b):
(c) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 470 de la SEQ ID NO: 28, o
(d) secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 470 de la SEQ ID NO: 28, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando el polipéptido de cadena pesada posee la secuencia de aminoácidos del punto anterior (b) dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(i) una actividad para impedir la reacción linfocitaria mixta;
(ii) una actividad para inducir la transducción de señales para inducir interferónº;o
(iii) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a células que expresan AILIM.
3. Un anticuerpo monoclonal humano que se une a AILIM humana, en el que una región variable de cadena liviana de dicho anticuerpo monoclonal humano posee una secuencia de aminoácidos de los siguientes puntos (a) o (b):
(c) secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 116 de la SEQ ID NO: 30, o
(d) secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 116 de la SEQ ID NO: 30, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando la región variable de cadena liviana posee la secuencia de aminoácidos del punto anterior (b), dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(i) una actividad para impedir la reacción linfocitaria mixta;
(ii) una actividad para inducir la transducción de señales para inducir interferón-º;o
(iii) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a las células que expresan AILIM.
4. Un anticuerpo monoclonal humano que se une a AILIM humana, en el que un polipéptido de cadena liviana de dicho anticuerpo monoclonal humano posee una secuencia de aminoácidos de los siguientes puntos (a) o (b):
(c) secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 236 de la SEQ ID NO: 30, o
(d) secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 236 de la SEQ ID NO: 30, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando el polipéptido de cadena liviana posee la secuencia de aminoácidos del punto anterior (b), dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(i) una actividad para impedir la reacción linfocitaria mixta;
(ii) una actividad para inducir la transducción de señales para inducir interferón-º;o
(iii) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a las células que expresan AILIM.
5. Un anticuerpo monoclonal humano que se une a AILIM humana y
comprende las siguientes características (a) y (b):
(a) una región variable de cadena pesada del anticuerpo comprende uno de los siguientes puntos (I) o (II):
(I) una secuencia de aminoácidos que comprende la secuencia de aminoácidos desde el aminoácido 20 hasta el aminoácido 117 de la SEQ ID NO: 28; o
(II) una secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 117 de la SEQ ID NO: 28, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos; y
(b) una región variable de cadena liviana del anticuerpo comprende uno cualquiera de los siguientes puntos (I) o (II):
(I) una secuencia de aminoácidos que comprende la secuencia de aminoácidos desde el aminoácido 23 hasta el aminoácido 116 de la SEQ ID NO: 30; o
(II) una secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 116 de la SEQ ID NO: 30, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando la región variable de cadena pesada es la del punto anterior (II) de (a) o la región variable de cadena liviana es la del punto anterior (II) de (b), dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(i) una actividad para impedir la reacción linfocitaria mixta;
(ii) una actividad para inducir la transducción de señales para inducir interferón-º;o
(iii) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a las células que expresan AILIM.
6. Un anticuerpo monoclonal humano que se une a AILIM humana y comprende las siguientes características (a) y (b):
(a) un polipéptido de cadena pesada del anticuerpo comprende uno cualquiera de los siguientes puntos (I) o (II):
(I) una secuencia de aminoácidos desde el aminoácido 20 hasta el aminoácido 470 de la SEQ ID NO: 28; o
(II) una secuencia de aminoácidos que comprende los aminoácidos desde la posición 20 hasta la posición 470 de la SEQ ID NO: 28, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de
aminoácidos son insertados o añadidos; y
(b) un polipéptido de cadena liviana del anticuerpo comprende uno de los siguientes puntos (I) o (II):
(I) una secuencia de aminoácidos desde el aminoácido 23 hasta el aminoácido 236 de la SEQ ID NO: 30; o
(II) una secuencia de aminoácidos que comprende los aminoácidos desde la posición 23 hasta la posición 236 de la SEQ ID NO: 30, en la que uno a diez restos de aminoácidos son eliminados o sustituidos, o a la que uno a diez restos de aminoácidos son insertados o añadidos,
siempre que, cuando el polipéptido de cadena pesada es el del punto anterior
(II) de (a) o el polipéptido de cadena liviana es el del punto anterior (II) de (b), dicho anticuerpo comprende una cualquiera de las características de los siguientes puntos (i) a (iii):
(i) una actividad para impedir la reacción linfocitaria mixta;
(ii) una actividad para inducir la transducción de señales para inducir interferón-º;o
(iii) una actividad para inducir la citotoxicidad celular dependiente del anticuerpo a las células que expresan AILIM.
7. Un ADN que codifica un polipéptido de región variable de cadena pesada del anticuerpo humano de la reivindicación 1, en el que dicho polipéptido comprende la secuencia de aminoácidos desde el aminoácido 20 hasta el aminoácido 117 de la SEQ ID NO: 28.
8. Un ADN que codifica un polipéptido de región variable de cadena liviana del anticuerpo de la reivindicación 3, el que dicho polipéptido comprende la secuencia de aminoácidos desde el aminoácido 23 hasta el aminoácido 116 de la SEQ ID NO: 30.
9. Un ADN que codifica un polipéptido de cadena pesada del anticuerpo humano de la reivindicación 2, en el que dicho polipéptido comprende la secuencia de aminoácidos desde el aminoácido 20 hasta el aminoácido 470 de la SEQ ID NO: 28.
10. Un ADN que codifica un polipéptido de cadena liviana del anticuerpo humano de la reivindicación 4, en el que dicho polipéptido comprende la secuencia de aminoácidos desde el aminoácido 23 hasta el aminoácido 236 de la SEQ ID NO: 30.
11. Un ADN seleccionado de los puntos (a) o (b) siguientes:
(a) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 126 hasta el nucleótido 419 de la SEQ ID NO: 27, o
(b) un ADN que comprende la secuencia de nucleótidos desde el nucleótido
105 hasta el nucleótido 386 de la SEQ ID NO: 29.
12. Un ADN seleccionado de los puntos (a) o (b) siguientes:
(a) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 69 hasta el nucleótido 1481 de la SEQ ID NO: 27, o
(b) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 39 hasta el nucleótido 749 de la SEQ ID NO:29.
13. Un vector que comprende el ADN de una cualquiera de las reivindicaciones 7 a 12.
14. El vector de la reivindicación 13, que comprende un ADN que comprende la secuencia de nucleótidos desde el nucleótido 126 hasta el nucleótido 419 de la SEQ ID NO: 27.
15. El vector de la reivindicación 13, que comprende un ADN que comprende la secuencia de nucleótidos desde el nucleótido 69 hasta el nucleótido 1481 de la SEQ ID NO: 27.
16. El vector de la reivindicación 13, que comprende un ADN que comprende la secuencia de nucleótidos desde el nucleótido 105 hasta el nucleótido 385 de la SEQ ID NO: 29.
17. El vector de la reivindicación 13, que comprende un ADN que comprende la secuencia de nucleótidos desde el nucleótido 39 hasta el nucleótido 749 de la SEQ ID NO: 29.
18. El vector de la reivindicación 13, que comprende un ADN de acuerdo con los siguientes puntos (a) y (b):
(a) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 126 hasta el nucleótido 419 de la SEQ ID NO: 27 y
(b) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 105 hasta el nucleótido 386 de la SEQ ID NO: 29.
19. El vector de la reivindicación 13, que comprende un ADN de acuerdo con los siguientes puntos (a) y (b):
(a) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 69 hasta el nucleótido 1481 de la SEQ ID NO: 27 y
(b) un ADN que comprende la secuencia de nucleótidos desde el nucleótido 39 hasta el nucleótido 749 de la SEQ ID NO: 29.
20. Una célula que produce el anticuerpo monoclonal humano de una cualquiera de las reivindicaciones 1 a 6, donde la célula no es una célula embrionaria humana.
21. La célula de la reivindicación 20, donde dicha célula es una célula fusionada obtenida mediante la fusión de la célula B, obtenida de un mamífero capaz de producir dicho anticuerpo monoclonal humano y una célula de mieloma obtenida de un mamífero.
22. Un huésped no humano recombinante genético transformado por el vector de una cualquiera de las reivindicaciones 13 a 19, obteniéndose dicho huésped de un mamífero seleccionado del grupo que consiste en animal bovino, cabra, conejo, ratón, rata, hámster y cobayo.
23. El huésped recombinante genético de la reivindicación 22, donde dicho huésped es una célula de mamífero no humano.
24. El huésped recombinante genético de la reivindicación 22, donde dicho huésped es un huevo fertilizado de mamífero no humano.
25. Un anticuerpo monoclonal humano o una porción del mismo que se une a AILIM humana producida por un huésped recombinante genético de las reivindicaciones 22 o 23.
26. Una composición farmacéutica que comprende el anticuerpo humano de una cualquiera de las reivindicaciones 1 a 6, y un vehículo farmacéuticamente aceptable.
27. Una composición farmacéutica que comprende un anticuerpo monoclonal humano o una porción del mismo de la reivindicación 25, y un vehículo farmacéuticamente aceptable.
28. Uso del anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para preparar una composición farmacéutica para la prevención, tratamiento o profilaxis de la alergia de tipo retardada.
29. Uso del anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para preparar una composición farmacéutica para la prevención, tratamiento o profilaxis de la artritis reumatoidea.
30. Uso del anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para preparar una composición farmacéutica para la prevención, tratamiento o profilaxis del lupus eritematoso sistémico.
31. Uso del anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para preparar una composición farmacéutica para la prevención, tratamiento o profilaxis de la psoriasis.
32. Uso del anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para preparar una composición farmacéutica para la
prevención, tratamiento o profilaxis de enfermedades inflamatorias.
33. El anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para su uso en la prevención, tratamiento o profilaxis de la alergia de tipo retardada.
5 34. El anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para su uso en la prevención, tratamiento o profilaxis de la artritis reumatoidea.
35. El anticuerpo o una porción del mismo de una cualquiera de las
reivindicaciones 1 a 6 y 25 para su uso en la prevención, tratamiento o profilaxis del 10 lupus eritematoso sistémico.
36. El anticuerpo o una porción del mismo de una cualquiera de las reivindicaciones 1 a 6 y 25 para su uso en la prevención, tratamiento o profilaxis de la psoriasis.
37. El anticuerpo o una porción del mismo de una cualquiera de las
15 reivindicaciones 1 a 6 y 25 para su uso en la prevención, tratamiento o profilaxis de enfermedades inflamatorias.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Métodos y composiciones para tratar y prevenir enfermedades asociadas con la integrina AVB8, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un anticuerpo aislado que se une específicamente a la integrina β8 humana e inhibe la adhesión del péptido asociado a latencia (LAP) a ανβ8, en donde el […]
Proteínas de unión al antígeno ST2, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo aislado que se une a un antígeno ST2 que tiene la secuencia de aminoácidos 19-556 del SEQ ID NO: 1, comprendiendo dicho anticuerpo una secuencia de […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]