ANTAGONISTAS DE CADHERINA R SELECTIVOS Y PROCEDIMIENTOS.
Péptido que es un antagonista selectivo de la cadherina R, constituido por de siete residuos aminoácidos y que presenta la secuencia de aminoácidos Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEC ID nº 6),
en el que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/013212.
Solicitante: THE SCRIPPS RESEARCH INSTITUTE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10550 NORTH TORREY PINES ROAD LA JOLLA, CA 92037 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FRIEDLANDER, MARTIN, DORRELL,Michael,I.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Abril de 2004.
Clasificación Internacional de Patentes:
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
Clasificación PCT:
- A61K38/08 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen de 5 a 11 aminoácidos.
- A61P27/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 27/00 Medicamentos para tratar los trastornos de los sentidos. › Agentes oftálmicos.
- C07K14/705 C07K 14/00 […] › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
- C07K7/06 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
- C07K7/56 C07K 7/00 […] › ciclados de forma distinta que por el ácido diamino-2,4 butanoico.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
Fragmento de la descripción:
REFERENCIA CRUZADA A LAS SOLICITUDES RELACIONADAS
La presente solicitud reivindica los derechos de la solicitud provisional de patente US nº de serie 60/467.188, presentada el 1 de mayo de 2003.
DECLARACIÓN DE LOS DERECHOS GUBERNAMENTALES 5
La presente invención se realizó con el apoyo del gobierno de los Estados Unidos mediante las subvenciones nº EY11254 y nº EY12598 del National Institutes of Health. El gobierno de los Estados Unidos posee determinados derechos sobre la presente invención.
CAMPO DE LA INVENCIÓN
La presente invención se refiere de manera general a los antagonistas de las moléculas de adhesión celular de 10 mamífero. Más específicamente, la invención se refiere a antagonistas peptídicos selectivos de la cadherina R de mamífero (cadherina-4) que resultan útiles para inhibir la adhesión celular y la angiogénesis retiniana.
ANTECEDENTES DE LA INVENCIÓN
La familia de moléculas de la cadherina está constituida por glucoproteínas transmembranales que actúan en interacciones célula-célula selectivas dependientes del calcio. Estas moléculas desempeñan importantes papeles 15 durante el desarrollo embrionario y la morfogénesis de tejidos al mediar en el reconocimiento y la distribución celulares. Las subfamilias de cadherinas (cadherinas clásicas, protocadherinas, desmocolinas y otras proteínas de tipo cadherina) se caracterizan por un número variable de dominios extracelulares de la cadherina, un único segmento transmembranal y un único dominio citoplasmático. Se ha informado de que las cadherinas denominadas clásicas (es decir, las cadherinas E, P, N y R) presentan cinco dominios extracelulares de cadherina repetidos en tándem (EC1-EC5) que 20 intervienen en interacciones preferentemente homofílicas, y una cola citoplasmática altamente conservada que media en la señalización intracelulares específica de la adhesión.
Las adhesiones célula-célula mediadas por la cadherina se producen al interactuar múltiples moléculas de cadherina expresadas en células contiguas, conduciendo a la formación de uniones adherentes. Según el modelo de cremallera de cadherinas propuesto por Shapiro et al., Nature 374(6520):327-37, 1995, las moléculas de cadherina 25 dentro de la membrana de la misma célula forman dímeros de cadenas paralelas estrechamente unidos (es decir los denominados dímeros cis). Tal como se ilustra en la figura 1, estos dímeros cis se unen a continuación a dímeros de cadherina expresados sobre células contiguas (transdimerización). Tras haberse producido una interacción suficiente, puede producirse el agrupamiento de cadherinas, a medida que se reclutan más moléculas de cadherina en el sitio, conduciendo a la interdigitación de moléculas de las dos superficies celulares. De esta manera pueden combinarse 30 interacciones relativamente débiles para formar adhesiones célula-célula bastante fuertes.
Tras la adhesión inicial de las cadherinas, las señales intracelulares, transmitidas mediante interacciones de las colas citoplasmáticas de las cadherinas con las moléculas de cadherina α y β, conducen a la reorganización del citoesqueleto. Aunque la asociación con los filamentos de actina no se cree que afecte a la unión homofílica, su asociación ayuda a mantener las moléculas de cadherina en los sitios de la interacción. En una relación de tipo 35 simbiótico, el agrupamiento de cadherinas provoca la reorganización del citoesqueleto y proporciona puntos de unión en la membrana, que resultan importantes para la producción de cambios celulares tras la formación de uniones adherentes. Simultáneamente, la asociación con el citoesqueleto mantiene las cadherinas en los sitios de interacción y ayuda a reclutar nuevas moléculas de cadherinas, mediando de esta manera en el agrupamiento de las cadherinas. El calcio desempeña un papel importante como cofactor durante el agrupamiento de cadherinas. Se pierde la función de 40 cadherina y las moléculas adquieren susceptibilidad a la degradación por proteasas en soluciones con una concentración insuficiente de iones calcio (es decir, inferior a aproximadamente 2 mM). Esto se debe al requisito de que el calcio estabilice la estructura de las moléculas de cadherina y proporcione la orientación correcta de los interfaz contiguos de cadherina.
Aunque se ha informado de que cada uno de los cinco dominios extracelulares de la cadherina clásica, EC1 a 45 EC5, desempeña un papel importante en la mediación de la dimerización de las cadherinas, el análisis de mutaciones sugiere que la mayoría de los residuos que se forman en la interfaz de dimerización se encuentra dentro del dominio más N-terminal de la cadherina (EC1) (Kitagawa et al., Biochem. Biophys. Res. Commun. 271(2):358-63, 2000). Sin embargo, se conoce relativamente poco sobre los mecanismos de homodimerización específica entre las moléculas de cadherina. 50
Las cadherinas desempeñan un papel significativo durante la guía neuronal y el desarrollo del sistema nervioso central. Se ha publicado que algunas subdivisiones del cerebro se definen a partir de la expresión diferencial de tipos de cadherina. Las cadherinas también desempeñan un papel importante en el desarrollo neural retiniano a través de la expresión específica en diferentes regiones de la retina en desarrollo. Por ejemplo, durante el desarrollo embrionario de la retina de pollo, se ha informado de que la cadherina B únicamente se encuentra en la glía de Müller, mientras que 55
determinadas poblaciones de células bipolares expresan cadherina R (también conocida como cadherina-4). Las células amacrinas y un subconjunto de células ganglionares expresan las cadherinas 6B y 7. Dentro de la capa plexiforme interna de la retina, estas mismas cadherinas únicamente se expresan en la sublámina asociada a los terminales nerviosos positivos para sinapsina I, sugiriendo que los perfiles de expresión diferentes contribuyen a la formación de sinapsis entre subpoblaciones específicas de neuronas durante el desarrollo de la retina. En el nervio óptico 5 embrionario, el crecimiento de los axones de las células ganglionares se encuentra mediado por la adhesión de la cadherina N con células gliales que expresan cadherina R.
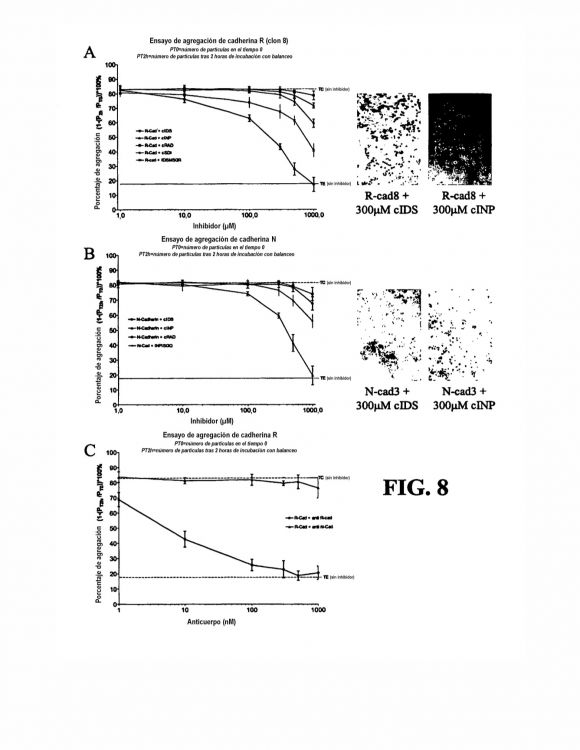
La adhesión de la cadherina también desempeña un papel en la vascularización retiniana durante el desarrollo (Dorrell et al., Invest. Ophthalmol. Vis. Sci. 43(11):3500-10, 2002). La alteración de la adhesión de la cadherina R durante la formación del plexo vascular superficial resulta en la pérdida de las interconexiones vasculares complejas 10 observadas durante la formación normal de patrón vascular. Al bloquear la adhesión de la cadherina R durante la formación posterior de capas vasculares profundas, se pierden claves cruciales de la guía, provocando que los vasos migren más allá de los plexos vasculares profundos normales y hacia el interior de la capa de fotorreceptores.
La retina está constituida por capas bien definidas de elementos neuronales, gliales y vasculares. Cualquier enfermedad o estado que altere las capas retinianas incluso ligeramente puede conducir a la degeneración neuronal y a 15 una pérdida visual significativa. La degeneración retiniana del ratón (ratón rd/rd) ha sido investigada durante más de 70 años como modelo de muchas enfermedades que conducen a la muerte de las células fotorreceptoras. En el ratón rd/rd, la degeneración de los fotorreceptores se inicia durante las primeras tres semanas después del nacimiento, al experimentar apoptosis las células bastones, lo que se atribuye a una mutación en la subunidad de la fosfodiesterasa dependiente de GMPc, seguido de la muerte de los fotorreceptores conos. 20
La atrofia vascular en el interior de la retina está asociada temporalmente con la muerte de las células fotorreceptoras en asimismo los ratones rd/rd. La vasculatura aparentemente se forma del modo característico normal a medida que se forman tres capas funcionales durante las tres primeras semanas. Sin embargo, los vasos en la capa vascular profunda empiezan a degenerar durante la segunda semana y al final de la cuarta semana posnatal, se observa una drástica reducción vascular al desaparecer prácticamente por completo los plexos profundo e intermedio. 25
En la circulación y la médula ósea adultas normales se aloja una población células madre hematopoyéticas a partir de las que pueden diferenciarse diferentes subpoblaciones de células a lo largo de linajes positivos (HSC Lin+) o negativos (HSC Lin-). Además,...
Reivindicaciones:
1. Péptido que es un antagonista selectivo de la cadherina R, constituido por de siete residuos aminoácidos y que presenta la secuencia de aminoácidos Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEC ID nº 6), en el que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln.
2. Péptido según la reivindicación 1, en el que Xaa es Asp o Asn. 5
3. Péptido constituido por la secuencia de aminoácidos Ile-Asp-Ser-Met-Ser-Gly-Arg (SEC ID nº 2) o Ile-Asp-Ser-Ala-Ser-Gly-Arg (SEC ID nº 10).
4. Péptido que es un antagonista selectivo de la cadherina R, en el que el péptido se encuentra representado por la fórmula:
10
en la que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln; X1 y X2 son independientemente un residuo aminoácido o una pluralidad de hasta 10 residuos aminoácidos unidos mediante enlaces peptídicos, e Y1 e Y2 son independientemente residuos aminoácidos unidos entre sí mediante un enlace disulfuro.
5. Péptido según la reivindicación 4, en el que Y1 e Y2 son residuos cisteína unidos entre sí mediante un 15 enlace disulfuro.
6. Péptido cíclico que presenta la secuencia de aminoácidos Cys-Ile-Xaa-Ser-Cys (SEC ID nº 7), en el que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln, y el péptido incluye un enlace disulfuro entre los dos residuos de Cys.
7. Péptido según la reivindicación 6, en el que Xaa es Asp. 20
8. Composición farmacéutica para inhibir la angiogénesis retiniana, que comprende un péptido según cualquiera de las reivindicaciones 1 a 7, y un portador farmacéuticamente aceptable de la misma, conjuntamente con un excipiente farmacéuticamente aceptable.
9. Método in vitro para inhibir la adhesión celular mediada por cadherina R, que comprende poner en contacto las células de mamífero que expresan las moléculas de cadherina R sobre su superficie celular con una 25 cantidad inhibidora de la adhesión celular de un péptido según cualquiera de las reivindicaciones 1 a 7.
10. Utilización de un péptido que es un antagonista selectivo de la cadherina R y que comprende 3 a 30 residuos aminoácidos, presentando los tres residuos contiguos del péptido la secuencia de aminoácidos Ile-Xaa-Ser, en la que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln, para la preparación de una composición farmacéutica destinada a inhibir la angiogénesis retiniana en un paciente que sufre de 30 angiogénesis vascular retiniana anormal.
11. Utilización de un péptido que es un antagonista selectivo de la cadherina R y que comprende 3 a 30 residuos aminoácidos, presentando los tres residuos contiguos del péptido la secuencia de aminoácidos Ile-Xaa-Ser; en la que Xaa es un residuo aminoácido seleccionado de entre el grupo constituido por Asp, Asn, Glu y Gln, para la preparación de una composición farmacéutica destinada al tratamiento de la degeneración macular relacionada con la 35 edad o de la retinopatía diabética.
12. Utilización según la reivindicación 10 u 11, en la que el péptido comprende por lo menos 7 residuos aminoácidos, presentando los siete residuos aminoácidos contiguos del péptido la secuencia de aminoácidos Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEC ID nº 6).
13. Utilización según la reivindicación 10 u 11, en la que el péptido comprende 3 a 10 residuos aminoácidos 40 dispuestos en un anillo.
14. Utilización según la reivindicación 13, en la que el péptido comprende por lo menos 7 residuos aminoácidos, presentando los siete residuos aminoácidos contiguos del péptido la secuencia de aminoácidos Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEC ID nº 6).
15. Utilización según cualquiera de las reivindicaciones 10 a 14, en la que Xaa es Asp o Asn. 45
16. Utilización según la reivindicación 10 u 11, en la que el péptido es un péptido según cualquiera de la reivindicaciones 1 a 17.
17. Utilización de un péptido según cualquiera de las reivindicaciones 1 a 7 para la preparación de una composición farmacéutica para inhibir el direccionamiento de las células madre a la vasculatura en desarrollo destinada a tratar una enfermedad asociada al desarrollo vascular anormal, en la que la composición farmacéutica está destinada a poner en contacto células madre de mamífero con una cantidad inhibidora del direccionamiento vascular de dicho péptido. 5
18. Utilización según la reivindicación 17, en la que la enfermedad es la degeneración macular o la retinopatía diabética.
19. Utilización según la reivindicación 17, en la que las células madre son células precursoras endoteliales.
Patentes similares o relacionadas:
Procedimientos de tratamiento del cáncer usando antagonistas de unión al eje de PD-1 e inhibidores de TIGIT, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo antagonista anti-PD-L1 o fragmento de unión a antígeno del mismo y un anticuerpo antagonista anti-TIGIT o fragmento de unión a antígeno del mismo para su uso […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Uso de CAR basados en ICOS para mejorar la actividad antitumoral y la persistencia del CAR, del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una secuencia de ácido nucleico aislada que codifica un receptor de antígeno quimérico (CAR), en donde el CAR comprende un dominio de unión a antígeno, un dominio transmembrana […]
Péptido derivado de GPC3, composición farmacéutica para el tratamiento o la prevención de cáncer usando el mismo, inductor de inmunidad y método para producir células presentadoras de antígeno, del 17 de Junio de 2020, de CYTLIMIC INC: Composición farmacéutica para su uso en el tratamiento o la prevención de cáncer, que comprende un péptido que consiste en una secuencia de aminoácidos […]
Péptidos inhibidores derivados del transcrito de tipo TREM-1 (TLT-1) y sus usos, del 10 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido de 6 a 16 aminoácidos que comprende al menos 6 aminoácidos consecutivos de la secuencia de aminoácidos sec. con núm. de ident.: 4 para su uso en el tratamiento […]
Fijación eficaz como objetivo de la leucemia humana primaria utilizando células T modificadas con receptor de antígeno quimérico anti-CD123, del 3 de Junio de 2020, de NOVARTIS AG: Una molécula de ácido nucleico aislada que codifica un receptor de antígeno quimérico (CAR), en donde dicho CAR comprende un dominio de unión anti-CD123 humanizado, […]
Dominios coestimuladores para su uso en células genéticamente modificadas, del 3 de Junio de 2020, de Precision Biosciences, Inc: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica un dominio coestimulador que comprende una secuencia de aminoácidos establecida […]
Método para proporcionar linfocitos T específicos de tumor, del 27 de Mayo de 2020, de HS Diagnomics GmbH: Un método para fabricar un receptor artificial de linfocitos T específicos de tumor, que comprende las etapas de: - proporcionar una preparación de linfocitos […]