Analogos estables de GLP-1.
Un análogo de GLP-1 resistente a la proteinasa, o de una variante de GLP-1,
que tiene una secuencia de aminoácidos que incluye una secuencia de sustrato de proteinasa que es escindida en condiciones fisiológicas por una proteinasa diana, en el que dicho análogo tiene una secuencia de aminoácidos que corresponde a dicho GLP-1 o variante de GLP-1 donde el residuo P'1 de dicha secuencia de sustrato de proteinasa es sustituida por un análogo de aminoácido que tiene un carbono CI tetrasustituido, en el que la sustitución del residuo P'1 reduce la susceptibilidad del análogo a la escisión por dicha proteinasa diana en relación con dicho factor peptídico o polipeptídico, y dicho análogo de aminoácido se representa mediante la fórmula II: en la que R1 y R2 son seleccionados independientemente de un alquilo C1-C10 o un halógeno; R3 es elegido entre alquilo C1-C10, arilo, un grupo hidroxilo, - (CH2) m-COOH, - (CH2) m-NH2, - (CH2) m-N-C (≥NH) NH2, - (CH2) m-C (≥O) NH2, -SH, o - (CH2) m-S-CH3; y m es 0, 1 ó 2; y en la que el alquilo incluye tanto cadenas de alquilo no sustituidas, como sustituidas, que tienen sustituyentes que reemplazan un hidrógeno en uno o más carbonos de la cadena principal de hidrocarburo, estos incluyen un halógeno, un hidroxilo, un carbonilo (como un carboxilo, un alcoxicarbonilo, un formilo, o un acilo), un tiocarbonilo (como un tioester, un tioacetato, o un tioformato), un alcoxilo, un fosforilo, un fosfato, un fosfonato, un fosfinato, un amino, un amido, una amidina, un ciano, un nitro, un sulfhidrilo, un alquiltio, un sulfato, un sulfonato, un sulfamoilo, un sulfonamido, un sulfonilo, un heterociclilo, un aralquilo, o un fragmento aromático o heteroaromático, o los fragmentos sustituidos en la cadena hidrocarburo pueden ser sustituidos ellos mismos e incluir formas sustituidas y no sustituidas de grupos amino, azido, imino, amido, fosforilo (incluyendo fosfonato y fosfinato), sulfonilo (incluyendo sulfato, sulfonamido, sulfamoilo y sulfonato), y grupos sililo, así como también éteres, alquiltios, carbonilos (incluyendo cetonas, aldehídos, carboxilatos, y ésteres), -CF3, y -CN.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/015488.
Solicitante: TRUSTEES OF TUFTS COLLEGE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: BALLOU HALL MEDFORD, MA 02155 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BACHOVCHIN, WILLIAM, W., LAI,Hung-Sen, SANFORD,David George.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/04 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Péptidos que tienen hasta 20 aminoácidos en una secuencia totalmente determinada; Sus derivados (gastrinas A61K 38/16, somatostatinas A61K 38/31, melanotropinas A61K 38/34).
- A61K38/22 A61K 38/00 […] › Hormonas (derivados de pro-opiomelanocortina, pro-encefalina o pro-dinorfina A61K 38/33, p. ej. corticotropina A61K 38/35).
- A61K38/26 A61K 38/00 […] › Glucagón.
- C07K14/575 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormonas.
- C07K14/60 C07K 14/00 […] › Factor de liberación de la hormona del crecimiento (GH-RF) (Somatoliberina).
- C07K14/605 C07K 14/00 […] › Glucagones.
PDF original: ES-2383752_T3.pdf
Fragmento de la descripción:
Análogos estables de GLP-1 Antecedentes de la invención [0001] Los productos terapéuticos de polipéptidos y péptidos son comúnmente utilizados en la práctica médica. Su facilidad de producción, mediante tecnología del ADN recombinante o sintetizadores de péptidos, asegura su uso continuado en una variedad de circunstancias en los próximos años. Por consiguiente, los productos terapéuticos con polipéptidos, como hormonas, citoquinas y factores de crecimiento, representan una clase importante de agentes terapéuticos. Sin embargo, determinados polipéptidos nativos pueden ser rápidamente inactivados in vivo por medio de proteólisis o isomerización. Dicha inactivación puede resultar inconveniente en los casos en los que se desea mantener un nivel de sangre constante o mantenido del producto terapéutico durante un periodo de tiempo, puesto que será necesaria entonces una administración repetida. En algunos casos, uno o más productos proteolíticos del polipéptido pueden ser antagonistas a la actividad del polipéptido intacto. En estos casos, la administración de solo un producto terapéutico adicional puede ser insuficiente para superar el efecto antagonista de los productos proteolíticos. [0002] Para una mayor ilustración, una clase de hormonas peptídicas cuya presencia prolongada en la sangre puede ser beneficiosa incluye los péptidos similares al glucagón tipo 1 y 2 (GLP-1 y GLP-2, respectivamente) , péptido insulinotrópico dependiente de la glucosa (GIP) , neuropéptido Y (NPY) , polipéptido pancreático (PP) , y péptido YY (PYY) . El GLP-1 es una importante hormona polipeptídica con función reguladora en el metabolismo de la glucosa y el metabolismo y secreción gastrointestinal. Los esfuerzos actuales muestran que el GLP-1 es un factor de crecimiento para las células beta en el páncreas y quizá esté implicado también en la diferenciación celular en otros órganos. El GLP-2 es un péptido de 33 aminoácidos que tiene una aplicación terapéutica en el tratamiento de enfermedades del tracto gastrointestinal. En particular, se ha determinado que el GLP-2 actúa como agente trófico para mejorar y mantener una correcta función gastrointestinal, así como para promover el crecimiento de los tejidos intestinales (Véase, p.ej., las patentes estadounidenses nº 5.834.428; 5.789.379; y 5.990.077; y la Publicación Internacional nº WO 98/52600) . El GIP es un péptido de 42 aminoácidos sintetizado y segregado por las células endocrinas en el intestino delgado (Véase R. A. Pederson, et al., Endocrinology 99, 780- 785 (1976) y T. B. Usdin, et al., Endocrinology 133, 2861-2870 (1993) ) . Las infusiones de GIP han demostrado que inhiben los efectos del glucagón en el hígado, mientras que resaltan los de la insulina. Además, el GIP tiene un efecto doble en el flujo de sangre hepática, aumentando el flujo a través de la vena porta e inhibe el flujo por la arteria hepática. El neuropéptido Y es un miembro de 36 aminoácidos de la familia del polipéptido pancreático. Se encuentra altamente concentrado en el sistema nervioso central y periférico de los mamíferos, es la sustancia conocida más potente que causa un aumento en la alimentación, y puede tener un papel en la base genética de la diabetes mellitus tipo II (Véase las patentes estadounidenses nº 6410701, 6075009, 5026685, 5328899, y K. Tatemoto, Proc. Natl. Acad. Scl. USA 79, 5485-5489 (1982) ) . El péptido YY (PYY) y el polipéptido pancreático (PP) son hormonas peptídicas relacionadas estructuralmente implicadas en la pérdida de memoria, depresión, ansiedad, epilepsia, dolor, hipertensión, y trastornos alimentarios y del sueño. [0003] Se cree que estas hormonas polipeptídicas, y otros factores polipeptídicos, son degradados por los miembros de la clase escisora de la post-prolina de las enzimas serina proteinasa, como la dipeptidil peptidasa IV (DPP IV) . La DPP IV es una membrana asociada a la serina peptidasa que escinde dipéptidos N-terminales de una cadena peptídica que contiene en la penúltima posición (P1) , preferentemente, un residuo de prolina, o un residuo de alanina si el residuo N-terminal (P2) es histidina o un gran aromático como tirosina, triptófano o fenilalanina. La secuencia amino terminal del GLP-1, el GIP, y el GLP-2 es His-Ala-Glu, Tyr-Ala-Glu, y His-Ala-Asp respectivamente. La secuencia amino terminal del NPY, el PP y el PYY es Tyr-Pro-Ser, Ala-Pro-Leu y Tyr-Pro-Ile respectivamente. Por lo tanto, la DPP IV ha sido implicada en la regulación de la actividad de cada una de estas hormonas polipeptídicas, así como otros polipéptidos, in vivo. [0004] La eliminación mediada por DPP IV de los dipéptidos Xaa-Ala o Xaa-Pro, en el que Xaa es un residuo de aminoácido, de la N-terminal de las hormonas peptídicas bioactivas arriba mencionadas los vuelve inactivos, o incluso antagónicos. Por tanto, la escisión e inactivación de las hormonas peptídicas mediante serina proteinasas como la DPP IV es sólo un ejemplo que ilustra la significativa limitación impuesta por la proteólisis al uso de polipéptidos terapéuticos. El descubrimiento de análogos que muestran estabilidad ante la proteólisis, como la inactivación mediada por DPP IV, tiene por lo tanto un especial interés. Por consiguiente, existe una necesidad en la técnica de hormonas peptídicas resistentes a la proteólisis.
Resumen de la invención [0005] La presente invención proporciona generalmente composiciones de análogos de péptidos y polipéptidos (aquí "análogos de GLP-1") que son resistentes a la escisión por proteinasas (p.ej., análogos que son resistentes a la proteólisis) . [0006] Los inventores han observado que la modificación de sustratos de la proteinasa que escinde la post-prolina en la posición P'1 (el residuo del lado carboxilo terminal del lugar de la escisión de amida) puede producir análogos del sustrato con una susceptibilidad muy reducida a la escisión mediada por enzimas en comparación con el sustrato nativo, al tiempo que se mantiene la actividad biológica del sustrato nativo. Por ejemplo, la modificación de sustratos de la serina proteinasa DPP IV escisora de post-prolina con un análogo de aminoácido en el residuo P'1 (del lugar de escisión de DPP IV) resulta en un sustrato análogo con una susceptibilidad reducida a la escisión mediante DPP IV, pero manteniendo la actividad biológica del sustrato subyacente. [0007] La invención hace referencia a la observación más general de que la modificación de los sustratos de proteinasa en el residuo P'1 (del lugar de escisión) con un análogo de aminoácido que tenga un CI carbono tetrasustituido puede aumentar notablemente la vida media in vivo del análogo resultante, p.ej., que puede tener una mayor duración de la acción biológica y/o una eliminación reducida en comparación con el polipéptido de tipo natural. Basándose en este descubrimiento, y su aplicabilidad a sustratos escindidos por una gama diversa de porteinasas, la presente invención proporciona un método para producir análogos P'1 de sustratos para proteinasas tales como serina proteinasas, metaloproteinasas, proteinasas aspárticas, y cisteína proteinasas. [0008] La presente invención también proporciona composiciones farmacéuticas que comprenden uno o más de los "análogos de GLP-1" en cuestión. Los ejemplos de composiciones farmacéuticas comprenden uno o más análogos de "GLP-1" formulados con portadores o excipientes farmacéuticamente aceptables. [0009] Los análogos de GLP-1 en cuestión pueden administrarse solos, o pueden administrarse como parte de un régimen terapéutico que incluya otras terapias apropiadas para la indicación de la enfermedad específica. A modo de ejemplo, la administración de un análogo de GLP-1 para el tratamiento de la diabetes puede usarse sola, o puede usarse en combinación con la modulación de la dieta y ejercicio, y/o con la administración de insulina. Otros ejemplos de métodos combinatorios de tratamiento comprenden la administración de análogo de GLP-1 y administración de un inhibidor de la enzima específica que escinde el polipéptido nativo. Dicho inhibidor puede ser específico para la enzima concreta (p.ej., un inhibidor específico de DPP IV)
o puede ser más genérico a la clase de enzimas (p.ej., un inhibidor de serina proteasas) . [0010] Otra área de la presente invención es el uso de los análogos de GLP-1 para fines de diagnóstico. [0011] Otro aspecto de la presente invención es el uso de análogos de GLP-1 para la fabricación de un medicamento que proporciona péptidos resistentes a la proteinasa.
Otro aspecto de la presente invención es el uso de un análogo de GLP-1 en la fabricación de un medicamento terapéutico.
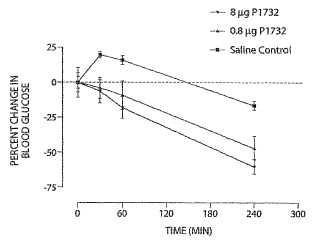
Breve descripción de los dibujos [0013]
La Figura 1 muestra... [Seguir leyendo]
Reivindicaciones:
en la que R1 y R2 son seleccionados independientemente de un alquilo C1-C10 o un halógeno; R3 es elegido entre alquilo C1-C10, arilo, un grupo hidroxilo, - (CH2) m-COOH, - (CH2) m-NH2, - (CH2) m-N-C (=NH) NH2, - (CH2) m-C (=O) NH2, -SH, o - (CH2) m-S-CH3; y m es 0, 1 ó 2; y en la que el alquilo incluye tanto cadenas de alquilo no sustituidas, como sustituidas, que tienen sustituyentes que reemplazan un hidrógeno en uno o más carbonos de la cadena principal de hidrocarburo, estos incluyen un halógeno, un hidroxilo, un carbonilo (como un carboxilo, un alcoxicarbonilo, un formilo, o un acilo) , un tiocarbonilo (como un tioester, un tioacetato, o un tioformato) , un alcoxilo, un fosforilo, un fosfato, un fosfonato, un fosfinato, un amino, un amido, una amidina, un ciano, un nitro, un sulfhidrilo, un alquiltio, un sulfato, un sulfonato, un sulfamoilo, un sulfonamido, un sulfonilo, un heterociclilo, un aralquilo, o un fragmento aromático o heteroaromático, o los fragmentos sustituidos en la cadena hidrocarburo pueden ser sustituidos ellos mismos e incluir formas sustituidas y no sustituidas de grupos amino, azido, imino, amido, fosforilo (incluyendo fosfonato y fosfinato) , sulfonilo (incluyendo sulfato, sulfonamido, sulfamoilo y sulfonato) , y grupos sililo, así como también éteres, alquiltios, carbonilos (incluyendo cetonas, aldehídos, carboxilatos, y ésteres) , -CF3, y -CN.
2. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1 de la reivindicación 1, en el que R1 y R2 son elegidos independientemente entre un metilo, etilo o propilo.
3. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de la reivindicación 1, en el que R1 y R2 son ambos un metilo.
4. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de la reivindicación 1, en el que R3 es elegido entre un alquilo C1-C10, fenilo, hidroxifenilo, indol, imidazol, hidroxilo, -COOH, -CH2COOH, -CH2CH2-NC (=NH) NH2, -CH2C (=O) NH2, - CH2CH2C (=O) NH2, -SH, o -CH2SCH3.
5. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de la reivindicación 1, que conserva al menos el 50% de la actividad biológica de dicho factor peptídico o polipeptídico activo.
6. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de la reivindicación 1, en el que la proteinasa diana es serina proteinasa, metaloproteinasa, proteinasa aspártica, o cisteína proteinasa.
7. Una preparación farmacéutica que comprende el análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de cualquiera de las reivindicaciones 1-6.
8. Una preparación farmacéutica envasada que comprende: el análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de cualquiera de las reivindicaciones 1-6, en un excipiente farmacéuticamente aceptable, y una etiqueta o instrucciones para su administración a un paciente.
9. Una preparación veterinaria envasada que comprende: el análogo resistente a la proteinasa de cualquiera de las reivindicaciones 1-6, en un excipiente aceptable, y una etiqueta o instrucciones para su administración a un animal.
10. El uso de un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de cualquiera de las reivindicaciones 1-6 para la fabricación de un medicamento para tratar o prevenir una o más entre la resistencia a la insulina, intolerancia a la glucosa, enfermedades relacionadas con el corazón, hiperglucemia, hiperinsulinemia, obesidad, hiperlipidemia, hiperlipoproteinemia, anomalías en la mucosa del tracto digestivo, trastornos de la ingesta de alimentos, y trastorno gastrointestinal.
11. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, según cualquiera de las reivindicaciones de la 1 a la 6 para su uso en el tratamiento o prevención de una o más entre la resistencia a la insulina, la intolerancia a la glucosa, enfermedades relacionadas con el corazón, hiperglucemia,
hiperinsulinemia, obesidad, hiperlipidemia, hiperlipoproteinemia, anomalías en la mucosa del tracto digestivo, trastornos de la ingesta de alimentos, y trastorno gastrointestinal.
12. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de
cualquiera de las reivindicaciones de la 1 a la 6, que además comprende la secuencia de aminoácidos C-terminal de Exendin-4.
13. El análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, de la reivindicación 12, en el que la secuencia de aminoácidos C-terminal de Exendin-4 es PSSGAPPPS.
14. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, que tiene una secuencia de aminoácidos elegida del grupo compuesto por:
HAXGTFTSDVSSYLEGQAAKEFIAWLVKGRPSSGAPPPS-NH2, HAXGTFTSDVSSYLEGQAAKEFIAWLVKGRG, HAXGTFTSDVSSYLEGQAAKEFIAWLVKGR-NH2, y XaaAXGTFTSDVSSYLEGQAAKEFIAWLVKGR;
en el que Xaa es un residuo de aminoácido, X es un análogo de aminoácido de la Fórmula II:
en la que R1 y R2 son seleccionados independientemente de un alquilo C1-C10 o un halógeno; R3 es elegido entre alquilo C1-C10, arilo, un grupo hidroxilo, - (CH2) m-COOH, - (CH2) m-NH2, - (CH2) m-N-C (=NH) NH2, - (CH2) m-C (=O) NH2, -SH, o - (CH2) m-S-CH3; y m es 0, 1 ó 2; y en la que el alquilo incluye tanto cadenas de alquilo no sustituidas, como sustituidas, que tienen sustituyentes que reemplazan un hidrógeno en uno o más carbonos de la cadena principal de hidrocarburo, estos incluyen un halógeno, un hidroxilo, un carbonilo (como un carboxilo, un alcoxicarbonilo, un formilo, o un acilo) , un tiocarbonilo (como un tioester, un tioacetato, o un tioformato) , un alcoxilo, un fosforilo, un fosfato, un fosfonato, un fosfinato, un amino, un amido, una amidina, un ciano, un nitro, un sulfhidrilo, un alquiltio, un sulfato, un sulfonato, un sulfamoilo, un sulfonamido, un sulfonilo, un heterociclilo, un aralquilo, o un fragmento aromático o heteroaromático, o los 5 fragmentos sustituidos en la cadena hidrocarburo pueden ser sustituidos ellos mismos e incluir formas sustituidas y no sustituidas de grupos amino, azido, imino, amido, fosforilo (incluyendo fosfonato y fosfinato) , sulfonilo (incluyendo sulfato, sulfonamido, sulfamoilo y sulfonato) , y grupos sililo, así como también éteres, alquiltios, carbonilos (incluyendo cetonas, aldehídos, carboxilatos, y ésteres) , -CF3, -CN.
15. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, según la reivindicación 14 en el que X se selecciona del grupo compuesto por:
16. El uso de un análogo de GLP-1 o de una variante de GLP-1 resistente a la
proteinasa que tiene una secuencia de aminoácidos seleccionada del grupo compuesto por:
HAXGTFTSDVSSYLEGQAAKEFIAWLVKGRPSSGAPPPS-NH2, HAXGTFTSDVSSYLEGQAAKEFIAWLVKGRG, HAXGTFTSDVSSYLEGQAAKEFIAWLVKGR-NH2, y XaaAXGTFTSDVSSYLEGQAAKEFIAWLVKGR;
en el que Xaa es un residuo de aminoácido y X es un análogo de aminoácido de la Fórmula II:
en la que R1 y R2 son seleccionados independientemente de un alquilo C1-C10 o un halógeno;
R3 es elegido entre alquilo C1-C10, arilo, un grupo hidroxilo, - (CH2) m-COOH, - (CH2) m-NH2, - (CH2) m-N-C (=NH) NH2, - (CH2) m-C (=O) NH2, -SH, o - (CH2) m-S-CH3; y m es 0, 1 ó 2; y en la que el alquilo incluye tanto cadenas de alquilo no sustituidas, como sustituidas, que tienen sustituyentes que reemplazan un hidrógeno en uno o más carbonos de la cadena principal de hidrocarburo, estos incluyen un halógeno, un hidroxilo, un carbonilo (como un carboxilo, un alcoxicarbonilo, un formilo, o un acilo) , un tiocarbonilo (como un tioester, un tioacetato, o un tioformato) , un alcoxilo, un fosforilo, un fosfato, un fosfonato, un fosfinato, un amino, un amido, una amidina, un ciano, un nitro, un sulfhidrilo, un alquiltio, un sulfato, un sulfonato, un sulfamoilo, un sulfonamido, un sulfonilo, un heterociclilo, un aralquilo, o un fragmento aromático o heteroaromático, o los fragmentos sustituidos en la cadena hidrocarburo pueden ser sustituidos ellos mismos e incluir formas sustituidas y no sustituidas de grupos amino, azido, imino, amido, fosforilo (incluyendo fosfonato y fosfinato) , sulfonilo (incluyendo sulfato, sulfonamido, sulfamoilo y sulfonato) , y grupos sililo, así como también éteres, alquiltios, carbonilos (incluyendo cetonas, aldehídos, carboxilatos, y ésteres) , -CF3 y -CN, para la fabricación de un medicamento para tratar o prevenir una enfermedad o afección seleccionada entre enfermedades relacionadas con el corazón, hiperglucemia, obesidad, hiperlipidemia, complicaciones diabéticas, hipertensión relacionada con la obesidad, osteoporosis, depresión, trastorno esquizoafectivo, apnea del sueño, síndromes de déficit de atención con problemas de concentración, pérdida de memoria, olvido, narcolepsia y enfermedades gastrointestinales.
17. El uso de la reivindicación 16 en el que X es seleccionada del grupo compuesto por:
18. El uso de la reivindicación 16, en el que la enfermedad o afección es una enfermedad relacionada con el corazón seleccionada entre infarto de miocardio, lesión de isquemia y reperfusión, insuficiencia cardiaca congestiva y paro cardiaco.
19. El uso de la reivindicación 16, en el que la enfermedad o afección es seleccionada entre la depresión, trastorno esquizoafectivo, apnea del sueño, síndromes de déficit de atención, pérdida de memoria, olvido, y narcolepsia.
20. El uso de la reivindicación 16, en el que la enfermedad o afección es una enfermedad gastrointestinal elegida entre una enteritis regional (enfermedad de Crohn) y una enfermedad inflamatoria intestinal.
21. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, según
cualquiera de las reivindicaciones 14 y 15 para su uso en el tratamiento y prevención de una enfermedad o afección seleccionada entre enfermedades relacionadas con el corazón, hiperglucemia, obesidad, hiperlipidemia, complicaciones diabéticas, hipertensión relacionada con la obesidad, osteoporosis, depresión, trastorno esquizoafectivo, apnea del sueño, síndromes de déficit de atención con problemas de concentración, pérdida de memoria, olvido, narcolepsia, y enfermedades gastrointestinales.
22. Un análogo de GLP-1 resistente a la proteinasa, o variante de GLP-1, según cualquiera de las reivindicaciones de la 1 a la 7 y 14, o 15 para su uso como medicamento.
Patentes similares o relacionadas:
Uso del péptido qbp1 para la prevención o el tratamiento del trastorno del estrés postraumático, el síndrome de estrés agudo y/o el síndrome de adaptación general, del 8 de Abril de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Una composición que comprende un péptido que consiste en una secuencia de aminoácidos con al menos un 70% de identidad con la SEQ ID NO: 1, o que […]
Péptidos capaces de reactivar mutantes de p53, del 18 de Marzo de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Un péptido recombinante o sintético que comprende una secuencia de aminoácidos expuesta en la SEQ ID NO: 314, en donde dicho péptido reactiva […]
Péptidos de diseño corto que poseen acciones selectivas contra bacterias y células cancerosas, del 26 de Febrero de 2020, de THE UNIVERSITY OF MANCHESTER: Un péptido con la fórmula I o II que se muestra a continuación **(Ver fórmula)** en donde: A1v se selecciona de G, GKI o GIK […]
Compuestos para su uso en el tratamiento y/o prevención de una infección de mycoplasma sp., del 31 de Enero de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Compuestos para su uso en el tratamiento y/o prevención de una infección de mycoplasma sp. La presente invención hace referencia a compuestos con […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Análogos de compstatina de acción prolongada y composiciones y métodos relacionados, del 8 de Enero de 2020, de Apellis Pharmaceuticals, Inc: Un análogo de compstatina de acción prolongada que comprende un resto reductor de la eliminación unido con dos restos análogos de compstatina, en donde cada resto […]
Terapias de antibióticos peptídicos derivados del búfalo de agua, del 20 de Noviembre de 2019, de Centaur, Inc: Una composición antibiótica que comprende un péptido antibiótico, en donde el péptido comprende una secuencia aminoacídica sintética que tiene la […]
Péptidos, dispositivos y procedimientos para la detección de anticuerpos de Anaplasma, del 20 de Noviembre de 2019, de Abaxis, Inc: Una composición que comprende una población de péptidos aislados, comprendiendo dicha población tres o más péptidos diferentes, en la que cada péptido en la población […]