Análogos de alfa-MSH terapéuticamente activos.
Un péptido que consiste en la secuencia:
Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEC.
ID Nº: 1),donde el extremo amino terminal de dicho péptido es CH3-C(≥O)-.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2005/000545.
Solicitante: AbbVie Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 North Waukegan Road North Chicago, IL 60064 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LARSEN, BJARNE DUE, JONASSEN,THOMAS ENGELBRECHT NORKILD, NIELSEN,SØREN, FRØKIÆR,JØRGEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona melanotropa [MSH], p. ej. alfa o beta-melanotropina.
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- C07K14/685 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › alfa-melanotropina.
PDF original: ES-2407107_T3.pdf
Fragmento de la descripción:
Análogos de alfa-MSH terapéuticamente activos
Campo de la invención La invención se refiere a análogos peptídicos de la hormona estimulante de los melanocitos a (a-MSH) , que poseen una mayor eficacia en comparación con el péptido nativo a-MSH. Los análogos de a-MSH exhiben mayores efectos antiinflamatorios y mayor capacidad para tratar o prevenir daños en todo el organismo, un órgano o una célula asociados a isquemia o isquemia seguida de reperfusión vascular, en comparación con a-MSH.
Antecedentes El péptido nativo hormona estimulante de los melanocitos a (a-MSH) se conoce como el agonista nativo del receptor tipo 1, tipo 3, tipo 4 y tipo 5 de melanocortina (MC) . Los receptores de MC pertenecen a la clase de receptores acoplados a proteínas-G. Todos los subtipos de receptores están acoplados a una proteína G estimulante, lo que significa que la estimulación del receptor implica aumento de la producción de AMPc. ACTH es el ligando nativo del receptor tipo 2 (MC2) .
Se realizó una serie de estudios sobre los receptores de MC en diversos tejidos. El receptor tipo 1 (MC1) , al cual se une a-MSH con gran afinidad, se sabe que se expresa en varios tejidos y células como cerebro incluidos astrocitos, testículo, ovario, macrófagos y neutrófilos. Es probable, sin embargo, que MC1 se exprese en una gama aún más amplia de tejidos aunque esto está por establecerse. La selectividad de los receptores de MC por unirse a diferentes péptidos MSH varía. MC1 se une con gran afinidad a a-MSH y con menor afinidad también a º-MSH, y-MSH y ACTH. Se ha informado que MC2 sólo se une a ACTH, pero no a ninguno de los péptidos MSH. La mayor afinidad por los ligandos de los otros receptores incluyen y-MSH (receptor MC3) y º-MSH (receptor MC4) . Por el contrario, MC5 se une con mucha menor afinidad a los péptidos MSH con el mismo patrón que MC1 (es decir, mayor afinidad por a-MSH) .
Los péptidos MSH actuando a través de la estimulación de los receptores de MC tienen una diversidad de funciones que incluyen inmunomodulación, antiinflamación, regulación de la temperatura corporal, percepción del dolor, síntesis de aldosterona, regulación de la presión arterial, frecuencia cardiaca, tono vascular, flujo sanguíneo cerebral, crecimiento del nervio, desarrollo de la placenta, síntesis/liberación de diversas hormonas como aldosterona, tiroxina, prolactina y FSH. ACTH tiene un efecto importante sobre la estimulación de la esteroidoneogénesis. Asimismo a-MSH induce la formación de pigmento en la piel.
Es importante destacar que no está completamente establecido cuáles receptores están implicados en una serie de acciones de los péptidos MSH, especialmente de a-MSH. Se ha especulado que la acción antiinflamatoria de a-MSH involucra diversos procesos que incluyen interferencia sin producción, acción de endotelina-1, formación de interleucina 10, la cual nuevamente se une a receptores MC1 expresados en macrófagos y monocitos.
La estimulación del receptor MC con a-MSH ha demostrado ser importante en diversos procesos inflamatorios (Lipton y Catania, 1997) : 1) inhiben la migración quimiotáctica de los neutrófilos (Catania, 1996) . 2) a-MSH incluidos los análogos inhiben la liberación de citocinas (IL-1, TNF-a) en respuesta al tratamiento con LPS (Goninard 1996) . 3) Inhiben a TNF-a en respuesta a una endotoxina bacteriana (Wong, K.Y. et al., 1997) . 4) La administración ICV o IP de a-MSH inhibe la producción de TNF-a por LPS administradas localmente. 5) Se ha demostrado que a-MSH reduce la inflamación en la enfermedad inflamatoria intestinal experimental (Rajora, N. et al., 1997) , y la insuficiencia renal aguda inducida por isquemia (Star, R.A. et al., 1995) . 6) a-MSH también tiene algún efecto protector al inhibir la inducción y el desencadenamiento de la hipersensibilidad de contacto e induce tolerancia al hapteno, y se especula que a-MSH puede mediar en una importante regulación negativa de la inflamación cutánea y enfermedades cutáneas hiperproliferativas (Luger, T.A., 1997) . Con este fin, a-MSH causa una mayor liberación de IL-8 desde las células endoteliales de la microvasculatura dérmica (Hartmeyer, M., 1997) .
Tanto las lesiones por hipoxia (isquemia) como las lesiones por reperfusión son factores importantes en la fisiopatología humana. Los ejemplos de hipoxia tisular que predisponen a lesión durante la reperfusión incluyen choque circulatorio, isquemia de miocardio, accidente cerebrovascular, isquemia renal temporal, cirugía mayor y trasplante de órganos. Como las enfermedades debidas a isquemia son causas sumamente comunes de morbimortalidad y debido a que el trasplante de órganos es cada vez más frecuente, son muy necesarias estrategias de tratamiento con potencial para limitar las lesiones de reperfusión para mejorar la salud pública. La fisiopatología subyacente de las lesiones de isquemia-reperfusión es compleja e implica no sólo una respuesta de reperfusión inflamatoria clásica con infiltración de neutrófilos, sino también la expresión de genes de citocinas como el factor de necrosis tumoral-a (TNF-a) , las interleucinas (IL) -1º, IL-6, IL-8, el interferón-y y la molécula de adhesión intercelular 1 (ICAM-1) en el órgano o tejido de reperfusión. Además, se ha sugerido que el TNF-a producido localmente contribuye a la disfunción postisquémica del órgano como en el corazón postinfarto por depresión directa de la contractilidad e inducción de apoptosis. Debido a la naturaleza compleja de las lesiones de isquemia y/o reperfusión los conceptos de tratamiento antiinflamatorio simples han demostrado ser ineficaces: por lo tanto, la mayoría de los estudios experimentales apuntan al hecho de que es necesaria la interacción concomitante con más de una de las vías activadas para proteger contra lesiones por reperfusión. Se ha demostrado que a-MSH tiene habilidades antiinflamatorias, antioxidantes y antiapoptóticas, lo cual proporciona una buena explicación de la eficacia de este compuesto para proteger contra lesiones de reperfusión.
Se sabe que ciertas modificaciones de los residuos de aminoácidos en la secuencia de aminoácidos de a-MSH produce una mayor afinidad por el receptor (por ejemplo el receptor MC4) , una actividad biológica prolongada o un perfil de unión del péptido al receptor más específico (Schiöth et al. 1998, Hruby et al. 1995, Sawyer et al. 1980, Hiltz et al. 1991, Scardenings et al. 2000) . Sin embargo, al apuntar hacia la generación de fármacos peptídicos, estos péptidos siguen teniendo problemas con la baja estabilidad frente a la degradación enzimática.
WO0190140 da a conocer derivados de melanocortinas incluida a-MSH que se vuelven resistentes a la degradación in vivo. Esta resistencia se obtiene reemplazando la fenilalanina de la secuencia central de a-MSH -Glu-His-Phe-Arg-Trp- con un aminoácido D, además, reemplazando la arginina y el aminoácido siguiente con bloques de construcción de aminoácidos N-sustituidos.
Como se indicó antes, el problema en el desarrollo de fármacos peptídicos terapéuticamente activos es que los péptidos son degradados rápida y muy eficazmente por las enzimas, generalmente con semividas en el rango de minutos. Las proteasas y otras enzimas proteolíticas son ubicuas, especialmente en el tubo digestivo, y por lo tanto los péptidos son generalmente susceptibles de degradación en varios sitios luego de la administración oral y en alguna medida en la sangre, el hígado, el riñón y el endotelio vascular. Además, un péptido dado es generalmente susceptible de degradación en más de una unión dentro del esqueleto; cada locus de hidrólisis es mediado por una cierta proteasa. Incluso si se superan dichos obstáculos, para los neuropéptidos en particular, se han encontrado dificultades en su transporte a través de la barrera hematoencefálica.
Con el fin de aumentar la estabilidad metabólica de los péptidos, Larsen et al., 1999 (WO 99/46283) desarrollaron una tecnología denominada SIP (sonda de inducción estructural) . La tecnología SIP se basa en el uso sondas que inducen estructura, que son representadas por secuencias peptídicas cortas, por ejemplo, (Lys) 6 añadidas al extremo C-terminal o al N-terminal o a ambos extremos C y N-terminales del péptido original. La sonda que induce estructura constriñe al péptido original en una conformación más ordenada basada en enlaces de hidrógeno intramoleculares, mediante lo cual el péptido quimera (péptido unido a la sonda) es menos susceptible a las proteasas en contraste con los péptidos con la conformación de bobina aleatoria. Como resultado de la estructuración, es mucho más difícil que una proteasa degrade al péptido quimera. La adición de una SIP a un péptido biológicamente activo generalmente... [Seguir leyendo]
Reivindicaciones:
1. Un péptido que consiste en la secuencia:
Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 1) , donde el extremo amino terminal de dicho péptido es CH3-C (=O) -.
2. Un péptido que consiste en la secuencia:
Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 2) , donde el extremo amino terminal de dicho péptido es CH3-C (=O) -.
3. El péptido de acuerdo con la reivindicación 1 o 2, donde el extremo carboxi terminal de dicho péptido es -C (=O) -OH.
4. El péptido de acuerdo con la reivindicación 1 o 2, donde el extremo carboxi terminal de dicho péptido es -C (=O) -NH2.
5. Un péptido seleccionado del grupo que consiste en:
Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 3) , Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 4) , ºLys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His- (D-Phe) -Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 5) , Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Nle-Glu-His- (D-Phe) -Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 6) , Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His- (D-Phe) -Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 7) , Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Nle-Glu-His- (D-Phe) -Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 8) , Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His-D-Nal-Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 9) , Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Nle-Glu-His-D-Nal-Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 10) , Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His-D-Nal-Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 11) , Glu-Glu-Glu-Glu-Glu-Glu-Ser-Tyr-Ser-Nle-Glu-His-D-Nal-Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 12) ,
donde el extremo amino terminal de dicho péptido es (B4) HN-, (B4) (B5) N-, o (B6) HN-, donde B4 y B5 se seleccionan independientemente entre H, C1-6 alquilo, C2-6 alquenilo, C6-10 arilo, C7-16 aralquilo, y C7-16 alquilarilo; B6 es B4-C (=O) ; y donde el extremo carboxi terminal de dicho péptido es -C (=O) -B1, en el que B1 se selecciona entre OH, NH2, NHB2, N (B2) (B3) , OB2 y B2, donde B2 y B3 se seleccionan independientemente entre C1-6 alquilo, C2-6 alquenilo, C6-10 arilo, C7-16 aralquilo y C7-16 alquilarilo.
6. El péptido de acuerdo con la reivindicación 5, donde dicho péptido consiste en la secuencia: Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro- (D-Val) (SEC. ID Nº: 3) .
7. El péptido de acuerdo con la reivindicación 5, donde dicho péptido consiste en la secuencia: Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His- (D-Phe) -Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 5) .
8. El péptido de acuerdo con la reivindicación 5, donde dicho péptido consiste en la secuencia: Lys-Lys-Lys-Lys-Lys-Lys-Ser-Tyr-Ser-Nle-Glu-His- (D-Nal) -Arg-Trp-Gly-Lys-Pro-Val (SEC. ID Nº: 9) .
9. El péptido de acuerdo con cualquiera de las reivindicaciones 5-8, donde el extremo amino terminal de dicho péptido (B4) HN-, en el que B4 es H.
10. El péptido de acuerdo con cualquiera de las reivindicaciones 5-8, donde el extremo amino terminal de dicho péptido es (B6) HN-, en el que B6 es B4-C (=O) - y donde B4 es C1-6 alquilo.
11. El péptido de acuerdo con la reivindicación 10, donde B4 es C1alquilo.
12. El péptido de acuerdo con cualquiera de las reivindicaciones 5-11, donde el extremo carboxi terminal de dicho péptido es -C (=O) -B1, en el que B1 es OH.
13. El péptido de acuerdo con cualquiera de las reivindicaciones 5-11, donde el extremo carboxi terminal de dicho péptido es -C (=O) -B1, en el que B1 es NH2.
14. El péptido de acuerdo con cualquiera de las reivindicaciones anteriores, donde el péptido tiene la capacidad de estimular uno o más receptores de melanocortina seleccionados entre los receptores de melanocortina tipo 1, 3, 4 y
5.
15. El péptido de acuerdo con cualquiera de las reivindicaciones anteriores, donde el péptido tiene al menos una de las propiedades siguientes:
a) inhibe la producción de TNF-a por los leucocitos humanos inducida por LPS b) inhibe la infiltración de eosinófilos en los pulmones inducida por inflamación c) inhibe la infiltración de neutrófilos en los pulmones inducida por inflamación d) inhibe la acumulación de TNF-a en la sangre circulante inducida por inflamación, e) reduce la insuficiencia renal aguda inducida por isquemia, f) reduce el tamaño del infarto de miocardio, g) reduce el grado de insuficiencia cardíaca postinfarto de miocardio, h) reduce la hipertensión vascular pulmonar, i) reduce la insuficiencia renal inducida por cisplatino.
16. Un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para usar en medicina.
17. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada al tratamiento o la profilaxis de la isquemia miocárdica.
18. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15, para la fabricación de una composición farmacéutica destinada al tratamiento o la profilaxis de la angina o el infarto de miocardio.
19. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15, para la fabricación de una composición farmacéutica destinada al tratamiento o la profilaxis de una afección inflamatoria seleccionado del grupo que consiste en inflamación pulmonar, artritis, dermatitis, pancreatitis, enfermedades inflamatorias intestinales, vasculitis, septicemia bacteriana, pericarditis, miocarditis y endocarditis.
20. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada a reducir la hipertensión vascular pulmonar.
21. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada a reducir la insuficiencia renal aguda inducida por isquemia.
22. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada a reducir el tamaño del infarto de miocardio inducido por isquemia.
23. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada a reducir el grado de insuficiencia cardíaca postinfarto de miocardio.
24. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada al tratamiento de la isquemia causada por una intervención quirúrgica.
25. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada al tratamiento de la isquemia causada por un trasplante de órgano.
26. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada al tratamiento de la isquemia causada por inserción quirúrgica de trasplantes, dispositivos, injertos o prótesis.
27. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-15 para la fabricación de una composición farmacéutica destinada al tratamiento de la isquemia causada por choque séptico.
28. El uso de un péptido de acuerdo con la reivindicación 19 para la fabricación de una composición farmacéutica destinada al tratamiento de la enfermedad inflamatoria intestinal.
29. El uso de un péptido de acuerdo con la reivindicación 19 para la fabricación de una composición farmacéutica destinada al tratamiento de artritis seleccionada del grupo que consiste en artritis reumatoidea, artrosis y artritis reactiva.
30. Una composición farmacéutica que comprende un péptido como el definido en cualquiera de las reivindicaciones 1-15.
31. La composición farmacéutica de acuerdo con la reivindicación 30 que comprende además uno o más vehículos farmacéuticos.
32. La composición farmacéutica de acuerdo con las reivindicaciones 30 o 31 que comprende además uno o más excipientes farmacéuticamente aceptables.
33. La composición farmacéutica de acuerdo con cualquiera de las reivindicacione.
3. 32, donde la composición es una composición parental, oral, tópica, transmucosa o transdérmica.
Patentes similares o relacionadas:
Compuesto farmacéutico, del 25 de Diciembre de 2019, de VALLAURIX PTE. LTD: (C2H5)3 N - CH2 - CO - Nle - Glu - His - D-Phe - Arg - Trp - NH2 o una sal farmacéuticamente aceptable del mismo.
Compuesto farmacéutico, del 6 de Noviembre de 2019, de VALLAURIX PTE. LTD: Compuesto con estructura de fórmula Ac - Nle - Glu - His- D-Phe -X - Trp - NH2, en la que X es homoArg o norArg, o una sal farmacéuticamente aceptable del […]
Análogos de alfa-MSH terapéuticamente activos, del 25 de Febrero de 2019, de AbbVie Inc: Un péptido que asciende a un total de 19 residuos de aminoácidos, donde el péptido se selecciona del grupo que consiste en: Lys-Lys-Lys-Lys-Lys-Lys-Ser-Ser-Ile-Ile-Ser-His-Phe-Arg-Trp-Gly-Lys-Pro-Val […]
Terapia para el vitíligo, del 13 de Diciembre de 2017, de Clinuvel Pharmaceuticals Limited: Composición farmacéutica que comprende un análogo de alfa-MSH el cual es un derivado de alfa-MSH que exhibe actividad agonista para el receptor de melanocortina-1 […]
Terapia para el vitíligo, del 22 de Julio de 2015, de Clinuvel Pharmaceuticals Limited: Composición farmacéutica que comprende un análogo de alfa-MSH seleccionado del grupo que consiste de: [Nle4, D-Phe7]-alfa MSH [Nle4, D-Phe7]-alfa […]
Análogos de MSH-alfa y MSH-gamma, del 4 de Marzo de 2015, de TXP Pharma GmbH: Péptido que consiste en de 14 a 16 restos aminoacídicos, en donde dicho péptido es un análogo de MSHα o de MSHα que tiene la secuencia aminoacídica: X […]
Conjugados tripeptídicos agonistas de la MSH, del 12 de Marzo de 2014, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS): Conjugado tripeptídico de fórmula: a) 5 A-His-DPhe-Arg-NH2, o b) A-His-DPhe-Trp-NH2, en la que A representa el radical que corresponde […]
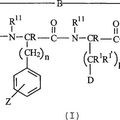 LIGANDOS DEL RECEPTOR DE MELANOCORTINA, del 16 de Octubre de 2008, de THE PROCTER & GAMBLE COMPANY: Ligandos del receptor de melanocortina. Se refiere a nuevos ligandos del receptor de melanocortina. Estos ligandos son análogos peptídicos cíclicos que preferiblemente […]
LIGANDOS DEL RECEPTOR DE MELANOCORTINA, del 16 de Octubre de 2008, de THE PROCTER & GAMBLE COMPANY: Ligandos del receptor de melanocortina. Se refiere a nuevos ligandos del receptor de melanocortina. Estos ligandos son análogos peptídicos cíclicos que preferiblemente […]