AGENTES DE CONTRASTE PARA IRM DOTADOS DE CAPACIDAD DE RESPUESTA INDEPENDIENTE DE LA CONCENTRACIÓN.
Método para la determinación in vivo, mediante el uso de la técnica de IRM,
de parámetro físico o químico de interés diagnóstico en un órgano, fluido o tejido del cuerpo de ser humano o animal, comprendiendo el método: - administrar a dicho ser humano o animal una cantidad eficaz desde el punto de vista de diagnóstico de un agente paramagnético de rotación lenta que responde a cambios del microentorno de dicho parámetro mediante cambios en la razón R2p/R1p, que se selecciona de - un complejo metálico paramagnético macromolecular dotado de al menos una molécula de agua lábil coordinada con el centro metálico y que tiene un valor de R de desde 1 hasta 10 ns y un valor de M de desde 0,01 hasta 1 μs, y - un sistema de tamaño nanométrico que atrapa un complejo metálico paramagnético a una concentración mínima de 5 mM, y que tiene un diámetro medio ≥ 5 nm, y - registrar una obtención de imágenes de IRM que responde a dicho parámetro mediante la medición de la razón R2p/R1p
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/004023.
Solicitante: BRACCO IMAGING S.P.A..
Nacionalidad solicitante: Italia.
Dirección: VIA EGIDIO FOLLI 50 20134 MILANO ITALIA.
Inventor/es: AIME,SILVIO, TERRENO,Enzo.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Abril de 2006.
Clasificación Internacional de Patentes:
- A61K49/08Z
- A61K49/10 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 49/00 Preparaciones para examen in vivo. › compuestos orgánicos.
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357624_T3.pdf


Fragmento de la descripción:
La presente invención se refiere al campo de la obtención de imágenes de diagnóstico mediante el uso de técnicas de obtención de imágenes por resonancia magnética (IRM). Más en particular, se refiere a un nuevo uso de una clase de agentes de contraste paramagnéticos en un método para la determinación in vivo de parámetros físicos o químicos de interés diagnóstico, independientemente de la concentración local del agente de contraste administrado.
ANTECEDENTES DE LA INVENCIÓN
En la actualidad está bien establecido que el potencial de los procedimientos de obtención de imágenes por resonancia magnética (IRM) puede aumentarse adicionalmente cuando esta modalidad de diagnóstico se aplica junto con la administración de agentes de contraste (AC), es decir, productos químicos que pueden promover cambios marcados en las tasas de relajación de los protones tisulares. Los AC para IRM se representan principalmente por complejos paramagnéticos, que contienen sobre todo iones de Gd(III), Fe(III) o Mn(II), que afectan a las tasas de relajación del agua en masa a través del intercambio de moléculas de agua en sus esferas de coordinación (Caravan P, et al. Chem Rev 1999, 99:2293-2352; the Chemistry of Contrast Agents in Medical Magnetic Resonance Imaging. Chichester, RU: John Wiley & Sons; 2001. págs. 45-120).
La eficacia de un complejo paramagnético se evalúa mediante su aumento de la relajación protónica o relaxividad (ri, i = 1, 2), que representa el aumento de la tasa de relajación protónica de una disolución acuosa que contiene una concentración 1 mM del agente paramagnético en comparación con la tasa de relajación protónica del agua neta. Para un complejo paramagnético, el aumento de la relajación protónica está principalmente gobernado por la elección del metal paramagnético, el tiempo de correlación rotacional del complejo y la accesibilidad del metal a las moléculas de agua circundantes, es decir el intercambio rápido de agua con la masa.
Están implicadas dos tasas de relajación características: R1 que se define como la inversa del tiempo de relajación longitudinal o tiempo de relajación espín-red T1, es decir 1/T1, y R2 que se define como la inversa del tiempo de relajación transversal o tiempo de relajación espín-espín T2, es decir 1/T2.
Cuanto mayor sea la relaxividad longitudinal (r1), más grande es el aumento de la señal detectado en las imágenes por RM ponderadas en T1 correspondientes y mejor es la diferenciación de contraste en las imágenes resultantes.
Existen algunos agentes de contraste cuya relaxividad está relacionada con, y puede depender de, las características físicas o químicas del microentorno en el que se distribuyen. Estos agentes se conocen como agentes de respuesta porque el contraste, en la imagen que promueven, responde a un parámetro físico o químico de interés diagnóstico. Se han notificado varios sistemas cuya relaxividad se hace dependiente del pH, la temperatura, PO2, actividad enzimática, concentraciones de iones y metabolitos (Jacques V, Top Curr Chem 2002, 221, 123-164).
Sin embargo, una propiedad de sensibilidad peculiar de este tipo no podría haberse explotado en la práctica porque las variaciones de T1 detectadas no pueden atribuirse claramente a un cambio en la relaxividad y, por consiguiente, a una variación en el parámetro físico o químico que está examinándose, si no se conoce la concentración real del complejo paramagnético. Para que sea eficaz, un agente de respuesta para IRM debe presentar su capacidad de respuesta de un modo independiente de la concentración. Por consiguiente, un objetivo de la presente invención es un método de IRM y agentes que permitan superar esta desventaja.
SUMARIO DE LA INVENCIÓN
Según el objetivo anterior, la presente invención se refiere a la identificación de una clase de agentes de respuesta cuyo uso permite la medición de un parámetro físico o químico de interés diagnóstico independientemente de la concentración real del propio agente. En un aspecto diferente, la invención se refiere a un método de uso de dichos agentes para la determinación de un parámetro físico o químico de interés diagnóstico, independientemente de la concentración absoluta del agente administrado.
BREVE DESCRIPCIÓN DE LAS FIGURAS
La figura 1 se refiere a valores de R2p/R1p calculados como una función de la fuerza del campo magnético para un complejo de Gd(III) macromolecular (q = 1, r = 3 Ǻ, M = 200 ns) dotado de valores de R en el intervalo de 0,5-10 ns. Para la relajación electrónica, se han usado un valor de 2 de 2*1019 s-2 y un valor de V de 10 s (correspondiente a valores de 1S en el intervalo de 0,65-500 ns).
La figura 2a) se refiere a valores de R2p/R1p calculados como función de R para sistemas basados en Gd(III) dotados de valores de M en el intervalo de 0,05-1 s a 7 T.
La figura 2b) se refiere a valores de R2p/R1p calculados como función de M para sistemas basados en Gd(III) dotados de valores de R en el intervalo de 0,5-10 ns a 7 T.
La figura 3 muestra la estructura del aducto (Gd-1)4/avidina.
La figura 4 muestra la dependencia de la temperatura de la razón R2p/R1p para el aducto (Gd1)4/avidina a 7 T. Se incluye la fórmula del complejo Gd-1 en la sección experimental. Las barras notificadas hacen referencia a la desviación estándar de tres mediciones de disoluciones que contienen 0,125, 0,25, y 0,5 mM del complejo paramagnético.
La figura 5 notifica la dependencia del pH de la razón R2p/R1p para el aducto GdDOTP/poliarginina (razón molar = 10) a 14,1 T y 312 K. La concentración del complejo de Gd(III) fue de 0,5 mM (cuadrados negros) y 0,25 mM (cuadrados blancos).
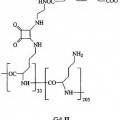
La figura 6 muestra la estructura del aducto macromolecular de Gd-II.
La figura 7 notifica la dependencia del campo magnético de R1p (símbolos negros) y R2p (símbolos blancos) medidos a 25ºC y 600 MHz para una disolución que contiene el aducto de Gd-II ([Gd] = 1 mM). pH 7 (cuadrados), pH 10 (círculos), y pH 12 (triángulos).
La figura 8 notifica la dependencia de la razón R2p/R1p sobre la concentración de Gd(III) para el aducto macromolecular de Gd-II a cuatro valores de pH: pH 7 (cuadrados), pH 8,5 (círculos), pH 10 (triángulos), y pH 12 (rombos) (600 MHz, 25ºC).
La figura 9 muestra la dependencia del pH correspondiente de la razón R2p/R1p calculada a partir del punto de datos notificado en la figura 8.
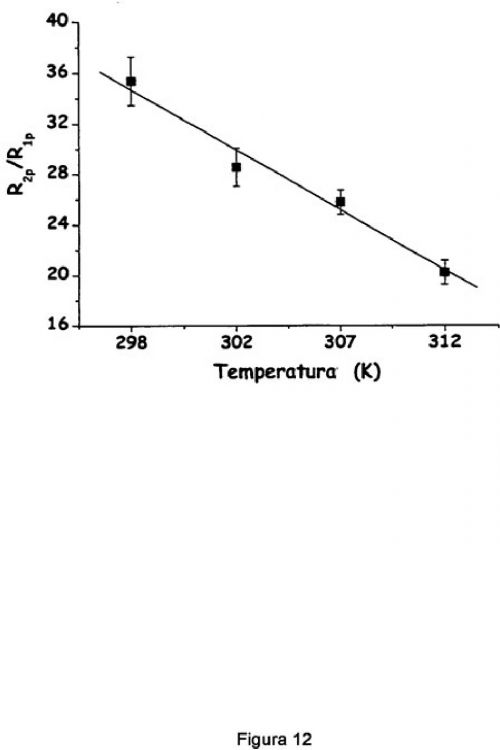
La figura 10 notifica la dependencia de la temperatura de R1p (círculos) y R2p (cuadrados) medidos a 300 MHz para una disolución que contiene liposomas paramagnéticos (POPC/Chol/DSPEPEG, razón molar 55:40:5) que atrapa GdHPDO3A 200 mM. La concentración total del complejo de Gd(III) en la suspensión fue de 6,6 mM.
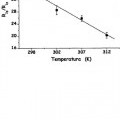
La figura 11 muestra la dependencia de la razón R2p/R1p sobre la concentración de liposomas (parte inferior del eje X) y Gd(III) (parte superior del eje X) para los liposomas paramagnéticos descritos en el ejemplo 4. Temperaturas: 298 K (cuadrados), 302 K (círculos), 307 K (triángulos superiores), y 312 K (rombos) (300 MHz).
DESCRIPCIÓN DE LA INVENCIÓN
Una clase de agentes de contraste que resuelve el problema al que se enfrenta la presente invención está representado por sistemas paramagnéticos de respuesta que responden a un parámetro físico o químico de interés diagnóstico en cuanto a que afectan a T1 y T2 de los protones de agua del disolvente, y en los que tal capacidad de respuesta de T1 y T2 a dicho parámetro sigue diferentes funciones de comportamiento. Para estos sistemas de respuesta, puede hacerse que la razón R2p/R1p sea independiente de la concentración real del propio agente mediante el mantenimiento de la dependencia funcional del mismo con respecto al parámetro de interés. Por consiguiente, mediante el uso de estos sistemas, puede obtenerse una determinación del parámetro de interés como independiente de la concentración del agente real mediante la medición de tal razón R2p/R1p.
En la presente invención, a menos que se indique lo contrario, con parámetro físico o químico de interés diagnóstico quiere decirse un parámetro seleccionado de: temperatura, pH, presión parcial de oxígeno (PO2) o dióxido de carbono (PCO2), concentración de ión o metabolito específico, o actividad enzimática específica.
Conociendo el valor de dicho(s) parámetro(s)... [Seguir leyendo]
Reivindicaciones:
1. Método para la determinación in vivo, mediante el uso de la técnica de IRM, de parámetro físico
o químico de interés diagnóstico en un órgano, fluido o tejido del cuerpo de ser humano o animal, comprendiendo el método:
- administrar a dicho ser humano o animal una cantidad eficaz desde el punto de vista de diagnóstico de un agente paramagnético de rotación lenta que responde a cambios del microentorno de dicho parámetro mediante cambios en la razón R2p/R1p, que se selecciona de
- un complejo metálico paramagnético macromolecular dotado de al menos una molécula de agua lábil coordinada con el centro metálico y que tiene un valor de ºR de desde 1 hasta 10 ns y un valor de ºM de desde 0,01 hasta 1 s, y
- un sistema de tamaño nanométrico que atrapa un complejo metálico paramagnético a una concentración mínima de 5 mM, y que tiene un diámetro medio 5 nm, y
- registrar una obtención de imágenes de IRM que responde a dicho parámetro mediante la medición de la razón R2p/R1p.
2. Método según la reivindicación 1, en el que la razón R2p/R1p medida actúa como indicador de un cambio en el parámetro de interés.
3. Método según la reivindicación 1, en el que el metal del complejo o agente paramagnético es un lantánido o un ión de metal de transición.
4. Método según la reivindicación 3, en el que el ión metálico se selecciona de Fe(2+), Fe(3+), Cu(2+), Cr(3+), Eu(3+), Dy(3+), La(3+), Yb(3+) o Mn(2+) y Gd(3+).
5. Método según la reivindicación 4, en el que el ión metálico es Gd(3+).
6. Método según la reivindicación 1, en el que el complejo metálico paramagnético macromolecular es el aducto (Gd-1)4/avidina, o el aducto Gd-DOTP/poliarginina, o el aducto macromolecular de Gd-II.
7. Método según la reivindicación 1, en el que el sistema paramagnético de tamaño nanométrico es una nanopartícula, una microemulsión, un liposoma o una cavidad proteica.
8. Método según la reivindicación 1, en el que el sistema paramagnético de tamaño nanométrico es un liposoma que atrapa Gd-HPDO3A.
9. Método según una cualquiera de las reivindicaciones 1 a 8, en el que el parámetro físico o químico de interés diagnóstico se selecciona de temperatura, pH, presión parcial de oxígeno o dióxido de carbono, concentración de ión o metabolito específico, actividad enzimática específica.
10. Uso de un agente paramagnético de rotación lenta que responde a un parámetro físico o químico dado de interés diagnóstico mediante cambios en la razón R2p/R1p y seleccionado de un complejo metálico paramagnético macromolecular dotado de al menos una molécula de agua lábil coordinada con el centro metálico y que tiene un R de desde 1 hasta 10 ns y un valor de M de desde 0,01 hasta 1 s, y un sistema de tamaño nanométrico que atrapa un complejo metálico paramagnético, a una concentración mínima de 5 mM, y que tiene un diámetro medio 5 nm, para la preparación de una composición de diagnóstico para su uso en la determinación de dicho parámetro en un órgano, fluido o tejido del cuerpo de ser humano o animal, mediante el uso de IRM, de una manera que es independiente de la concentración absoluta de dicho agente administrado.
11. Compuesto seleccionado de los siguientes:
- el aducto (Gd-1)4/avidina, en el que Gd-1 tiene la siguiente estructura
**(Ver fórmula)**
- el aducto macromolecular de Gd-II.
12. Compuestos según la reivindicación 11 para su uso como agentes de contraste.
Patentes similares o relacionadas:
Compuestos de quelato de gadolinio con alta relaxividad para usar en la obtención de imágenes por resonancia magnética, del 17 de Junio de 2020, de Bayer Pharma Aktiengesellschaft: Un compuesto de formula general (I), **(Ver fórmula)** en la cual: R1 representa, independientemente uno de otro, un átomo de hidrógeno o […]
Compuestos quelatos de manganeso basados en macrociclo de tetraazabiciclo adecuados como agentes de imagen de IRM, del 3 de Junio de 2020, de GE HEALTHCARE AS: Un compuesto de Fórmula I o una sal o solvato del mismo: **(Ver fórmula)** donde: X es O o S; Y es O, S o Q-R3 donde Q es N o CH y R3 se selecciona del […]
Método para producir la forma cristalina de modificación a de calcobutrol, del 27 de Mayo de 2020, de Bayer Pharma Aktiengesellschaft: Compuesto de la fórmula (I) en forma cristalina de la modificación A **(Ver fórmula)** caracterizado porque el diagrama de difracción de rayos X en polvo del […]
Nanopartículas ultrafinas como agente de contraste multimodal, del 1 de Abril de 2020, de UNIVERSITE CLAUDE BERNARD-LYON I: Nanopartículas para su uso como agente terapéutico para el tratamiento de tumores de pulmón, dichas nanopartículas estando caracterizadas por que […]
Orientación de corroles para toxicidad tumoral e IRM, del 25 de Marzo de 2020, de CEDARS-SINAI MEDICAL CENTER: Una composición farmacéutica para su uso en el tratamiento del cáncer, que comprende una nanopartícula dirigida que comprende una proteína de direccionamiento y un […]
Polímero biocompatible y nanopartícula magnética con biocompatibilidad, del 18 de Marzo de 2020, de MegaPro Biomedical Co., Ltd: Un polimero biocompatible de formula (I), **(Ver fórmula)** en la cual R1 es alquilo de C1-C20 de cadena lineal o ramificada; R2 es alquilo de C1-C20 de cadena […]
Preparación de gadobutrol de alta pureza, del 19 de Febrero de 2020, de Bayer Intellectual Property GmbH: Procedimiento para producir gadobutrol de alta pureza (= el complejo con gadolinio de N-(1-hidroximetil-2,3- dihidroxipropil)-1,4,7-triscarboximetil-1,4,7,10-tetraazaciclododecano), […]
Composiciones, métodos y sistemas para la síntesis y uso de agentes de formación de imágenes, del 2 de Octubre de 2019, de LANTHEUS MEDICAL IMAGING, INC: Una composición que comprende un compuesto que comprende la Fórmula (II): **Fórmula** o una sal, base libre, o combinación de las mismas, en donde: R1 es alquilo, […]