Agente destinado a ser utilizado para una inyección que comprende antibiótico, y solución para inyección que comprende el agente.
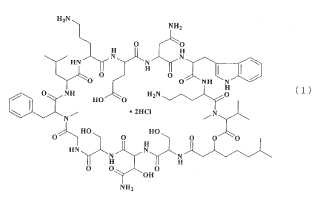
Formulación inyectable para la preparación al momento que comprende el antibiótico WAP-8294A2 con la fórmula estructural (1) siguiente:
como principio activo y que comprende además una ciclodextrina seleccionada de entre el grupo constituido por 2hidroxipropil--ciclodextrina y -ciclodextrina, en un medio acuoso adecuado para la inyección, encontrándose dicha formulación en forma de una solución acuosa concentrada estable sin ajuste del pH.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2007/063003.
Solicitante: ARIGEN PHARMACEUTICALS, INC.
Nacionalidad solicitante: Japón.
Dirección: PLACE CANADA 3F 3-37, AKASAKA 7-CHOME MINATO-KU TOKYO 107-0052 JAPON.
Inventor/es: MACHIDA, HARUHIKO, NAKAJIMA,Hirofumi.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K47/04 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › No-metales; Sus compuestos.
- A61K47/26 A61K 47/00 […] › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/40 A61K 47/00 […] › Ciclodextrinas; Sus derivados.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
PDF original: ES-2378279_T3.pdf
Fragmento de la descripción:
Agente destinado a ser utilizado para una inyección que comprende antibiótico, y solución para inyección que comprende el agente.
Campo técnico La presente invención se refiere a una formulación inyectable de preparación al momento de un antibiótico depsipéptido, el WAP-8294A, que presenta una notable actividad antibacteriana contra el Staphylococcus aureus resistente a meticilina (SARM) , a una solución para la administración intravenosa de la misma y a los métodos para su preparación.
Antecedentes de la técnica El SARM es un Staphylococcus aureus resistente a los fármacos contra el que los antibióticos, incluida la meticilina, se han mostrado ineficaces. La aparición del SARM se documentó por primera vez en Inglaterra en 1961 y a partir de ese momento el SARM se extendió rápidamente por todo el mundo. Actualmente, el SARM constituye el 50-70% de los Staphylococcus aureus aislados en dependencias sanitarias y está muy extendido en los hospitales. El personal de atención sanitaria y los pacientes pueden resultar fácilmente infectados por SARM por contacto dentro de las dependencias sanitarias. Generalmente, las personas sanas no pasan de convertirse en portadoras cuando resultan infectadas por SARM, ya que SARM es una variante de Staphylococcus aureus y tiene una patogenicidad baja. Sin embargo, cuando las personas de edad avanzada con una inmunidad disminuida, los pacientes inmunodeficientes, los pacientes posoperatorios o los pacientes a los que se ha colocado un catéter de intubación en la tráquea o en un vaso sanguíneo resultan infectados por SARM, éste prolifera dentro del organismo y provoca diversas enfermedades infecciosas como neumonía, enteritis, septicemia, endocarditis o meningitis. En el mundo occidental y en Japón, donde la atención sanitaria está muy desarrollada, la infección por SARM se considera una de las más graves entre las que se producen en las dependencias sanitarias y la misma exige diversas medidas para su prevención.
Dado que no se aprecian diferencias en los síntomas y la evolución entre las infecciones por SARM y otras infecciones bacterianas, las infecciones por SARM son muy difíciles de distinguir mediante los datos clínicos generales y las pruebas de laboratorio. El diagnóstico se confirma mediante la identificación del SARM a través de un examen microbiológico. Para el tratamiento de las infecciones por SARM, resulta eficaz la administración de agentes antibacterianos junto con tratamiento sintomático. Sin embargo, se hace necesario utilizar agentes antibacterianos especiales como la vancomicina y la teicoplanina, que son eficaces contra el SARM, porque el SARM es resistente a los agentes antibacterianos comunes. Cuando se utilizan estos agentes, la dosis y el período de administración deben limitarse al mínimo necesario a fin de evitar la aparición de nuevas cepas resistentes. Actualmente, los agentes antibacterianos utilizados en las infecciones por SARM requieren un período terapéutico bastante prolongado hasta mostrar el efecto deseado y, por consiguiente, no se puede esperar una rápida recuperación de los pacientes.
En contraste con la situación descrita anteriormente, se ha desarrollado un antibiótico depsipéptido denominado WAP-8294A2 que constituye un prometedor agente antibacteriano (documento de patente 1) . Dicho WAP-8294A2 tiene un espectro antibacteriano relativamente estrecho y presenta una actividad antimicrobiana significativamente intensa contra el SARM, pudiéndolo eliminar en un período breve en términos de actividad bactericida. Por consiguiente, el WAP-8294A2 se considera eficaz especialmente contra la exacerbación aguda de las infecciones por SARM gracias a su intensa acción antibacteriana y se espera que se convierta en un agente terapéutico capaz de contribuir a una rápida recuperación de los pacientes que entran en estado crítico debido a infecciones por SARM.
Documento de patente 1: patente japonesa 3339235
Por otro lado, el documento US nº 5.648.455 da a conocer la preparación de una formulación inyectable de WAP8294A2.
Además, el documento US2005/0239692A1 da a conocer una preparación farmacéutica acuosa de oligopéptidos que comprende un oligopéptido de cinco aminoácidos y una betaciclodextrina parcialmente eterificada.
Descripción de la invención PROBLEMA QUE PRETENDE RESOLVER LA INVENCIÓN
Tal como se ha mencionado anteriormente, se propone un antibiótico depsipéptido, el WAP-8294A2, como agente terapéutico contra las infecciones por SARM, que constituyen un grave problema en los hospitales. Aunque dicho agente tiene una fuerte actividad antibacteriana, presenta el inconveniente de que resulta difícil preparar una formulación inyectable y una solución para su administración intravenosa que sean estables a las concentraciones
elevadas que resultan adecuadas para su uso práctico, lo que ha hecho imposible su realización práctica.
El objetivo de la presente invención consiste en proporcionar una formulación inyectable para su preparación al momento y una solución para la administración de WAP-8294A2 que sean estables a concentraciones elevadas. La posibilidad de preparar una formulación inyectable práctica de este antibiótico resultaría muy útil para el tratamiento de las infecciones por SARM, para las cuales existen quimioterapias limitadas.
Medios para resolver el problema El WAP-8294A2 es un antibiótico depsipéptido que presenta la fórmula estructural (I) indicada a continuación. Ejerce una fuerte acción antibacteriana sobre el SARM. El WAP-8294A2 se obtiene en forma de clorhidrato y su solución es fuertemente ácida. La estabilidad de una solución acuosa de WAP-8294A2 depende del pH y la concentración. Es estable en condiciones ácidas, con un pH bajo. Sin embargo, a un pH neutro es viscosa y tiende a gelificarse, y su estabilidad disminuye con el aumento de la concentración. Además, cuando se encuentran iones en una solución acuosa, tal como iones de sodio, ésta tiende a gelificarse incluso a un pH bajo y a formar precipitados a pH neutro.
Se han aplicado estrategias farmacéuticas con el fin de obtener una solución inyectable práctica de WAP-8294A2 con las características físicas y químicas mencionadas anteriormente, pero ha sido difícil preparar una solución inyectable estable de WAP-8294A2 de concentración elevada. Cuando se prepara por un método convencional, una solución inyectable de WAP-8294A2 es una solución acuosa con una concentración baja. La solución es estable, pero, debido al aumento de la cantidad necesaria de solución para su administración, las molestias para los pacientes son notables cuando la solución se inyecta. Además, la solución es inestable a medida que cambia su pH. Incluso si se ajusta el pH antes de la administración, la solución debe utilizarse rápido, como mucho al cabo de 2-3 horas tras dicho ajuste, debido a su inestabilidad. Además, el método convencional tiene el inconveniente de que se pueden formar microprecipitados en la solución a un pH próximo al neutro y, por consiguiente, resulta esencial utilizar un filtro para evitar que dichos precipitados penetren en los vasos sanguíneos. Además, tras la administración intravenosa puede existir el peligro de que la interacción con los iones de sodio y/o las proteínas séricas de la sangre dé lugar a una agregación molecular y provoque alteraciones hematológicas.
En el contexto de la presente invención se ha investigado la estabilidad de una solución de WAP-8294A2. Tal como se describe a continuación, se ha descubierto que, entre los solubilizantes para uso inyectable, son particularmente superiores para la estabilización del WAP-8294A2 una solución de 2-hidroxipropil-º-ciclodextrina y una solución de ºciclodextrina. Otros estudios han puesto de manifiesto que se puede obtener una solución inyectable estable de WAP-8294A2 con una concentración elevada utilizando estos solubilizantes o estabilizantes y sin ajustar el pH, a diferencia de los métodos convencionales, a fin de obtener una formulación inyectable para su preparación al momento.
También se ha puesto de manifiesto que, cuando se obtiene una solución para su administración mediante dilución y ajuste del pH utilizando esta formulación, la solución se puede preparar en una concentración elevada y con un pequeño volumen, y es más estable que una solución preparada por un método convencional. Además, la presente solución inyectable muestra notables efectos terapéuticos contra la infección por SARM sin provocar alteraciones hematológicas después de la administración,... [Seguir leyendo]
Reivindicaciones:
1. Formulación inyectable para la preparación al momento que comprende el antibiótico WAP-8294A2 con la fórmula estructural (1) siguiente:
como principio activo y que comprende además una ciclodextrina seleccionada de entre el grupo constituido por 2hidroxipropil--ciclodextrina y -ciclodextrina, en un medio acuoso adecuado para la inyección, encontrándose dicha 10 formulación en forma de una solución acuosa concentrada estable sin ajuste del pH.
2. Formulación inyectable según la reivindicación 1, en la que el pH de la formulación está comprendido entre 2 y 4.
3. Formulación inyectable según cualquiera de las reivindicaciones 1 ó 2, en la que el WAP-8294A2 está presente en 15 una concentración de 5-20 mg/ml.
4. Formulación inyectable según cualquiera de las reivindicaciones anteriores, en la que el WAP-8294A2 está presente en una concentración de 5-15 mg/ml.
5. Formulación inyectable según cualquiera de las reivindicaciones anteriores, en la que la 2-hidroxipropil-ciclodextrina está presente en una concentración de 2-50%.
6. Formulación inyectable según cualquiera de las reivindicaciones anteriores, en la que la 2-hidroxipropil-
ciclodextrina está presente en una concentración de 5-20%. 25
7. Formulación inyectable según cualquiera de las reivindicaciones 1 a 4, en la que la -ciclodextrina está presente en una concentración de 0, 5-2, 5%.
8. Formulación inyectable según cualquiera de las reivindicaciones 1 a 4, en la que la -ciclodextrina está presente 30 en una concentración de 1-2%.
9. Solución intravenosa que comprende una mezcla de (a) una formulación inyectable según la reivindicación 1; 35 (b) un agente de ajuste del pH; y (c) un líquido o diluyente de infusión intravenosa;
en la que el líquido o diluyente de infusión intravenosa y el agente de ajuste del pH están presentes en unas cantidades suficientes para proporcionar una concentración de 0, 1 mg/ml a 7, 5 mg/ml de WAP-8294A2 y un pH de 6 40 a 8.
10. Solución intravenosa según la reivindicación 9, que presenta una concentración de WAP-8294A2 de 0, 1 mg/ml a 5 mg/ml.
45 11. Solución intravenosa según la reivindicación 9 ó 10, que presenta una concentración de WAP-8294A2 de 0, 1 mg/ml a 3 mg/ml.
12. Solución intravenosa según cualquiera de las reivindicaciones 9 a 11, en la que el líquido o diluyente de infusión intravenosa (c) es una solución de dextrosa. 50
13. Solución intravenosa según cualquiera de las reivindicaciones 9 a 12, en la que el agente de ajuste del pH es una solución acuosa de hidrogenofosfato disódico, dihidrogenofosfato de sodio e hidróxido de sodio.
14. Método para preparar una formulación inyectable según la reivindicación 1, en el que dicho método comprende
disolver clorhidrato de WAP-8294A2 en una solución de dicha ciclodextrina en dicho medio acuoso adecuado para la inyección sin ajustar el pH.
15. Método para la preparación de una solución intravenosa que comprende el mezclado de:
(a) una formulación inyectable según la reivindicación 1;
(b) un agente de ajuste del pH; y
(c) un líquido o diluyente de infusión intravenosa;
en el que el líquido o diluyente de infusión intravenosa y el agente de ajuste del pH se añaden a (a) en una cantidad 15 suficiente para proporcionar una concentración de 0, 1 mg/ml a 7, 5 mg/ml de WAP-8294A2 y un pH de 6 a 8 en la solución intravenosa resultante.
Patentes similares o relacionadas:
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Formulaciones de azalida acuosas concentradas, del 8 de Julio de 2020, de Sun Pharma Global FZE: Una composición farmacéutica tópica para su uso en el tratamiento de una infección ocular que comprende administrar a un paciente en necesidad del mismo, una cantidad […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Tratamiento de disfunción eréctil y otras indicaciones, del 1 de Julio de 2020, de STRATEGIC SCIENCE & TECHNOLOGIES, LLC: Una composición para su uso en un método de tratamiento de la disfunción sexual en un sujeto, preferiblemente un sujeto humano, comprendiendo la composición: […]
Composición autoemulsionante de ácidos grasos omega-3, del 24 de Junio de 2020, de MOCHIDA PHARMACEUTICAL CO., LTD.: Una preparación autoemulsionante encapsulada que tiene una composición autoemulsionante que comprende, cuando se define que la composición autoemulsionante […]