Activación y expansión de células.
Un método para expandir una población de células T mediante la ligación de una porción de superficie celular,
que comprende:
a. proporcionar una población de células;
b. poner en contacto dicha población de células con una superficie, en donde dicha superficie tiene unido a ella un primer agente que liga una primera porción de la superficie de la célula T y un segundo agente que liga una segunda porción de la superficie de la célula T, en donde dicha ligación por el primer y segundo agente induce la proliferación de dichas células T y en donde dicho primer agente es un anticuerpo anti-CD3 o un fragmento de anticuerpo de este, y dicho segundo agente es un anticuerpo anti-CD28 o un fragmento de este;
c. expandir dichas células en un sistema cerrado, en donde dichas células se expanden a una concentración de entre 6 x 106 células/ml y 90 x 106 células/ml en menos de dos semanas,
en donde dicho sistema de cierre comprende un biorreactor como recipiente de cultivo posicionado sobre una plataforma oscilante, en donde dicha plataforma oscilante se inicia aproximadamente en el día 3 a aproximadamente 5 a 15 oscilaciones/minuto y en donde la velocidad y el ángulo de dicha plataforma oscilante son variables.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/028161.
Solicitante: LIFE TECHNOLOGIES CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 5791 VAN ALLEN WAY CARLSBAD, CA 92008 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KALAMASZ, DALE, CRAIG,STEWART, LAW,CHE, BONYHADI,MARK, SAUND,NARINDER, MCMILLEN,DAVID, CHANA,HARJINDER,SINGH, BERENSON,RONALD, HARDWICK,ALAN R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- A61L27/38 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Células animales (para utilizar en piel artificial A61L 27/60).
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12M1/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › Equipos para enzimología o microbiología.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- C12N5/00 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/0781 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células B; Sus progenitores.
- C12N5/0783 C12N 5/00 […] › Células T; Células NK; Progenitores de células T o NK.
- C12N5/0789 C12N 5/00 […] › Células madre; Células progenitoras multipotentes.
PDF original: ES-2434916_T3.pdf
Fragmento de la descripción:
Activación y expansión de células.
ANTECEDENTES DE LA INVENCIÓN
Campo de la invención La presente invención se refiere generalmente a métodos para estimular y activar células, y más particularmente, a métodos para activar y expandir las células a densidades muy altas y para expandir las células a números muy altos.
Descripción de la técnica relacionada El receptor de antígeno de la célula T (TCR) es un receptor multisubunitario de reconocimiento que se asocia con el complejo CD3 y se une a péptidos presentados por las proteínas del complejo mayor de histocompatibilidad (MHC) clase I y II en la superficie de las células presentadoras de antígeno (APC) . La unión del TCR al péptido antigénico en la APC es el evento central en la activación de células T, que se produce en una sinapsis inmunológica en el punto de contacto entre la célula T y la APC.
Para mantener la- activación de las células T, los linfocitos T típicamente requieren una segunda señal coestimuladora. La coestimulación es típicamente necesaria para que una célula T auxiliadora produzca suficientes niveles de citocinas que induzcan la expansión clonal. Bretscher, Immuno/. Today 13: 74, 1992; June y otros, Immunol. Today 15:321, 1994. La principal señal co-estimuladora se produce cuando un miembro de los ligandos de la familia B7 (CD80 (B7.1) o CD86 (B7.2) ) en una célula presentadora de antígeno activada (APC) se une a CD28 en una célula T.
Los métodos de estimulación de la expansión de ciertos subconjuntos- de células T tienen el potencial de generar una variedad de composiciones de células T útiles en la inmunoterapia. La inmunoterapia exitosa puede ayudarse aumentando la reactividad y la cantidad de las células T por estimulación eficiente.
Las diversas técnicas disponibles para la expansión de- las células T humanas se han basado principalmente en el uso de células accesorias y/o factores de crecimiento exógenos, tales como la interleucina-2 (IL-2) . La IL-2 se ha usado junto con un anticuerpo anti-CD3 para estimular la proliferación de células T, expandiendo predominantemente la subpoblación de células T CD8+. Se cree que se requieren ambas señales de APC para la activación óptima de células T, la expansión, y la sobrevivencia a largo plazo de las células T después de la reinfusión. El requisito de las APC pareadas a MHC como células accesorias presenta un problema importante para los sistemas de cultivo a largo plazo debido a que las APC son relativamente de corta duración. Por lo tanto, en un sistema de cultivo a largo plazo, las APC deben obtenerse continuamente a partir de una fuente y reponerse. La necesidad de un suministro renovable de células accesorias es problemático para el tratamiento de inmunodeficiencias en las que están afectadas las células accesorias. Adicionalmente, cuando se trata una infección viral, si las células accesorias llevan el virus, las células pueden contaminar la población entera de células T durante el cultivo a largo plazo.
En ausencia de factores de crecimiento exógenos o de células accesorias, puede enviarse una señal coestimuladora a una población de células T, por ejemplo, exponiendo las células a un ligando CD3 y a un ligando CD28 unido a una superficie de fase sólida, tal como una perla. Ver C. June, y otros (patente de los Estados Unidos núm. 5, 858, 358) ; C. June y otros WO 99/953823. Si bien estos métodos son capaces de alcanzar poblaciones terapéuticamente útiles de células T, el aumento de robustez y la facilidad de preparación de células T continúan siendo menos que ideales.
Adicionalmente, los métodos actualmente disponibles en la técnica no se han centrado en la expansión a corto plazo de las células T o la obtención de una población más robusta de células T y los resultados beneficiosos de estas. Además, la aplicabilidad de las células T expandidas se ha limitado solamente a pocos estados de enfermedad. Para una máxima efectividad in vivo, teóricamente, una población de células T activadas, generadas ex vivo o in vivo debe estar en un estado que pueda orquestar al máximo una respuesta inmune al cáncer, enfermedad infecciosa, u otros estados de enfermedad. La presente invención proporciona métodos para generar un mayor número de células más puras y altamente activadas que tienen receptor de superficie y características de producción de citocinas que parecen más sanos y naturales que otros métodos de expansión.
Adicionalmente, la presente invención proporciona composiciones de poblaciones celulares de cualquier célula diana, que incluyen las poblaciones de células T y los parámetros para la producción de las mismas, así como también para proporcionar otras ventajas relacionadas.
BREVE RESUMEN DE LA INVENCIÓN
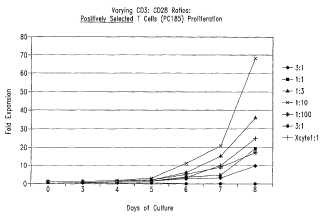
La presente invención proporciona métodos para activar y expandir una población de células T mediante la ligación de una porción de superficie celular, que comprende: a ) una población de células; b. poner en contacto dicha población de células con una superficie, en donde dicha superficie tiene unida a ella un primer agente que liga una primera porción de superficie de la célula T y un segundo agente que liga una segunda porción de superficie de la célula T, en donde dicha ligación por el primer y segundo agente induce la proliferación de dichas células T y en donde dicho primer agente es un anticuerpo anti-CD3 o un fragmento de anticuerpo de este, y dicho segundo agente es un anticuerpo anti-CD28 o un fragmento de este, c. expandir dichas células en un sistema cerrado, en donde dichas células se expanden a una concentración de entre 6 x 106 células/ml y 90 x 106 células/ml en menos de dos semanas, en donde dicho sistema cerrado comprende un recipiente de cultivo biorreactor posicionado en una plataforma oscilante, en donde la oscilación de dicha plataforma se inicia en aproximadamente el día 3 a aproximadamente 5 a 15 oscilaciones/minuto y en donde la velocidad y el ángulo de dicha plataforma oscilante son variables. En una modalidad, las células T se derivan de un único individuo y las células T se expanden a partir de un número de células de partida de aproximadamente 100-500 X 106 hasta un total de aproximadamente 100-500 X 109 células en menos de aproximadamente dos semanas. El método de la reivindicación 1 en donde dichas células T alcanzan una concentración de aproximadamente 50 X 106 células/ml en menos de dos semanas. En una modalidad, las células T alcanzan una concentración de 40-60 X 106 células/ml del día 7 al día 12. En una modalidad adicional, las células T se expanden por lo menos aproximadamente 1.5 veces en aproximadamente 24 horas desde aproximadamente el día 5 a aproximadamente el día 12. En otra modalidad, la población de células T se siembra en un recipiente de cultivo que retiene de aproximadamente un volumen de 0.1 litros a aproximadamente un volumen de 200 litros. En una modalidad relacionada, el recipiente de cultivo comprende al menos un filtro de entrada y un filtro de salida. En aún otra modalidad, la población de células T se siembra a una concentración inicial de 0.2 X 106células/ml a 5 X 106 células/ml.
En una modalidad, la expansión de las células de la presente invención se produce en un sistema cerrado. En una modalidad, el sistema cerrado comprende un recipiente que comprende al menos un filtro de entrada, un filtro de salida, y un puerto de muestreo. En otra modalidad, el medio de cultivo se perfunde a través del sistema cerrado. En ciertas modalidades, la perfusión se inicia aproximadamente en los días 4-8 a una velocidad de aproximadamente 0.5 ml/minuto a aproximadamente 3 ml/minuto. Los medios ilustrativos incluyen, pero sin limitarse a, RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15, y X-Vivo 20. En modalidades adicionales, el medio puede comprender una citocina, tal como IL-2, IFN-γ, IL-4, GM-CSF, IL-10, IL-12, TGFβ, y TNF-α, o una vitamina. En modalidades adicionales, el medio comprende surfactante, un anticuerpo, plasmanato o un agente reductor (por ejemplo, N-acetil-cisteína, 2-mercaptoetanol) .
En otras modalidades, la plataforma comprende además un elemento térmico variable, un imán, y un distribuidor de gas. En ciertas modalidades, el sistema cerrado comprende además una bomba de jeringa y un control para la transferencia estéril hacia y desde dicho sistema cerrado.
La presente invención proporciona además las poblaciones de células T producidas de acuerdo con los métodos descritos en la presente invención.
Otro aspecto de la presente invención describe métodos para la expansión de una población de células mediante la ligación de una porción de superficie celular, que comprende: proporcionar una población... [Seguir leyendo]
Reivindicaciones:
1. Un método para expandir una población de células T mediante la ligación de una porción de superficie celular, que comprende:
a. proporcionar una población de células;
b. poner en contacto dicha población de células con una superficie, en donde dicha superficie tiene unido a ella un primer agente que liga una primera porción de la superficie de la célula T y un segundo agente que liga una segunda porción de la superficie de la célula T, en donde dicha ligación por el primer y segundo agente induce la proliferación de dichas células T y en donde dicho primer agente es un anticuerpo anti-CD3 o un fragmento de anticuerpo de este, y dicho segundo agente es un anticuerpo anti-CD28 o un fragmento de este;
c. expandir dichas células en un sistema cerrado, en donde dichas células se expanden a una concentración de entre 6 x 106 células/ml y 90 x 106 células/ml en menos de dos semanas,
en donde dicho sistema de cierre comprende un biorreactor como recipiente de cultivo posicionado sobre una plataforma oscilante, en donde dicha plataforma oscilante se inicia aproximadamente en el día 3 a aproximadamente 5 a 15 oscilaciones/minuto y en donde la velocidad y el ángulo de dicha plataforma oscilante son variables.
2. El método de la reivindicación 1, en donde dichas células T se derivan de un único individuo y en donde dichas células T se expanden a partir de un número de partida d.
10. 500 x 106 células hasta un total d.
10. 500 x 109 células en menos de dos semanas.
3. El método de la reivindicación 2, en donde dichas células T alcanzan una concentración de 50 x 106 células/ml en menos de dos semanas.
4. El método de cualquiera de las reivindicaciones 2 o 3, en donde dichas células T alcanzan una concentración d.
4. 80 x 106 células/ml hacia el día 12.
5. El método de cualquiera de las reivindicaciones 2 o 3, en donde dichas células T alcanzan una concentración d.
4. 80 x 106 células/ml hacia el día 9.
6. El método de cualquiera de las reivindicaciones 2 o 3, en donde dichas células T alcanzan una concentración d.
4. 80 x 106 células/ml hacia el día 7.
7. El método de cualquiera de las reivindicaciones 2 o 3, en donde dichas células T se expanden en al menos aproximadamente 1.5 veces en aproximadamente 24 horas de aproximadamente el día 5 a aproximadamente el día 12.
8. El método de cualquiera de las reivindicaciones 2 a la 7, en donde dicha población de células T se siembra en un recipiente de cultivo que retiene un volumen de aproximadamente 0.1 litros a aproximadamente 200 litros.
9. El método de la reivindicación 8, en donde dicho recipiente de cultivo comprende al menos un filtro de entrada y un filtro de salida.
10. El método de la reivindicación 8, en donde dicha población de células T se siembra a una concentración inicial de 0.1-0.5 x 106 células/ml.
11. El método de cualquiera de las reivindicaciones 1 a la 10, en donde dicho sistema cerrado comprende un recipiente que comprende al menos un filtro de entrada, un filtro de salida, y un puerto de muestreo.
12. El método de cualquiera de las reivindicaciones 1 a la 11, en donde el medio de cultivo se perfunde a través de dicho sistema cerrado.
13. El método de la reivindicación 12, en donde dicha perfusión se inicia a una velocidad de 0.5 ml/minuto a 3.0ml/minuto el día 4, el día 6 o el día 8.
14. El método de la reivindicación 12, en donde dicho medio se selecciona del grupo que consiste de RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15, y X-Vivo 20.
15. El método de la reivindicación 12, en donde dicho medio de cultivo comprende uno o más de los siguientes: una citocina, una vitamina, un surfactante, un anticuerpo, plasmanato o un agente reductor.
16. El método de la reivindicación 15, en donde dicha citocina se selecciona del grupo que consiste de IL-2, IFN-γ, IL-4, GM-CSF, IL-10, IL-12, TGF-β, y TNF-α.
17. El método de la reivindicación 15, en donde dicho agente reductor se selecciona del grupo que consiste de 5 N-acetil-cisteína y 2-mercaptoetanol.
18. El método de las reivindicaciones 1 a la 10, en donde dicha plataforma comprende además un elemento térmico variable y/o un imán.
19. El método de cualquiera de las reivindicaciones precedentes, en donde dicho sistema cerrado comprende además un distribuidor de gas y/o una bomba de jeringa y un control para la transferencia estéril hacia y desde dicho sistema cerrado.
20. El método de cualquiera de las reivindicaciones 1 a la 19, en donde la superficie se selecciona a partir de 15 metales, vidrio, plásticos, co-polímeros, coloides, lípidos, superficies celulares, o una partícula.
21. El método de la reivindicación 20, en donde dicha partícula es paramagnética.
22. El método de la reivindicación 20 o la reivindicación 21, en donde dicha partícula es una perla.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Métodos y composiciones para tratar y prevenir enfermedades asociadas con la integrina AVB8, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un anticuerpo aislado que se une específicamente a la integrina β8 humana e inhibe la adhesión del péptido asociado a latencia (LAP) a ανβ8, en donde el […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Proteínas de unión al antígeno ST2, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo aislado que se une a un antígeno ST2 que tiene la secuencia de aminoácidos 19-556 del SEQ ID NO: 1, comprendiendo dicho anticuerpo una secuencia de […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]