Acoplamiento covalente, sin enlazadores, de bacteriorrodopsina en forma de membrana púrpura.
Procedimiento para la fabricación de bacteriorrodopsina reticulada de forma covalente,
caracterizado porque labacteriorrodopsina se hace reaccionar en forma unida a membrana como sustrato de una transglutaminasa y deeste modo es reticulada de forma covalente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2000/002904.
Solicitante: U-NICA TECHNOLOGY AG.
Inventor/es: PASTERNACK, RALF, HAMPP, NORBERT, SEITZ, ARNE, FUCHSBAUER,H.-L.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/215 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Halobacteriaceae (F).
- C07K17/02 C07K […] › C07K 17/00 Péptidos fijados sobre un soporte o inmovilizados; Su preparación. › Péptidos inmovilizados, o en, un soporte orgánico.
- C09B61/00 C […] › C09 COLORANTES; PINTURAS; PULIMENTOS; RESINAS NATURALES; ADHESIVOS; COMPOSICIONES NO PREVISTAS EN OTRO LUGAR; APLICACIONES DE LOS MATERIALES NO PREVISTAS EN OTRO LUGAR. › C09B COLORANTES ORGANICOS O COMPUESTOS ESTRECHAMENTE RELACIONADOS PARA PRODUCIR COLORANTES; MORDIENTES; LACAS (procesos de fermentación o procesos que utilizan enzimas para la síntesis de un compuesto dado C12P). › Colorantes de origen natural preparados a partir de fuentes naturales.
- C12N11/02 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 11/00 Enzimas fijadas sobre un soporte o inmovilizadas; Células microbianas fijadas sobre un soporte o inmovilizadas; Su preparación. › Enzimas o células microbianas inmovilizadas sobre o en un soporte orgánico.
PDF original: ES-2420905_T3.pdf
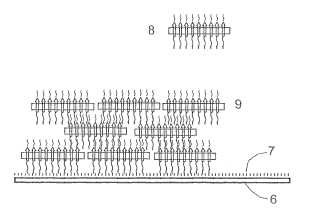
Fragmento de la descripción:
Acoplamiento covalente, sin enlazadores, de bacteriorrodopsina en forma de membrana púrpura La invención se refiere al acoplamiento covalente sin enlazadores, de bacteriorrodopsina (BR) de forma unida a membrana, en especial en forma de membrana púrpura.
La bacteriorrodopsina (BR) es una proteína de la membrana que se presenta, por ejemplo, en halobacterias en forma de cristales no solubles en agua, de forma discoidal, bidimensionales, la llamada membrana púrpura (PM) . La membrana púrpura tiene un grosor de unos 5 mm. El diámetro de la membrana púrpura se encuentra de manera típica en la zona de 300 nm hasta 1000 nm.
La membrana púrpura se compone de moléculas de bacteriorrodopsina en forma α-helicoidal y aproximadamente 10 moléculas de lípidos para cada molécula de bacteriorrodopsina. La bacteriorrodopsina está casi completamente incorporada en la membrana de lípidos, constituida a base de las moléculas de lípidos. De ello resulta, una desacostumbrada estabilidad termodinámica.
La bacteriorrodopsina en forma de membrana púrpura es utilizada técnicamente como material fotocrómico para aplicaciones ópticas. Además la bacteriorrodopsina en forma de membrana púrpura tiene significación técnica como material con características fotoeléctricas.
Para estas aplicaciones técnicas es ventajosa, entre otras, la reticulación covalente de membranas púrpura. En la utilización de la bacteriorrodopsina en aplicaciones fotovoltaicas se consiguen para cada capa de membrana púrpura aproximadamente 300 mV. Mediante la constitución de varias capas de membrana púrpura una encima de otra mediante reticulación covalente, se pueden conseguir elementos que facilitan tensiones mas elevadas. Otro aspecto adicional interesante es el acoplamiento covalente de membranas púrpura sobre superficies, polímeros o pequeñas moléculas, por ejemplo colorantes.
Normalmente se pretende la utilización de bajo peso molecular de enlazadores, por ejemplo glutaraldehído, para la unión covalente de membranas púrpura. No obstante estas reacciones de acoplamiento tienen lugar con un rendimiento muy desfavorable. La causa de ello es que pocos aminoácidos de la bacteriorrodopsina se encuentran fuera de la doble capa de lípidos de la membrana, están sometidos a impedimento estérico y reaccionan de modo difícil con los reactivos de acoplamiento de bajo peso molecular. Los reactivos de acoplamiento en forma de bajo peso molecular tienen además otro importante inconveniente. Pueden entrar a través del canal de protones hasta el centro activo de la bacteriorrodopsina. En especial, una reacción de las moléculas de los enlazadores con el lugar de unión del retinaldehído en la lisina-216 (base Schiff) conduce a perjuicios irreversibles de las funciones deseadas de la proteína. Por esta razón los reactivos de acoplamiento de bajo peso molecular, ampliamente extendidos, que reaccionan con grupos amino, son especialmente desfavorables. Además, los enlazadores de molécula pequeña deben ser suministrados en exceso para conseguir, como mínimo, un rendimiento y velocidad de reticulación aceptables en cierta medida. Múltiples moléculas sin reaccionar permanecen en el material y deben ser eliminadas después de la reacción. Esto no es posible, por ejemplo, en la fabricación de películas ópticas.
Los inconvenientes de los enlazadores de bajo peso molecular se reúnen brevemente a continuación en los siguientes puntos:
- Pocos aminoácidos de la bacteriorrodopsina son accesibles para los enlazadores.
- Los enlazadores que reaccionan con grupos amino funcionales no se deben utilizar.
- Los enlazadores que no han reaccionado se deben eliminar, puesto que de lo contrario tiene lugar una postreacción incontrolada, duradera en el tiempo, que conduce a una variación continuada de las propiedades del material y a falta de estabilidad a largo plazo.
El documento EP 0 417 541 da ha conocer un procedimiento para la reticulación de proteínas orientadas con utilización de enlazadores de bajo peso molecular tales como glutaraldehído, carbodiimida o diaminas.
El documento B.J. Gaffney, Biochim. Biophys. Acta, 822 (1985) 289-313 es un articulo de resumen sobre la reticulación química y bioquímica de diferentes partes de la membrana. El articulo da a conocer entre otros, la reticulación bioquímica de proteínas del citoesqueleto y de la membrana no especificadas en detalle, de eritrocitos mediante transglutaminasa propia de las células en la alimentación de un ionóforo de calcio y de calcio minimolar. La reticulación de la bacteriorrodopsina es descrita solamente, por el contrario, con utilización de enlazadores fotoactivables de bajo peso molecular, con un grupo de isotiocianato.
El documento WO 99/06446 da a conocer un procedimiento para el acoplamiento de transglutaminasa catalizada de proteínas o péptidos en un soporte. El documento no proporciona indicaciones de si la bacteriorrodopsina es apropiada como sustrato de una transglutaminasa.
Un objetivo de la invención consiste por lo tanto en un procedimiento para el acoplamiento covalente de bacteriorrodopsina en forma de membrana, en especial para reticulación directa de membranas púrpura sin utilización de enlazadores de bajo peso molecular. Otro campo de utilización es el acoplamiento de bacteriorrodopsina en forma de membrana en superficies de polímeros o materiales auxiliares, en especial colorantes.
Este objetivo es conseguido mediante un procedimiento para la fabricación de bacteriorrodopsina reticulada covalente, la cual se caracteriza porque la bacteriorrodopsina en forma unida a la membrana es utilizada como sustrato de una transglutaminasa, en especial, de una transglutaminasa bacteriana y de esta forma es reticulada de forma covalente.
Bajo el concepto de bacteriorrodopsina, tal como se utilizará en adelante, se comprenderá tanto la bacteriorrodopsina de tipo natural o salvaje (BR-WT) como la bacteriorrodopsina. El concepto de variantes de bacteriorrodopsina comprende también las moléculas de bacteriorrodopsina que se diferencian de BR-WT por adición, sustitución, deleción y/o inserción de aminoácidos, en especial como mínimo de un aminoácido, de manera especialmente preferente un mínimo de dos, de manera más preferente un mínimo de tres y hasta 50, preferentemente hasta 20, y en especial preferentemente hasta 10 aminoácidos. Además se comprenden bajo el concepto de variantes, moléculas de bacteriorrodopsina en las que el retinal está sustituido por moléculas análogas a retinal así como moléculas de bacteriorrodopsina que han sido modificadas químicamente, por ejemplo, mediante introducción de grupos protectores o grupos secundarios funcionales.
Para el objetivo de la presente invención la expresión “bacteriorrodopsina” comprende también proteínas de la membrana estructuralmente relacionadas con la bacteriorrodopsina, que se encuentran en forma unida a la membrana y que presentan una homología de mínimo 70%, más preferentemente como mínimo 80% y con máxima preferencia como mínimo 90% con respecto al tipo natural o salvaje de la bacteriorrodopsina.
La homología, tal como se utiliza en esta descripción, es definida del modo siguiente H (%) = (1-A/[BR-WT]) x 100,
en la que H significa homología en porcentaje, A es el número de variaciones con respecto a la secuencia salvaje de la bacteriorrodopsina y [BR-WT] el número de aminoácidos de la secuencia de la bacteriorrodopsina de tipo salvaje.
Son ejemplos para proteínas de la membrana estructuralmente relacionadas con bacteriorrodopsina en forma unida a la membrana, que están comprendidos en la invención, la halorrodopsina así como sensorrodopsina. Estas proteínas de la membrana se encuentran de forma no cristalina en la membrana.
Los materiales de bacteriorrodopsina a utilizar preferentemente según la invención comprenden bacteriorrodopsina de tipo salvaje así como variantes de la bacteriorrodopsina con una secuencia modificada de aminoácidos. De manera preferente las variantes de la bacteriorrodopsina presentan una función física modificada, en especial una sensibilidad a la luz modificada, un color modificado o una cinética modificada del comportamiento fotocrómico de la bacteriorrodopsina. Tienen la máxima preferencia las variantes de bacteriorrodopsina en la que se han delecionado o bien introducido lugares de unión para la reticulación enzimática con transglutaminasa. De manera especialmente preferente se utilizarán variantes de bacteriorrodopsina en las que se ha delecionado Gln o Lys o que se han cambiado por otros aminoácidos. En la bacteriorrodopsina se encuentra un lugar de unión Lys-intracelular (término =C-) en las posiciones Lys41, Lys42,... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la fabricación de bacteriorrodopsina reticulada de forma covalente, caracterizado porque la bacteriorrodopsina se hace reaccionar en forma unida a membrana como sustrato de una transglutaminasa y de 5
este modo es reticulada de forma covalente.
2. Procedimiento, según la reivindicación 1, caracterizado porque la bacteriorrodopsina se hace reaccionar en forma de membrana púrpura como sustrato de una transglutaminasa y de esta manera es reticulada de forma covalente.
3. Procedimiento, según la reivindicación 1 ó 2, caracterizado porque la bacteriorrodopsina es una proteína de membrana en forma unida a membrana que está estructuralmente relacionada con la bacteriorrodopsina de tipo salvaje y tiene como mínimo 90% de homología con respecto a la bacteriorrodopsina de tipo salvaje.
4. Procedimiento, según cualquiera de las reivindicaciones anteriores, caracterizado porque la bacteriorrodopsina es 15 seleccionada entre bacteriorrodopsina de tipo salvaje y/o variantes de bacteriorrodopsina.
5. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque las variantes de bacteriorrodopsina son seleccionadas entre variantes de bacteriorrodopsina que difieren de la bacteriorrodopsina de tipo salvaje por adición, sustitución, deleción y/o inserción de aminoácidos, en particular como mínimo un aminoácido; moléculas de bacteriorrodopsina en las que el retinal es sustituido por moléculas similares a retinal; y moléculas de bacteriorrodopsina que son químicamente modificadas por introducción de grupos protectores y/o grupos funcionales laterales.
6. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se delecionan Gln o Lys 25 o se sustituyen por otros aminoácidos en las variantes de la bacteriorrodopsina.
7. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se reticulan entre sí bacteriorrodopsinas o variantes de bacteriorrodopsina idénticas o distintas.
8. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se hace reaccionar como mínimo una variante de bacteriorrodopsina que es halorrodopsina y/o sensorrodopsina en una forma unida a membrana.
9. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se hace reaccionar como mínimo una variante de bacteriorrodopsina que tiene una secuencia de aminoácidos modificada en comparación con la bacteriorrodopsina de tipo salvaje y/o en la que el retinal, está sustituido por una molécula similar a retinal y/o que es químicamente modificada y/o que es modificada por tratamiento enzimático.
10. Procedimiento, según la reivindicación 9, caracterizado porque se hace reaccionar como mínimo una variante de 40 bacteriorrodopsina que contiene solamente un lugar de unión único para transglutaminasa.
11. Procedimiento, según la reivindicación 9, caracterizado porque se hace reaccionar como mínimo una variante de bacteriorrodopsina que contiene dos lugares de unión para transglutaminasa que no se encuentran en el mismo lado de la membrana.
12. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque la reacción de reticulación es interrumpida por calentamiento breve a 80ºC o superior.
13. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se utiliza una 50 transglutaminasa bacteriana.
14. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque se utiliza una transglutaminasa bacteriana que es activa sin cofactor.
15. Procedimiento, según cualquiera de la reivindicaciones anteriores, caracterizado porque la bacteriorrodopsina es reticulada con un polímero, una sustancia de superficie y/o una sustancia auxiliar, caracterizado porque la sustancia auxiliar es seleccionada entre grupos que consisten en colorantes, fluorocromos, lípidos, péptidos, ácidos nucleicos, oligómeros y polímeros sintéticos, proteínas, lectinas, polisacáridos y moléculas conductoras.
16. Bacteriorrodopsina reticulada de forma covalente, sin enlazadores, que se puede obtener por el procedimiento, según cualquiera de las reivindicaciones anteriores.
Utilización de la bacteriorrodopsina reticulada de forma covalente sin enlazadores, según la reivindicación 16, para aplicaciones fotoeléctricas.
18. Utilización de la bacteriorrodopsina reticulada de forma covalente sin enlazadores, según la reivindicación 16, para almacenamiento tridimensional de datos.
Patentes similares o relacionadas:
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Procedimientos de tratamiento o predicción del riesgo de un evento de taquiarritmia ventricular, del 17 de Abril de 2019, de CRITICAL CARE DIAGNOSTICS, INC: Un procedimiento de selección de un tratamiento para un sujeto, comprendiendo el procedimiento: determinar un nivel de ST2 soluble en una muestra biológica […]
Péptidos autoensamblantes modificados, del 15 de Abril de 2019, de MASSACHUSETTS INSTITUTE OF TECHNOLOGY: Una composición para su uso en un procedimiento para tratar a un sujeto, en la que la composición se administra como relleno para defectos en un defecto óseo dentro […]
 Tratamiento de dolencias asociadas a septicemia, del 30 de Octubre de 2018, de TLA Targeted Immunotherapies AB: Un reactivo de union capaz de unirse especificamente al receptor de quimioquina CXCR1 para su uso en el tratamiento de la septicemia o del sindrome de insuficiencia respiratoria […]
Tratamiento de dolencias asociadas a septicemia, del 30 de Octubre de 2018, de TLA Targeted Immunotherapies AB: Un reactivo de union capaz de unirse especificamente al receptor de quimioquina CXCR1 para su uso en el tratamiento de la septicemia o del sindrome de insuficiencia respiratoria […]
Tratamiento de esclerosis múltiple, del 17 de Enero de 2018, de TLA Targeted Immunotherapies AB: Un reactivo de unión capaz de unirse específicamente al receptor de quimioquina CCR2 para su uso en el tratamiento de esclerosis múltiple, en donde el reactivo de unión […]
Composición en polvo seco estable que comprende microorganismos biológicamente activos y/o materiales bioactivos y métodos de producción, del 26 de Julio de 2017, de ADVANCED BIONUTRITION CORPORATION: Una composición seca estable que comprende (i) un microorganismo o material bioactivo, (ii) al menos dos agentes estabilizadores y (iii) al menos dos agentes […]
Tratamiento de afecciones respiratorias, del 17 de Mayo de 2017, de TLA Targeted Immunotherapies AB: Un reactivo de unión capaz de unirse específicamente al receptor de quimiocinas CCR2 para uso en el tratamiento de una afección respiratoria, en donde […]
Moléculas de unión para las proteínas similares al factor VIII y factor VIII humano, del 12 de Noviembre de 2014, de DYAX CORP.: Un método para la purificación del factor VIII humano y/o un polipéptido similar al factor VIII que comprende: (a) poner en contacto una solución que […]