Ácido ribonucleico pequeño de interferencia (ARNip) para administración oral.
El ácido ribonucleico pequeño de interferencia (ARNip) cubierto en 3' con hidroxipropoxi fosfodiéster,
dicho ARNipque comprende dos cadenas de ARN separadas que son complementarias entre sí, sobre al menos 19 nucleótidos,en donde cada cadena tiene 49 nucleótidos o menos, y en donde los dos primeros apareamientos de bases en elnucleótido en el extremo 3' de cada cadena son residuos 2'-metoxietil ribonucleótido.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09169772.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: NATT, FRANCOIS, JEAN-CHARLES, BILLY,ERIC, HUNZIKER,JUERG, SCHNELL,CHRISTIAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/713 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos nucleicos u oligonucleótidos con estructura en doble hélice.
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
PDF original: ES-2398680_T3.pdf
Fragmento de la descripción:
Ácido ribonucleico pequeño de interferencia (ARNip) para administración oral
Antecedentes:
La interferencia de ARN inicialmente descubierta en las plantas como Silenciamiento de Gen Pos-Transcripcional (PTGS) , es un mecanismo altamente conservado desencadenado por un ARN de doble cadena (ARNbc) y capaz de inhibir la expresión de la transcripción de genes homólogos para el ARNbc1. El ARNbc primero se procesa por Dicer en dúplex cortos de 21-23 nt, denominados ARNs pequeños de interferencia (ARNips) 2. Incorporados en el complejo de silenciamiento inducido por ARN (RISC) son capaces de mediar el silenciamiento del gen a través de la escisión del ARNm diana en el centro de la región de homología por Argonauta 2, un componente de RISC3. En 2001, Elbashir et al4 demostraron que la introducción directa de ARNips sintéticos mediaría el silenciamiento del gen de interferencia de ARN en drosophila pero también en células de mamífero. Desde entonces, el silenciamiento del gen mediado por ARNip se ha convertido en una potente y ampliamente utilizada herramienta de la biología molecular, en ambos estudios identificación diana y validación diana. El uso de ARNips para el silenciamiento del gen en estudios de animales ha sido descrito en una cantidad limitada de modelos de animales. Los ARNips no modificados fueron administrados localmente en el ojo5, intratecal o intracerebralmente en el sistema nervioso central6, e intranasal para la inhibición de virus respiratorio7. También se ha estudiado la inyección hidrodinámica intravenosa de ARNips no modificados en la vena de la cola. Este enfoque permite una administración rápida, principalmente en el hígado8. Un número muy limitado de estudios se ha reportado en la administración sistémica de ARNips no modificados. Duxbur y et al9 administraron vía intravenosa ARNips no modificados dirigidos a la Quinasa de Adhesión Focal en un modelo de ratón de xenoinjerto de tumor, y observaron una inhibición del crecimiento del tumor así como una quimiosensibilización a la gemcitabina. Soutscheck et al reportaron el uso sistémico de ARNips altamente modificados químicamente para el silenciamiento endógeno de la Apolipoproteína B. La administración intraperitoneal de la mayoría de ARNip anti-ApoB a la dosis alta de 50 mg/kg redujo nivel de proteína ApoB y la concentración de Lipoproteína10. A pesar de estos ejemplos, el uso in vivo de ARNips bajo la administración sistémica necesita mejoras con el fin de hacer ampliamente aplicable esta tecnología para la validación diana o aplicaciones terapéuticas. En efecto, ARNips no modificados se someten a digestión enzimática, principalmente mediante abundantes nucleasas en la corriente sanguínea. Con el fin de mejorar las propiedades farmacológicas de ARNips, diferentes grupos investigaron la modificación química de estos reactivos. WO2005021749 describe que moléculas de ARN de doble cadena (ARNbc) sintéticas con al menos un extremo romo que comprenden un cierto tipo de modificación química median eficientemente la interferencia del ARN. Dande and coworkers han descrito que modificaciones de 4’-tioribosa individualmente o combinados con modificaciones 2’-O-Metilo aumentan la actividad y la estabilidad en plasma de ARNips (Dande et al.. J. Med. Chem. 2006, 49, 1624-1634) .
Mientras que los enfoques descritos son muy diferentes entre sí y que no se llevó a cabo un estudio sistemático, una visión general de los resultados permite determinar la tolerancia de ARNips para modificaciones químicas. Se han investigado varios químicos tales como fosforotioatos11 o boranofosfatos12, 2’-O-Metil13, 2’-O-alil14, 2’-metoxietil (MOE) y 2’-deoxifluoronucleotidos15 o Ácidos Nucleicos Bloqueados (ANB) 16. Estos estudios destacaron que la tolerancia de la modificación no solo depende de la química, sino también depende de la posición.
La presente invención provee un ARNip modificado mínimamente con propiedades farmacológicas mejoradas. Los ARNips modificados mínimamente son ARN de 19bp de doble cadena modificado en el extremo 3’ de cada cadena con el fin de prevenir la digestión de 3’-exonucleasa: se ha reemplazado el 3’-didesoxinucleótido saliente de ARNip 21-nt por una fracción universal 3’-hidroxipropil fosfodiéster y la modificación de los dos primeros apareamientos de bases del nucleótido en el extremo 3’ de cada cadena, mejora aún más la estabilidad del suero. Aplicando vía intraperitoneal u oral a ratones adultos, los ARNips modificados muestran una mayor potencia en un modelo de angiogénesis inducida por factor de crecimiento que se correlaciona con su aumento en la estabilidad en suero.
Resumen En un aspecto, la presente invención provee un ácido ribonucleico pequeño de interferencia (ARNip) cubierto en 3’ con Hidroxipropoxi fosfodiéster para la administración oral, dicho ARNip que comprende dos cadenas de ARN separadas que son complementarias entre sí sobre al menos 15 nucleótidos, en donde cada cadena tiene 49 nucleótidos o menos, y en donde los primeros dos apareamientos de bases del nucleótido en el extremo 3’ de cada cadena son residuos 2’-metoxietil ribonucleótido.
En una modalidad, el ARNip comprende al menos un nucleótido modificado adicional.
En otra modalidad, dicho nucleótido modificado se selecciona entre los nucleótidos que tienen un enlace internucleósido modificado seleccionado entre los enlaces fosforotioato, fosforoditioato, fosforamidato, boranofosfonoato, y amida.
En otra modalidad, dichas dos cadenas de ARN son totalmente complementarias entre sí.
En otra modalidad, dicho ARNip comprende un saliente de 1 a 6 nucleótidos en al menos uno de los extremos 5’ o extremos 3’.
También se describe un ARNip que contiene al menos una cadena que es complementaria sobre al menos 15 nucleótidos para el ARNm o pre-ARNm de VEGFR-1, VEGFR-2, VEGFR3, Tie2, bFGFR, IL8RA, IL8RB, Fas, o IGF2R.
El ARNip puede contener al menos una cadena que comprende una secuencia seleccionada de SEQ ID NO I - 900.
El ARNip se puede elegir del grupo que consiste de SEQ ID NO 901-930.
En otra modalidad, el ARNip tiene una estabilidad en un ensayo estándar de ácido gástrico que es mayor que la de un ARNip no modificado con la misma secuencia de nucleótido.
En otra modalidad, el ARNip tiene una estabilidad en un ensayo estándar de ácido gástrico que es mayor o igual al 50%, después de 30 minutos de exposición.
En otra modalidad, el ARNip tiene una estabilidad en un ensayo estándar de suero mayor de la del ARNip no modificado.
En otra modalidad, el ARNip tiene una estabilidad en un ensayo estándar de suero que es mayor de o igual al 50%, después de 30 minutos de exposición.
En otra modalidad, el ARNip tiene una estabilidad en un ensayo estándar de lavado intestinal que es mayor de la del ARNip no modificado.
En otra modalidad, el ARNip tiene una biodisponibilidad oral mejorada en comparación con una del ARNip no modificado de la misma secuencia de nucleótido.
En un aspecto, la invención provee una composición farmacéutica que comprende un ARNip con cualquiera o más de las propiedades anteriores.
En otro aspecto, la invención provee un ARNip con una cualquiera o más de las propiedades anteriores para utilizar como un medicamento.
En otro aspecto, la invención provee el uso de un ARNip con una cualquiera o más de las propiedades anteriores en la preparación de un medicamento para tratar un trastorno angiogénico.
En otro aspecto, la invención provee el uso de un ARNip con cualquiera o más de las propiedades anteriores para inhibir un proceso angiogénico in vitro.
Breve Descripción de los Dibujos:
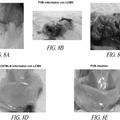
Figura 1a, 1b, 1c, 1d y 1e: La degradación metabólica de ARNip no modificado pG13-ARNip (ARNip del tipo salvaje en suero de ratón) ; a-c) El análisis de HPLC de Intercambio Iónico de ARNips no modificados después de la incubación en suero de ratón durante 0’, 30’ y 180’; Después de 30’ de incubación a 37°C, el pico principal en el HPLC de Intercambio Iónico se aisló y se volvió a inyectar en LC-MS, d) tabla de pesos moleculares detectados y sus asignaciones; e) espectro ESI-MS
Figura 2: ilustración de cuatro formatos de ARN de cadena doble: ARNip de tipo-salvaje (o no modificado) . MOE o/h ARNip, ARNip-C3 y MOE ARNip-C3.
Figura 3: Estabilidad de ARNip en 3 formatos diferentes en ácido gástrico de ratón. Las muestras se incubaron a 37°C en ácido gástrico de ratón a una concentración 2 micromolar. La desaparición del compuesto principal se siguió durante un periodo de 2-6 horas mediante la cuantificación... [Seguir leyendo]
Reivindicaciones:
1. El ácido ribonucleico pequeño de interferencia (ARNip) cubierto en 3’ con hidroxipropoxi fosfodiéster, dicho ARNip que comprende dos cadenas de ARN separadas que son complementarias entre sí, sobre al menos 19 nucleótidos, en donde cada cadena tiene 49 nucleótidos o menos, y en donde los dos primeros apareamientos de bases en el nucleótido en el extremo 3’ de cada cadena son residuos 2’-metoxietil ribonucleótido.
2. El ARNip de la reivindicación 1, en donde cada cadena tiene 19 nucleótidos.
3. El ARNip de acuerdo con la reivindicación 1, en donde dicho ARNip comprende los nucleótidos modificados seleccionados entre los nucleótidos que tienen un enlace internucleósido modificado seleccionado entre los enlaces de fosforotioato, fosforoditioato, fosforamidato, boranofosfonoato, y amida.
4. El ARNip de acuerdo con la reivindicación 1, en donde al menos un nucleótido adicional se modifica.
5. El ARNip de acuerdo con la reivindicación 1, en donde dichas dos cadenas de ARN son totalmente complementarias entre sí.
6. El ARNip de acuerdo con la reivindicación 1, que comprende un saliente de 1 a 6 nucleótidos sobre al menos uno de los extremos 5’ o extremos 3’.
7. El ARNip de acuerdo con la reivindicación 1, que tiene estabilidad en un ensayo estándar de ácido gástrico que es mayor que la de un ARNip no modificado con la misma secuencia de nucleótido.
8. El ARNip de acuerdo con la reivindicación 1, que tiene estabilidad en un ensayo estándar de ácido gástrico que es mayor o igual al 50%, después de 30 minutos de exposición.
9. El ARNip de acuerdo con la reivindicación 1, que tiene estabilidad en un ensayo estándar de suero que es mayor que la de un ARNip no modificado con la misma secuencia de nucleótido.
10. El ARNip de acuerdo con la reivindicación 1, que tiene estabilidad en un ensayo estándar de suero que es mayor
o igual a 50%, después de 30 minutos de exposición.
11. El ARNip de acuerdo con la reivindicación 1, que tiene estabilidad en un ensayo estándar de lavado intestinal que es mayor que la de un ARNip no modificado con la misma secuencia de nucleótido.
12. El ARNip de acuerdo con la reivindicación 1, que tiene una biodisponibilidad oral mejorada en comparación con un ARNip no modificado de la misma secuencia de nucleótido.
13. El ARNip de acuerdo con cualquiera de las reivindicaciones 1-12, para utilizar como un medicamento.
14. Composición que comprende un ARNip de acuerdo con cualquiera de las reivindicaciones 1-13, para utilizar en el tratamiento de un trastorno angiogénico, en donde dicho ARNip es un ARNip anti-VEGFR2.
15. Composición que comprende un ARNip de acuerdo con cualquiera de las reivindicaciones 1-12, para inhibir un proceso angiogénico in vitro, en donde dicho ARNip es un ARNip anti-VEGFR2.
16. Composición que comprende un ARNip de acuerdo con cualquiera de las reivindicaciones 1-12, para inhibir un proceso angiogénico, en donde dicho ARNip es un ARNip anti-VEGFR2.
17. Composiciones de acuerdo con cualquiera de las reivindicaciones 13 y 14-16, en donde el medicamento comprende un portador farmacéuticamente aceptable.
18. El ARNip de acuerdo con la reivindicación 7, en donde las dos cadenas son complementarias entre sí, para 19 nucleótidos.
19. El ARNip de acuerdo con la reivindicación 1, en donde un extremo del ARNip tiene el extremo romo.
20. El ARNip de acuerdo con la reivindicación 1, en donde ambos extremos del ARNip tienen el extremo romo.
21. El ARNip de acuerdo con la reivindicación 1, en donde ambos extremos tienen el extremo romo, y las dos cadenas son complementarias entre sí para los 19 nucleótidos.
Patentes similares o relacionadas:
 Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
Compuestos que modulan la actividad de señalización de las interleucinas 17 y 23, del 29 de Julio de 2020, de Sarepta Therapeutics, Inc: Un método ex vivo de modulación de la actividad de señalización de IL-17 en una célula, que comprende poner en contacto la célula con un oligómero antisentido de morfolino […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Terapia mediada por ARN interferente para enfermedades neurodegenerativas, del 24 de Junio de 2020, de Università Degli Studi Di Trento: Agente terapéutico para su uso en el tratamiento de enfermedades neurodegenerativas asociadas con anomalías de la proteína tau codificada […]
Compuestos oligonucleotídicos dirigidos a ARNm de huntingtina, del 3 de Junio de 2020, de UNIVERSITY OF MASSACHUSETTS: Una molécula de ARN que tiene una longitud entre 15 y 35 bases, que comprende una región de complementariedad que es completamente complementaria a 5' CAGUAAAGAGAUUAA 3' […]
Agente de direccionamiento para células cancerosas o fibroblastos asociados con cáncer, del 29 de Abril de 2020, de NITTO DENKO CORPORATION: Composición para su uso en el tratamiento de cáncer en el que están implicados fibroblastos asociados con cáncer, caracterizada porque la composición comprende un portador […]
Lípido catiónico, del 29 de Abril de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto representado por la fórmula: **(Ver fórmula)** donde, W denota la fórmula -NR1R2 o la fórmula -N+R3R4R 5(Z-); R1 y R2 denotan, cada uno de forma independiente, […]
Oligonucleótidos TGF-beta modificados, del 29 de Abril de 2020, de ISARNA Therapeutics GmbH: Oligonucleótido que consiste en CAAAGTATTTGGTCTCC (SEQ ID NO. 46), en el que los nucleótidos en negrita son oligonucleótidos modificados con LNA, complementarios […]