Métodos de expansión de células y usos de células y de medios de acondicionamiento producidos por los mismos para terapia.
Células estromales adherentes de un tejido elegido entre el grupo que consiste en placenta y tejido adiposo para su uso en el tratamiento de
(a) una enfermedad o condición elegida entre el grupo que consiste en pérdida de sangre,
anemia, trastornos autoinmunitarios, diabetes, artritis, esclerosis múltiple, enfermedad del injerto contra el huésped (GvHD), encefalomielitis autoinmunitaria (EAE), lupus eritematoso sistémico (SLE), artritis reumatoide, esclerosis sistémica, síndrome de Sjorgen, miastenia gravis (MG), síndrome de Guillain-Barre (GBS), tiroiditis de Hashimoto (HT), enfermedad de Grave, diabetes mellitus dependiente de la insulina (IDDM) y enfermedad intestinal inflamatoria; o
(b) una condición que puede beneficiarse de la facilitación del injerto de células madre hematopoyéticas en un sujeto,
en donde dichas células estromales adherentes se obtienen de un cultivo tridimensional.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E13164303.
Solicitante: PLURISTEM LTD. .
Nacionalidad solicitante: Israel.
Dirección: MATAM BUILDING 20 31905 HAIFA ISRAEL.
Inventor/es: ABERMAN,ZAMI, MERETZKI,SHAI, BURGER,ORA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- C12N5/073 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos embrionarios; Células o tejidos fetales.
- C12N5/0775 C12N 5/00 […] › Células madre mesenquimales; Células madre derivadas de tejido adiposo.
PDF original: ES-2549528_T3.pdf
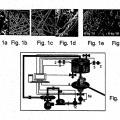


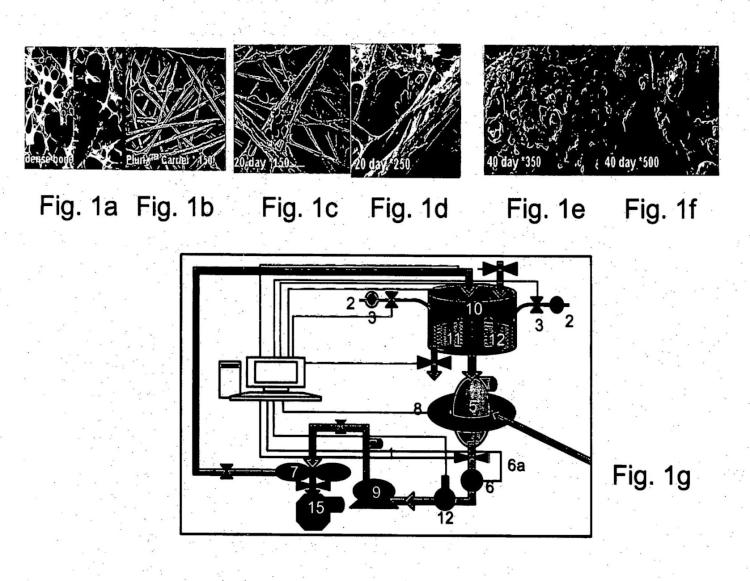
Fragmento de la descripción:
Métodos de expansión de células y usos de células y de medios de acondicionamiento producidos por los mismos para terapia
CAMPO Y ANTECEDENTES DE LA INVENCIÓN.
La presente Invención se refiere a métodos de expansión de células, poblaciones de células producidas por ellos y usos de los mismos. Específicamente, la presente invención se refiere a métodos para la expansión de las células adherentes a partir de placenta o de tejido adiposo (a lo largo de toda la PCT) y usos terapéuticos de las mismas, tales como para trasplante de células madre hematopoyéticas.
En el ámbito médico en desarrollo existe la creciente necesidad de grandes cantidades de células madre adultas destinadas al injerto de células e ingeniería de tejidos. Además, la terapia con células madre adultas se está desarrollando continuamente para el tratamiento y la curación de enfermedades o condiciones diversas, tales como trastornos hematopoyéticos, enfermedades cardíacas, enfermedad de Parkinson, enfermedad de Alzheimer, ictus, quemaduras, distrofia muscular, trastornos autoinmunitarios, diabetes y artritis.
Las células madre hematopoyéticas (HSCs: Hematopoietic Stem Cells) son células precursoras, que dan lugar a todos los tipos de células sanguíneas, tanto del linaje mieloide como del linfoide. El injerto y la iniciación de la hematopoyesis por HSCs trasplantadas dependen de la capacidad de esas células para migrar y proliferar dentro de
la BM del receptor.
Está ampliamente aceptado que las células madre están íntimamente asociadas in vivo con nichos discretos en la médula ósea, que proporcionan señales moleculares que median colectivamente su diferenciación y auto- renovación, a través de contactos célula-célula o Interacciones de corto alcance. Estos nichos son parte del "mlcroentorno Inductivo hematopoyétlco" (HIM), compuesto de células de la médula ósea, es decir macrófagos, fibroblastos, adlpocltos y células endotellales. Las células de la médula ósea mantienen la integridad funcional del HIM proporcionando proteínas de la matriz extra celular (ECM: Extra Celular Matrix) y componentes de la membrana basal que facilitan el contacto célula-célula. También proporcionan varias atocinas solubles o residentes necesarias para la diferenciación y la proliferación controlada de células hematopoyéticas.
Se requiere que las Interacciones entre las HSCs y el estroma preserven la viabilidad de las HSCs y eviten su diferenciación. Después del trasplante de HSCs, las HSCs trasplantadas deben migrar al mlcroentorno de la médula ósea (BM: Bone Marrow) y alojarse en los nichos apropiados antes de proliferar y diferenciarse. Durante el proceso migración, las HSCs trasplantadas salen del torrente sanguíneo y transmigran siguiendo un gradiente de quimiocinas través de la barrera de células endoteliales de la BM para llegara los nichos de destino. Las HSCs del donante debe entonces dirigirse a los nichos hematopoyéticos en donde encuentran un microentorno más favorable para la división de HSCs, y en donde puede ser establecido un continuo contacto físico y químico entre las HSCs y las células mesenquimales, el ECM y los factores de crecimiento segregados. Todos estos procesos implican una serie compleja de moléculas tales como citocinas, quimiocinas, hormonas, esteroides, proteínas de la matriz extracelular, factores de crecimiento, proteínas de interacción célula a célula, proteínas de adhesión, y proteínas matriz.
El número total de células injertadas en los nichos de la BM dedicados sustenta el éxito del trasplante de HSCs. Para lograr el injerto, las HSCs de donantes que son trasplantadas en la circulación sanguínea deben dirigirse a la médula del receptor donde generan focos de hematopoyesis funcional. Se concluye que el número de estos focos es el producto de HSCs totales transfundidas multiplicado por su eficiencia de injerto.
Uno de los mayores problemas implicados con el trasplante de HSCs es la baja tasa de supervivencia de estas células en el sistema aceptor. Está bien documentado que las HSCs trasplantadas por vía intravenosa son eliminadas de la circulación y visualizadas en la BM al cabo de unos minutos después de su transfusión. De tres a cinco horas después del trasplante de HSCs, no se detectan células del donante en la sangre periférica de los receptores [Askenasy et al. 2002 Transplanted hematopoietic cells seed in clusters in recipient bone marrow in vivo, Stem Cells 20: 301 - 10]. La gran mayoría de las células trasplantadas se destruyen poco después de ser transfundidas. En consecuencia, la colonización de la médula del receptor es de baja eficiencia y sólo 1 - 5% de las células transfundidas son detectadas en la BM del receptor 2-3 días después del trasplante [Kerre et al 2001 2001 Both CD34+ 38+ and CD34+ 38- cells home specifically to the bone marrow of NOD/LtSz scid/scid mice but show different kinetics in expansión. J. Immunol. 167: 3692 - 8; Jetmore et al 2.002 2.002 Homing efficiency, cell cycle kinetics, and survival of quiescent and cycling human CD34(+) cells transplanted into conditioned NOD/SCID recipients. Blood. 99: 1585 - 93].
Las células estromales mesenquimales (MSCs: Mesenchymal Stromal Cells) son una población heterogénea de células capaces de diferenciarse en distintos tipos de células mesenquimales maduras. La diferenciación de estas células en células endoteliales reticulares, fibroblastos, adipocitos, y células precursoras osteogénicas depende de la influencia de varios factores bioactivos.
El uso de MSCs para el apoyo del injerto de HSC es conocido en la técnica. Vahas publicaciones han demostrado eficiencias de injerto más altas de HSC cuando se co-trasplantan con células madre mesenquimales [Gurevitch et al. 1999 1999 Transplantation of allogeneic or xerogeneic bone marrow within the donor stromal microenvironment. Transplantation 68: 1362 - 8; Fan et al. 2001 2001 Successful allogeneic bone marrow transplantation (BMT) by injection of bone marroww cells via portal vein: stromal cells as BMT-facilitating cells. [Stem Cells. 19: 144 - 50], También se demostró que el co-trasplante de células madre mesenquimales humanas en un modelo de injerto humano-ovino tuvo como resultado la mejora del injerto a largo plazo de BM quimérica de HSCs humanas en los animales [Almeida - Porada et al. 2000], El co-trasplante de progenitores de células estromales humanas en ovejas fetales preinmunes tuvo por resultado la aparición temprana de células de donante humano en la circulación y eleva los niveles de células en la médula ósea en momentos posteriores después del trasplante [Blood. 95: 3620 - 7], Se encontró que la inyección simultánea de HSC y células madre mesenquimales aceleraba la hematopoiesis [Zhang et al. 2004. Stem Cells 22: 1256 - 62], Recientemente, estos hallazgos se extendieron a un modelo animal más próximo, el mono Rhesus. Cuando se co-trasplantaron células madre HSCs y mesenquimales haplo-idénticas, se demostró un injerto de HSC facilitado [Liu et al. 2005 Zhonghua Xue Ye Xue Za Zhi. 26: 385 - 8]. También se publicó recientemente el uso de células madre mesenquimales para promover el injerto de HSC en sujetos humanos [Koc O. N., J. Clin. Oncol. 2000; 18: 307 - 316; Lazarus H. M., Biol Blood Marrow Transplant. 2005 de mayo; 11 (5): 389 - 98],
Aparentemente, la contribución de las MSCs al injerto hematopoyético reside en la producción de citocinas de apoyo de HSCs que ayudan mediando y equilibrando la migración, auto-renovación y potenciales de compromiso de las HSCs trasplantadas, en la reconstrucción del microentorno hematopoyético dañado que se necesita para la migración y la proliferación de las HSCs y en la inhibición de las células T derivadas del donante, que pueden causar la enfermedad del injerto contra el huésped (GvHD: Graft versus Host Disease), [Charbord P., y Moore, K., Ann. N. Y. Acad. Sci 1044: 159 - 167 (2005); patentes de EE.UU. Nos. 6.010.696; 6.555.374]. Por ejemplo, en un estudio de Maitra, [Maitra B, et al, Bone Marrow Trasplant 33 (6): 597 - 604. (2004)], se encontró que las células madre mesenquimales humanas apoyan a las células madre hematopoyéticas del donante no relacionado y suprimen la activación de las células T en el modelo de ratones NOD-SCID, lo que muestra que las MSCs derivadas de médula ósea humana no relacionada pueden mejorar el resultado del trasplante alogénico.
Un importante obstáculo en el uso de MSCs es la dificultad de aislar grandes cantidades de poblaciones de estas células que se producen de forma natural, aislamiento que es técnicamente difícil y costoso, debido en parte a la cantidad limitada de células. La fuente más obvia de MSCs es la médula ósea, pero el importante malestar implicado en la obtención... [Seguir leyendo]
Reivindicaciones:
1. Células estromales adherentes de un tejido elegido entre el grupo que consiste en placenta y tejido adiposo para su uso en el tratamiento de
(a) una enfermedad o condición elegida entre el grupo que consiste en pérdida de sangre, anemia, trastornos autoinmunitarios, diabetes, artritis, esclerosis múltiple, enfermedad del injerto contra el huésped (GvHD), encefalomielitis autoinmunitaria (EAE), lupus eritematoso sistémico (SLE), artritis reumatoide, esclerosis sistémica, síndrome de Sjorgen, miastenia gravis (MG), síndrome de Guillain-Barre (GBS), tiroiditis de Hashimoto (HT), enfermedad de Grave, diabetes mellitus dependiente de la insulina (IDDM) y enfermedad intestinal inflamatoria; o
(b) una condición que puede beneficiarse de la facilitación del injerto de células madre hematopoyéticas en un sujeto,
en donde dichas células estromales adherentes se obtienen de un cultivo tridimensional.
2. Un medio acondicionado de células estromales adherentes derivadas de un tejido elegido entre el grupo que consiste en placenta y tejido adiposo, para su uso en el tratamiento de una condición elegida entre el grupo que consiste en trastornos autoinmunitarios, artritis, esclerosis múltiple, enfermedad de injerto contra huésped (GvHD), encefalitis autoinmunitaria (EAE), lupus eritematoso sistémico (SLE), artritis reumatoide, esclerosis sistémica, síndrome de Sjorgen, miastenia gravis (MG), síndrome de Guillain-Barre (GBS), toroiditis de Hashimoto (HT), enfermedad de Grave, diabetes mellitus dependiente de la insulina (IDDM) y enfermedad intestinal inflamatoria,
en donde dichas células estromales adherentes se obtienen de un cultivo tridimensional.
3. Las células o el medio para el uso según las reivindicaciones 1a o 2a, que comprenden además administrar células madre.
4. Las células o el medio para el uso según la reivindicación 3a, en donde dichas células madre
comprenden células madre hematopoyéticas, y/o
se administran al mismo tiempo que dicho medio acondicionado o células adherentes, y/o
se administran después de la administración de dichos medio acondicionado o células adherentes.
5. Las células o el medio para el uso según la reivindicación 1a, en donde dicho cultivo tridimensional comprende un biorreactor 3D.
6. Las células o el medio para el uso según la reivindicación 5a, en donde dicho biorreactor se elige entre el grupo que consiste en un biorreactor de flujo pistón, un biorreactor continuo de tanque agitado y un biorreactor de
lecho estacionario.
7. Las células o el medio para el uso según la reivindicación 1a, en donde
dicho cultivo de dichas células se realiza bajo un flujo continuo de un medio de cultivo y/o
dicho cultivo tridimensional comprende un material adherente elegido entre el grupo que consiste en un poliéster, un polialquileno, un polifluorocloroetileno, un pol¡(cloruro de vinilo), un poliestireno, una polisulfona, un acetato de celulosa, una fibra de vidrio, una partícula de cerámica, un matrigel, un componente de matriz extracelular, un colágeno, un poli (ácido L láctico) y una fibra de metal inerte y/o
dicho cultivo se realiza durante al menos 3 días y/o
dicho cultivo se realiza hasta que dichas células adherentes alcanzan al menos un 60% de confluencia y/o
dichas células adherentes comprenden una matriz de expresión de marcador positivo elegida entre el grupo que consiste en CD73, CD90, CD29 y CD105 y/o
dichas células adherentes comprenden una matriz de expresión de marcador negativo elegido entre el grupo que consiste en CD45, CD80, HLA-DR, CD11b, CD14, CD19, CD34y CD79 y/o
dichas células adherentes segregan un nivel de al menos un factor elegido entre el grupo que consiste en SCF, Flt-3 y IL-6 más elevado que el segregado por células adherentes de placenta o de tejido adiposo desarrolladas en un cultivo 2D y/o
dichas células adherentes expresan un nivel de al menos una proteína elegida entre el grupo que consiste en la familia de la histona H2A (H2AF), aldehido deshidrogenasa X (ALDH X), factor de alargamiento de la traducción eucariótica 2 (EEEF2), reticulocalbina 3, dominio de unión de EF-hand calcio (RCN2) y
calponina 1 del músculo liso básica (CNN1), más alto que el segregado por las células adherentes de placenta o tejido adiposo desarrolladas en un cultivo 2D y/o
dichas células adherentes expresan un nivel de expresión de al menos una protema seleccionada entre el grupo que consiste en ribonucleoproteína nuclear heterogénea H1 (Hnrphl), precursor de isoforma 2 de antígeno CD44, 3 fosfoadenosina 5 fosfosulfato sintasa 2 isoforma a (Papss2) y protema ribosomal L7a (rpL7a), más bajo que el expresado por las células adherentes de placenta o de tejido adiposo desarrolladas en un cultivo 2D.
8. Las células o el medio para el uso según la reivindicación 1a, en donde dichas células adherentes o medio 10 se caracterizan por una actividad inmunosupresora más elevada que la de células adherentes de placenta o de
tejido adiposo desarrolladas en un cultivo 2D.
9. Las células o el medio para el uso según la reivindicación 8a, en donde dicha actividad inmunosupresora comprende la reducción de la proliferación de las células T.
10. Las células o el medio para el uso según las reivindicaciones 1a o 2a, en donde dichas células comprenden 15 células que tienen un fenotipo de células madre estromales.
11. Las células o el medio para el uso según la reivindicación 10a, en donde dicho fenotipo de células madre estromales comprende la actividad de supresión de las células T y/o la actividad de soporte de las células madre hematopoiéticas.
Patentes similares o relacionadas:
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Agente profiláctico y/o agente terapéutico para el linfoma difuso de células B grandes, del 17 de Junio de 2020, de ONO PHARMACEUTICAL CO., LTD.: 6-amino-9-[(3R)-1-(2-butinoil)-3-pirrolidinil]-7-(4-fenoxifenil)-7,9-dihidro-8H-purin-8-ona, una sal de la misma, un solvato de la misma o un N-óxido de la misma, […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Método para preparar una célula dendrítica, célula dendrítica preparada mediante el mismo y uso del mismo, del 13 de Mayo de 2020, de JW Creagene Inc: Un método para preparar una célula dendrítica que comprende: cultivar una célula dendrítica inmadura hasta una célula dendrítica madura en presencia de […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Solución de preservación del trasplante basada en polímeros, del 25 de Marzo de 2020, de Kizhakkedathu, Jayachandran: Una solución de preservación del trasplante que comprende un poliglicerol hiperramificado o dendrítico en el que el poliglicerol hiperramificado […]