Vesículas de membranas externas bacterianas mejoradas.
Un proceso para la fabricación de una preparación de vesícula de membrana externa de una bacteria Gramnegativa recombinante que sobreexpresa el inmunógeno 287,
en el que la membrana bacteriana se interrumpe sustancialmente en ausencia de detergente de desoxicolato.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10179782.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS S.R.L..
Nacionalidad solicitante: Italia.
Dirección: VIA FIORENTINA 1 53100 SIENA (SI) ITALIA.
Inventor/es: PIZZA, MARIAGRAZIA, RAPPUOLI, RINO, SERRUTO,DAVIDE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/095 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Neisseria.
- A61K39/104 A61K 39/00 […] › Pseudomonas.
- A61K39/112 A61K 39/00 […] › Salmonella; Shigella.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- C12N1/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Lisis de microorganismos.
PDF original: ES-2520392_T3.pdf

Fragmento de la descripción:
Vesículas de membranas externas bacterianas mejoradas
Campo técnico Esta invención pertenece al campo de la preparación de vesículas para fines de inmunización.
Antecedentes de la técnica Una de las diversas aproximaciones a la inmunización frente a una infección de N. meningitidis es usar vesículas de membranas externas (OMVs) . Una vacuna de OMV eficaz frente al serogrupo B ha sido producida por el instituto Nacional Noruego de la Sanidad Pública [por ejemplo, referencia 1] pero, aunque está vacuna es segura y previene la enfermedad MenB, su eficacia está limitada a la cepa usada para preparar la vacuna.
La vacuna “RIVM” está basada en vesículas que contienen seis subtipos diferentes de PorA y se ha mostrado que es inmunógena en niños en ensayos clínicos de fase II. [2].
La referencia 3 describe una vacuna contra diferentes serotipos patógenos de meningococo del serogrupo B basada en OMV que retiene un complejo de proteínas de 65-kDa. La referencia 4 describe una vacuna que comprende OMV de cepas meningocócicas tratadas por ingeniería genética, en las que las OMVs comprenden: al menos una proteína de membrana externa (OMP) de clase 1 pero que no comprende OMP de clase 2/3. La referencia 5 describe OMVs que comprenden OMPs que tienen mutaciones en sus bucles superficiales y OMVs que comprenden derivados de lipopolisacárido meningocócico (LPS) .
La referencia 6 describe composiciones que comprenden OMVs complementadas con proteínas de unión de transferrina (por ejemplo, TbpA y TbpB) y/o superóxido-dismutasa Cu, Zn. La referencia 7 describe composiciones que comprenden OMVs complementadas con diversas proteínas. La referencia 8 describe preparaciones de vesículas de membranas obtenidas a partir de N. meningitidis con un gen furK modificado.
Además de N. meningitidis del serogrupo B, han sido preparadas vesículas a partir de otras bacterias. La referencia 9 describe un procedimiento para preparar vacunas basadas en OMV para meningococos del serogrupo A. Las referencias 10 y 11 describen vesículas a partir de N. gonorrhoeae. La Referencia 12 describe preparaciones de vesículas a partir de N. lactamica. Han sido preparadas también vesículas a partir de Moraxella catarrhalis [13, 14], Shigella flexneri [15, 16], Pseudomonas aeruginosa [15, 16], Porphyromonas gingivalis [17], Treponema pallidum [18], Hae- mophilus influenzae [19 y 20] y Helicobacter pylori [21].
Un inconveniente de las preparaciones de vesículas bacterianas es que no están presentes agentes protectores importantes. Para retener antígenos como nspA en preparaciones de OMV, la referencia 20 expone que la expresión de NspA debe ser sobrerregulada con una desactivación concomitante de por A y cps. Es un objeto de la invención proporcionar preparaciones de vesículas adicionales y mejoradas, junto con procedimientos para su elaboración. En particular, es un objeto de la invención proporcionar vesículas que retengan componentes inmunógenos bacterianos importantes a partir de N. meningitidis.
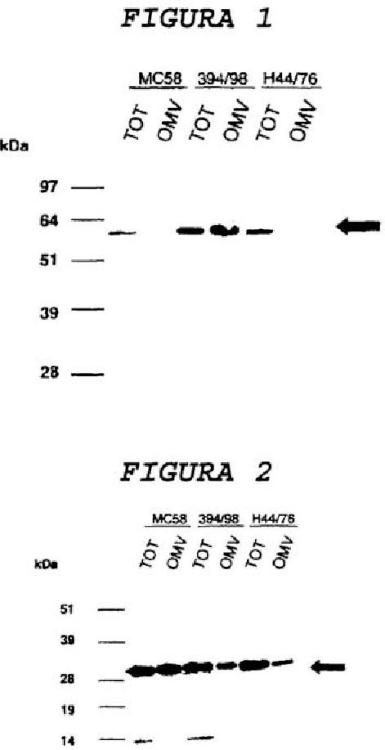
Descripción de la invención Los métodos de la técnica anterior para la preparación de OMV meningocócicos incluyen el uso de un detergente durante la rotura de la membrana bacteriana [por ejemplo, véase la referencia 22, en la que se usa un detergente de desoxicolato]. La invención está basada en el descubrimiento sorprendente de que la rotura de la membrana sustancialmente en ausencia de detergente da lugar a OMVs que retienen importantes componentes inmunógenos bacterianos, particularmente (i) la proteína de superficie de NspA protectora, (ii) la proteína “287” y (iii) la proteína “741”.
Por lo tanto, la invención proporciona un procedimiento para la elaboración de una preparación de vesículas de membranas externas a partir de una bacteria, en la que la membrana de bacteria es rota sustancialmente en ausencia de detergente. Se proporcionan también preparaciones de OMVs que pueden ser obtenidas mediante procedimientos de la invención.
Para la obtención de vesículas de NspA+ve, el procedimiento de la invención es mucho más sencillo que realizar las múltiples manipulaciones genéticas descritas en la referencia 20.
El procedimiento de la invención incluirá normalmente las siguientes etapas básicas (a) tratar células bacterianas en ausencia sustancial de detergente; (b) centrifugar la composición de la etapa (a) para separar las vesículas de las membranas externas de las células tratadas y los restos celulares y recoger la materia sobrenadante; (c) realizar una centrifugación a velocidad elevada de la materia sobrenadante de la etapa (b) y recoger las vesículas de membranas externas en un sedimento; (d) volver a dispersar el sedimento de la etapa (c) en un tampón; (e) realizar una segunda centrifugación a velocidad elevada de acuerdo con la etapa (c) recogiendo las vesículas de membranas externas en un sedimento; (f) volver a dispersar el sedimento de la etapa (e) en un medio acuoso.
El procedimiento puede comprender también las siguientes etapas: (g) realizar una filtración en condiciones estériles a través de al menos dos filtros de tamaño de poros decreciente de la composición nuevamente dispersada de la etapa (f) ; y (h) opcionalmente, incluir la composición de la etapa (g) en un vehículo farmacéuticamente aceptable y/o una composición adyuvante.
La etapa (a) da lugar a vesículas de la membrana externa bacteriana, y las vesículas comprenden generalmente componentes de la membrana externa sustancialmente en su forma nativa. Ventajosamente, son conservados los componentes de membranas de NspA “287” y “741”.
La etapa (b) incluirá normalmente una centrifugación a aproximadamente 5.000-10.000 g durante hasta 1 hora.
Las etapas (c) y (e) incluirán normalmente una centrifugación a aproximadamente 35.000-100.000 g durante hasta 2 hora.
Las etapas de centrifugación son realizadas preferentemente entre 2º C y 8º C.
Puede ser usado cualquier tampón adecuado en la etapa (b) por ejemplo, tampón Tris, tampón de fosfato, tampón de histidina etc. La etapa (f) puede incluir también el uso de un tampón que puede ser el mismo tampón usado en la etapa (d) o puede incluir sencillamente el uso de agua (por ejemplo, agua para inyección) .
La etapa (g) finaliza preferentemente con un filtro con un tamaño de poros de aproximadamente 0, 2 μm.
La invención proporciona también una composición de vesículas de N. meningitidis caracterizada porque las vesículas incluyen (i) proteína de NspA, (ii) proteína “287” y (iii) proteína “741”.
La bacteria La bacteria a partir de la cual son preparadas las OMVs puede ser gram-positiva, pero es preferentemente gram- negativa. La bacteria puede ser del genero Moraxella, Shigella, Pseudomonas, Treponema, Porphyromonas o Helico- bacter, (véase lo que antecede para las especies preferidas) pero es preferentemente del genero Neisseria. Las especies preferidas de Neisseria son N. meningitidis y N. gonorrhoeae. Dentro de la N. meningitidis, puede ser usado cualquiera de los serogrupos A, C, W135 e Y, pero es preferido preparar vesículas a partir del serogrupo B. Las cepas preferidas dentro del serogrupo B son MC58, 2996, H4476 y 394/98.
Para reducir la actividad pirógena, es preferido que la bacteria tenga bajos niveles de endotoxinas (LPS) . Son conocidas bacterias mutantes adecuadas, por ejemplo, Neisseria mutante [23] y Helicobacter mutante [24]. Los procedimientos para preparar membranas externas agotadas en LPS a partir de bacterias gram-negativas se describen en la referencia 25.
La bacteria puede ser una bacteria de tipo salvaje o puede ser una bacteria recombinante. Las bacterias recombi- nantes preferidas sobreexpresan (con relación a la correspondiente cepa de tipo salvaje) inmunógenos como NapA, 287, 741, TbpA, TbpB, superóxido dismutasa [6] etc. La bacteria puede expresar más de una proteína de membrana externa de clase I PorA, por ejemplo, 2, 3, 4, 5 ó 6 de subtipos de PorA: Pl.7, 16; Pl.5, 2; P1.19, 15; P15c, 10; Pl.12, 13; y P1.7h, 4, [por ejemplo, referencias 26 y 27].
El procedimiento de la invención incluirá normalmente una etapa inicial de cultivo de las bacterias, opcionalmente seguida de una etapa de concentración de las células cultivadas.
Rotura de membranas La rotura de membranas para la formación de vesículas es realizada sustancialmente en ausencia de detergente.
En particular, la rotura de membranas puede ser realizada sustancialmente en ausencia de un detergente de desoxicolato, estando presente opcionalmente otros detergentes.
La rotura de membranas puede ser realizada sustancialmente en ausencia de un... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para la fabricación de una preparación de vesícula de membrana externa de una bacteria Gramnegativa recombinante que sobreexpresa el inmunógeno 287, en el que la membrana bacteriana se interrumpe sustancialmente en ausencia de detergente de desoxicolato.
2. El proceso de la reivindicación 1, en el que la membrana bacteriana se interrumpe sustancialmente en ausencia de cualquier detergente.
3. El proceso de la reivindicación 1 o la reivindicación 2, que comprende las siguientes etapas básicas: (a) tratar células bacterianas en ausencia sustancial de detergente; (b) centrifugar la composición de la etapa (a) para separar las vesículas de membrana externa de las células tratadas y los residuos celulares, y recoger el sobrenadante; (c) realizar una centrifugación del sobrenadante de la etapa (b) a alta velocidad y recoger las vesículas de membrana externa en un pellet; (d) redispersar el sedimento de la etapa (c) en un tampón; (e) realizar una segunda centrifugación a alta velocidad según la etapa (c) , recoger las vesículas de membrana externa en un sedimento; (f) volver a dispersar el sedimento de la etapa (e) en un medio acuoso.
4. El proceso de la reivindicación 3, que comprende, además, las etapas siguientes: (g) realizar una filtración estéril a través de, al menos, dos filtros de tamaño de poro decreciente de la composición redispersada de la etapa (f) ; y (h) opcionalmente, incluir la composición de la etapa (g) en un vehículo farmacéuticamente aceptable y / o una composición adyuvante.
5. El proceso de la reivindicación 3 o la reivindicación 4, en el que la etapa (b) comprende una centrifugación a alrededor de 5000 a 10000 g como máximo 1 hora, y los pasos (c) y (e) comprenden una centrifugación a alrededor de 35000 hasta 100000 g como máximo 2 horas.
6. El proceso de cualquiera de las reivindicaciones anteriores, en el que la ruptura de la membrana se lleva a cabo mediante sonicación, homogeneización, microfluidización, cavitación, choque osmótico, trituración, prensa francesa, homogeneización, o cualquier otra técnica física.
7. El proceso de cualquiera de las reivindicaciones anteriores, en el que el tampón usado en la etapa (d) y / o en la etapa (f) es un tampón Tris, un tampón fosfato, o un tampón de histidina.
8. El procedimiento de cualquiera de las reivindicaciones 5 a 7, en el que la etapa (g) finaliza con un filtro de tamaño de poro de alrededor de 0.2 μm.
9. El proceso de cualquiera de las reivindicaciones anteriores en el que la bacteria de la que se preparan las VME es del género Moraxella, Shigella, Pseudomonas, Treponema, Porphyromonas, Helicobacter o Neisseria.
10. El proceso de la reivindicación 9, en el que la bacteria es N. meningitidis o N. gonorrhoeae.
11. El proceso de la reivindicación 10, en el que la bacteria es N. meningitidis del serogrupo B.
12. El proceso de la reivindicación 11, en el que la bacteria es la cepa MC58, 2996, H4476 o 394 / 98.
13. El proceso de cualquiera de las reivindicaciones anteriores, que comprende, además, la etapa de formular una cantidad inmunológicamente eficaz de las VME como una composición inmunogénica.
14. Una composición de VME obtenible por el procedimiento de cualquiera de las reivindicaciones anteriores.
15. La composición de la reivindicación 14, que comprende, además, un adyuvante.
16. La composición de la reivindicación 15, que comprende fosfato de aluminio y / o adyuvante de hidróxido (s) .
17. La composición de cualquiera de las reivindicaciones 14 a 16 para su uso como un medicamento.
18. El uso de una composición de vesículas de membrana externa de cualquiera de las reivindicaciones 14 a 16 en la fabricación de un medicamento para aumentar una respuesta inmune en un paciente.
Patentes similares o relacionadas:
Preparación de vacunas vivas, del 19 de Febrero de 2020, de Elanco Tiergesundheit AG: Las cepas de Campylobacter depositadas con la Colección Alemana de Cultivos Tipo (Deutsche Sammlung von Mikrorganismen und Zellkulturen (DSMZ)) el 27 […]
Vacunas de Salmonella de protección cruzada, del 16 de Octubre de 2019, de INTERVET INTERNATIONAL B.V: Un serovar de Salmonella enterica del serogrupo C1 para su uso en la protección de aves de corral contra un trastorno que surge de una infección por Salmonella enterica del serogrupo […]
Cepas avirulentas modificadas de Salmonella Gallinarum y composición farmacéutica usando las mismas, del 27 de Marzo de 2019, de CJ CHEILJEDANG CORPORATION: Cepas modificadas de Salmonella Gallinarum, que comprenden la eliminación de al menos un clúster de genes completo seleccionado de los siguientes puntos (i) a (iv): […]
Vacuna de LPS, del 16 de Enero de 2019, de KM Biologics Co., Ltd: Una composición de vacuna contra la salmonela para su uso en la inmunización de aves contra la salmonela que comprende como ingrediente activo una […]
Vacuna de toxinas bacterianas, del 29 de Noviembre de 2018, de IDEMITSU KOSAN CO., LTD.: Una proteína híbrida que comprende dos proteínas toxinas seleccionadas del grupo que consiste en proteína toxina Shiga (Stx), proteína toxina del cólera (CT) y […]
Composiciones inmunogénicas que comprenden Lawsonia intercellularis, del 7 de Noviembre de 2018, de BOEHRINGER INGELHEIM VETMEDICA, INC.: Una vacuna de combinación que comprende i) antígeno L. intracellularis eficaz para reducir la incidencia o disminuir la gravedad de la enteropatía proliferativa […]
Exopolisacárido de la bacteria Shigella sonnei, método para producirlo, vacuna y composición farmacéutica que lo contienen, del 22 de Octubre de 2018, de Aparin, Petr Gennadievich: Antígeno polisacarídico de Shigella sonnei, fase I, que consiste en 1-100 unidades de disacáridos repetidos de O- [4-amino-2-(N-acetil)amino-2,4-didesoxi-ß-D-galactopiranosil]-(1→ […]
Vacuna de toxinas bacterianas, del 19 de Octubre de 2018, de IDEMITSU KOSAN CO., LTD.: Una proteína híbrida que comprende (a) dos proteínas toxinas seleccionadas del grupo que consiste en proteína toxina Shiga (Stx), proteína […]